不同体外培养方法对去透明带小鼠胚胎发育的影响
王雅光 高源 秦书俭

[摘要] 目的 探讨不同体外培养方法对小鼠去透明带胚胎发育的影响。 方法 以胚胎各阶段发育率、囊胚率和囊胚细胞数作为衡量指标,对比微滴单卵法、微滴群卵法、微滴单卵+群卵法、mWOW培养法(the modified “well of well” system)四种体外培养方法,探讨不同体外培养方法对去透明带胚胎发育的影响。 结果 mWOW培养法、微滴单卵+群卵法、微滴单卵法这三种方法之间的发育率、囊胚率以及囊胚数均有显著差异(P<0.05)。 结论mWOW法与其他三种方法相比,更适合作为体外培养去透明带小鼠8-细胞以后阶段的方法,以及用于体内移植小鼠胚胎的体外培养方法。
[关键词] 胚胎培养技术; 胚胎发育; mWOW法
[中图分类号] Q954.4 [文献标识码] A [文章编号] 1673-9701(2015)16-0018-03
[Abstract] Objective To investigate the effects of different culture methods in vitro mouse zona-free embryonic development. Methods In various stages of embryonic development rate,blastocyst rate and cell numbers of blastocysts developed were measured as mWOW system (the modified “well of well” system), micro-drops single + group, micro-drops single and micro-drops group culture in vitro. The effects of different methods of were compared in vitro embryo development zona-free. Results Embryonic development rate, blastocyst rate and cell numbers of blastocysts developed were significantly higher in mWOW system culture than micro-drops single + group, micro-drops single and micro-drops group culture. Conclusion Compared with micro-drops single + group,micro-drops single and micro-drops group culture,mWOW system method is more suitable for zona-free cultured in vitro mouse embryos.
[Key words] Embryo culture techniques; Embryonic development;mWOW method
现阶段,体外培养去透明带小鼠胚胎已经成为研究早期胚胎发育机制、制备转基因小鼠等科学研究领域中的重要环节。但是由于去透明带后的胚胎容易因为黏附聚集的问题发育延迟或者停止,影响囊胚率和囊胚质量。因此,有学者[1]提出如要推动慢病毒感染去透明带胚胎技术的发展,需要考虑的是如何完善去透明带胚胎体外培养系统。
目前,去透明带胚胎体外培养方法主要有微滴单卵法、微滴群卵法、微滴单卵+群卵法、mWOW培养法。本实验将通过这四种方法对比来培养去透明带胚胎并观察其发育情况,通过对每个阶段囊胚细胞个数、囊胚率以及发育率的检测,来讨论四种体外培养方法对去透明带胚胎发育的影响。
1 材料与方法
1.1 实验动物及主要试剂
本实验于2011年3月~2012年3月完成。由辽宁医学院实验动物中心提供的4~6周龄的SPF级昆明小鼠,PMSG购自郑州华畜动物制药厂,FHM操作液、KSOM培养液购自Jibco公司,人绒毛促性腺激素、石蜡油、透明质酸酶、链酶蛋白酶、PVP均购自Sigma公司。
1.2 方法
1.2.1 超数排卵 取已适应本鼠舍光照周期(内源LH释放时间受光照周期的调控)的昆明小鼠,进行超数排卵的时间为下午1时,注射PMSG,过48 h后注射hCG(注射方法均经腹腔,剂量均为10 IU/只),然后将雌雄(2∶1)合笼,次日上午通过检查阴道栓方式确定受精母鼠。
1.2.2 去除卵丘细胞及透明带 经阴道栓检查确定受精的母鼠颈椎脱臼处死,在无菌条件下快速取出输卵管及靠近输卵管部分的子宫,放置在FHM操作液里。镜下取出合子团,然后将其放入含有透明质酸酶(浓度为0.3 mg/mL)的FHM操作液里,将卵丘细胞吹打脱落以后,再将重新收集的合子放入准备好的FHM操作液里,继续洗去杂质、透明质酸酶以及残留的卵丘细胞等。最后在链酶蛋白酶液(浓度为0.5%)中放入洗涤好的合子,同时镜下观察透明带,待其溶解后,再迅速放入新鲜的FHM操作液中清洗,之后再经KSOM培养液洗涤。
1.2.3 实验分组及培养 将收集的去透明带合子,根据实验设计分为四组,A:微滴单卵培养组;B:微滴群卵培养组;C:微滴单卵+群卵培养组;D:mWOW培养组。
微滴单卵培养组:将用KSOM-AA培养液做的20个2 μL的微滴滴在35 mm的培养皿(塑料无菌)上,待2 h后将每个微滴里放入1枚合子,放于37℃、5%CO2培养箱中培养。
微滴群卵培养组:将用KSOM-AA培养液做的1个3 μL的微滴滴在35 mm的培养皿(塑料无菌)上,所有微滴用石蜡油覆盖,待2 h后每个微滴里放入20~25枚合子,放于37℃、5%CO2培养箱中培养。
微滴单卵+群卵培养组:观察待微滴单卵培养方法体外培养出来的胚胎基本已经完全发育到8-细胞阶段,此时开始进行群体的培养,移动时使用移卵管,以减少胚胎的损伤。
mWOW培养组:按照Pereira等[2]制作mWOW孔的方法,将针头加热后在35 mm无菌塑料培养皿上20个孔(孔深0.2 mm、直径0.3 mm左右),之后打完孔的培养皿用KSOM和DDW培养液洗涤使孔中的杂质清除。所有的mWOW孔先用400 μL KSOM培养液滴覆盖,然后KSOM培养液滴上再覆盖一层薄薄的石蜡油。待2 h后将每个mWOW孔里放置一枚合子,放于37℃、5%CO2培养箱中培养。
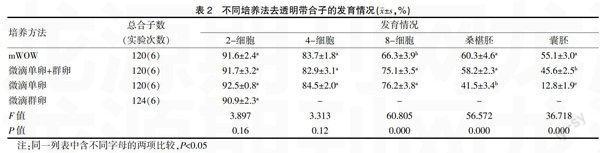
本实验重复培养6次,随机将484枚合子(去透明带)分成四组;即微滴单卵组合子数为120枚、微滴群卵组合子数为124枚、微滴单卵+群卵组合子数为120枚、mWOW组合子数为120枚,四个组用相同的培养皿和培养液培养。2-细胞、4-细胞、8-细胞、桑椹胚以及囊胚发育情况的检测时间,分别是在培养到20 h、40 h、52 h、64 h、88 h。取出的囊胚经过染色计算囊胚细胞数。见表1。
1.3 统计学处理
采用SPSS17.0统计学软件进行数据分析,计量资料以(x±s)表示,采用析因方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 不同体外培养方法培养去透明带合子后的发育情况
由于去透明带后的合子黏性增加粘连而使微滴群卵法只能在2-细胞阶段统计发育情况,其他各阶段都无法进行统计;其他三种方法均能进行发育率的计算。在2-细胞发育阶段四种方法之间发育率差异无统计学意义(P>0.05);在4-细胞发育阶段微滴单卵法、微滴单卵+群卵法、mWOW法之间的发育率差异无统计学意义(P>0.05);在8-细胞发育阶段微滴单卵法与微滴单卵+群卵法发育率相比较没有明显的差异(P>0.05),而两组均高于mWOW培养法的发育率,并且差异有统计学意义(P<0.05);在桑葚胚发育阶段mWOW法和微滴单卵+群卵法的发育率比较没有明显差异(P>0.05),但是两组的培养率均高于微滴单卵培养法的发育率,并且差异有统计学意义(P<0.05)。见表2。
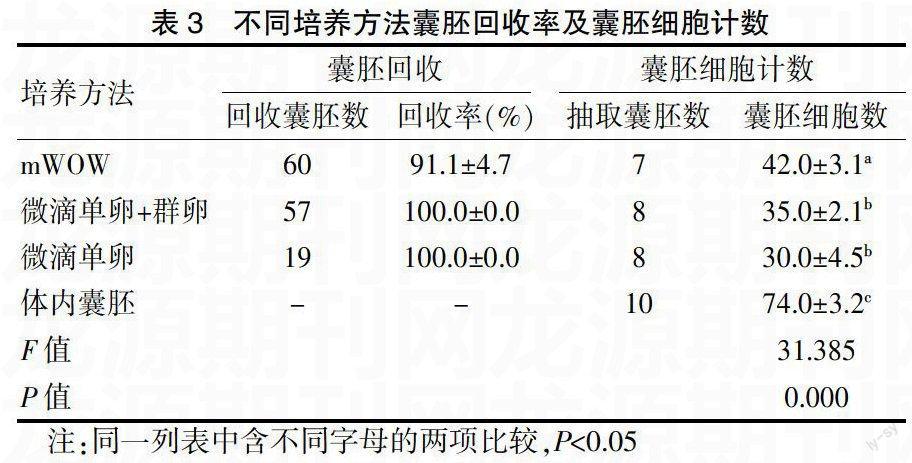
2.2不同培养方法得到的囊胚回收率及囊胚计数情况
从囊胚回收率的结构上看微滴单卵法和微滴单卵+群卵法囊胚均是100%的回收率,与mWOW法的囊胚回收率相比有显著统计学意义(P<0.05);微滴单卵法、微滴单卵+群卵法和mWOW法三种方法得到的囊胚细胞数与体内囊胚的细胞数相比有显著统计学意义(P<0.05)。群卵法和微滴单卵法与单纯的微滴单卵培养方法相比较得到的囊胚的细胞数没有明显的差异(P>0.05),但是这两种培养方法培养的囊胚细胞数与mWOW培养方法相比有显著的统计学意义(P<0.05)。见表3。
3 讨论
微滴培养法是传统小鼠胚胎体外培养方法[3],也是培养去透明带胚胎的常用方法。经过多年发展,人们通过对微滴法进行改进,发明了微滴群卵法等诸多培养方式,以期进一步优化胚胎体外培养系统。但是,各种[4]改进方法虽然能够发挥群体培养优势,通过缩小胚胎间距来促进胚胎发育[5],但是去透明带胚胎相互黏连、聚合,导致无法继续发育的问题无法解决。2000年Vajta等[6]发现WOW体外培养去透明带的方法不但培养效率高,而且操作方法比较简单。近年来,也有人相继报道应用这一方法成功培养了单个胚胎,并且胚胎发育率及移植后妊娠率均显著高于微滴法[7],后来又有研究发现[8]单个胚胎的培养效果并不如群体的培养。2005年Daniela等[9]将WOW培养法进行了改进,因而有了mWOW培养方法,该方法是用一个400 μL的微滴覆盖大约40左右个V形孔,改善了原来的一个微滴覆盖一个V形孔的方法。这种方法不但解决了透明带黏连问题还增强了胚胎之间的自分泌/旁分泌因子对胚胎发育的促进作用[10],并且这种培养去透明带胚胎的方法优于WOW法也得到了证实[11]。
四种方法结果进行对比分析:mWOW法除8-细胞阶段发育率、囊胚回收率低于微滴单卵+群卵法和微滴单卵法,其他各阶段mWOW法均显著高于其他两种方法,由于微滴群卵培养法因透明带合子粘连无法进行统计将其除外。由于体外培养环境与体内培养环境不同,由于桑椹胚在体外经过短时间的发育就能形成胚囊,所以要求体外培养时间相对而言越短越好。所以选择进行体外培养桑葚胚减少胚胎发育的损失进而会提高胚囊率。与8-细胞早期的胚胎比较致密化的桑椹胚的结构空间更稳定、胚胎更强韧,从而能尽可能地减少mWOW法对8-细胞期胚胎发育的不良影响。mWOW法的V形孔不但可以抑制有害因子的释放,而且还能够在一定程度上避免细胞因子的扩散[12]。综上,mWOW法更适合作为体外培养去透明带小鼠胚胎的方法。
[参考文献]
[1] 刘勤,张晋宇,王露露,等. 慢病毒载体介导的增强型绿色荧光蛋白转基因小鼠的建立[J]. 第三军医大学学报, 2008,30(10):885-889.
[2] Pereira DC,Dode MA,Rumpf R. Evaluation of different culture systems on the in vitro production of bovine embryos[J]. Theriogenology,2005,63(4):1131-1141.
[3] 陈绍威,梁冠男,毛熙光,等. 小鼠体外受精胚胎发育的研究[J]. 泸州医学院学报,2012,35(2):130-132.
[4] Bedzhovl,Graham SJ,Leung CY,et al. Developmental plasticity,cell fate specification and morphogenesis in the early mouse embryo[J]. Philos Trans R Soc Lond B Biol Sci,2014,369 (1657):59-61.
[5] Somfai T,Inaba Y,Aikawa Y,et al. Culture of bovine embryosin polyester mesh sections:the effect of pore size and oxygen tension on in vitro development[J]. Reprod Domest Anim,2010,45(6):1104-1109.
[6] Vajta G,Peura TT,Holm P,et al. New method for culture of zona-included or zona-free embryos: the Well of the Well (WOW) system[J]. Mol Reprod Dev,2000,55(3):256-264.
[7] Sugimura S,Akai T,Somfai T,et al. Time-lapse cinematogra-phy compatible polystyrene-based microwell culture system:a novel tool for tracking the development of individual bo-vine embryos[J]. Biol Reprod,2010,83(6):970-978.
[8] Lee YL,Lee KF,Xu JS,et al. Embryotrophic factor-3 from human oviductal cells affects the messenger RNA expression of mouse blastocyst[J]. Biol Reprod,2003,68:375-382.
[9] Daniela CP,Dode MA,Rumpf R. Evaluation of different culture systems on the in vitro production of bovine embryos[J]. Theriogenology,2005,63:1131-1141.
[10] Gambini A,De Stefano A,Bevacqua RJ,et al. The aggregation of four reconstructed zygotes is the limit to improve the developmental competence of cloned equine embryos[J]. Plos One,2014,9(11):e110998.
[11] Krisher RL,Wheeler MB. Towards the use of microfluidicsfor individual embryo culture[J]. Reprod Fertil Dev,2010,22(1):32-39.
[12] Thompson JG. Culture without the petri-dish[J]. TheriOgenology,2007,67:16-20.
(收稿日期:2015-03-25)

