不同培养条件对香石竹组培苗玻璃化现象的影响
张玉园 杜清叶
[摘 要] 香石竹茎尖试管苗继代培养玻璃化现象是香石竹脱毒试管苗生产的一个主要障碍。为探讨不同培养条件对香石竹组培苗玻璃化的影响,以香石竹健壮组培苗为材料,以MS为基本培养基,研究了不同浓度6-BA、蔗糖和琼脂以及添加活性炭对防止香石竹组培苗玻璃化现象的作用。结果表明,降低6-BA的浓度,适当提高蔗糖和琼脂的浓度,组培苗增殖系数较高,玻璃化率低。其中,MS+蔗糖30.0 g+琼脂8.0 g+6-BA 0.5 mg/L+ NAA 0.01 mg/L+活性炭4 g/L的培养基可以有效降低香石竹组织培养中的玻璃化现象。
[关键词] 香石竹 继代培养 玻璃化
Abstract: Vitrification is the main obstacle in subculture of carnation plantlets in vitro,which were induced from shoot tips. In order to study the influence of different culture conditions on the carnation somaclone vitrification, with robust carnation somaclone as material, taking MS as the basic culture medium, the effects of different concentrations of 6-BA, sugar and agar and active carbon added on prevention of carnation plantlets vitrification phenomenon were tested. The results showed that low concentration of 6-BA and properly increasing the concentration of sugar and agar, in which somaclone multiplication coefficient is higher and the vitrification rate is low. Therefore, medium with MS+sucrose 30.0 g+agar 8.0 g+6-BA 0.5mg/L+NAA 0.01mg/L+ activated carbon 4 g/L can effectively prevent carnation vitrification in tissue culture.
Key words: Carnation, Subculture, Vitrification
[中图分类号] S681.5 [文献标识码] A [文章编号] 1003-1650 (2015)11-0090-02
香石竹(Dianthus caryophyllus L.),石竹科石竹属,原产于欧洲南部,现世界各地广泛栽培,我国上海、北京、广州等地区栽培面积较大。香石竹单朵花期较长,花朵雍容富丽,色彩绚丽娇艳,耐瓶插,宜制作花束、花篮,观赏价值极高,是世界著名的四大切花之一[1]。传统生产香石竹主要依靠扦插、分株繁殖,但难以达到大量快速繁殖的目的,并且经过多代繁殖的植株在这种长期营养繁殖过程中,体内会积累大量的病毒原,极易受到病毒侵染,使种源不断退化,严重影响植株的健壮生长[2,3]。近年来我国香石竹组织培养和快速繁殖技术研究开展较早,取得了不少研究成果[4]。然而,尽管香石竹获得再生比较容易,但其再生苗比较纤弱、易发生玻璃化,在植物组织培养中组培苗玻璃化现象及其容易发生,已报道的植物多达70种[5]。由于玻璃苗的组织结构和生理功能异常,故增殖系数低,生根较难,移栽大田难以成活,是植物组织培养的一大难题[6-8]。如何改进培养技术克服玻璃化等问题,是其研究和需克服的难点。
本研究以生长健壮的正常茎尖组培苗为材料,采用单因素随机变量法,初步研究6-BA、琼脂、蔗糖、活性炭等不同组培条件下对茎尖组培苗继代培养过程中玻璃化现象发生的情况,以期为获得大量的香石竹试管苗及改善其质量奠定理论基础。
1 材料与方法
1.1 材料
材料为健壮的香石竹组培苗。
1.2 方法
1.2.1 试验处理
取健壮的香石竹组培苗,以MS为基本培养基,pH值为5.8~6.0,每处理接种20瓶,每瓶3株苗,重复3次,接种后放置在光照强度为: 1000~2000 lx;光照时数12 h/d;培养在(25±1)℃的恒温培养箱中进行培养30 d。
试验在基本培养基上分别设置下列4种处理,并对各因子进行探讨,探讨加入不同量的各因子对香石竹的玻璃化现象的影响,各处理设置如下:
1.2.1.1 6-BA浓度对组培苗玻璃化的影响。 基本培养基:MS+NAA 0.01 mg/L+蔗糖30 g/L+琼脂8.0 g/L;6-BA 浓度分为5个水平:0、0.2、0.5、1.0、2.0 mg/L。
1.2.1.2琼脂用量对组培苗玻璃化的影响。 基本培养基: MS+6-BA 0.5 mg/L+NAA 0.01 mg/L+蔗糖30.0 g/L琼脂浓度分为4个水平:4.0、6.0、8.0、10.0 g/L。
1.2.1.3蔗糖浓度对组培苗玻璃化的影响。 基本培养基: MS+6-BA 0.5 mg/ L+NAA 0.01 mg/L+琼脂8.0 g/L; 蔗糖处理浓度分为5个水平:10.0、20.0、30.0、40.0 、50.0 g/L。
1.2.1.4活性炭对组培苗玻璃化的影响。 培养基为: MS+6-BA 0.5 mg/L+NAA0.01 mg/L+蔗糖30.0 g/L+ 琼脂8.0g/L;活性炭处理浓度分为4个水平:0、2.0、4.0、6.0 g/L
1.2.2 记录结果
接种30 d后观察组培苗的生长状况,统计组培苗的玻璃化情况,获得的试验数据进行分析,玻璃化率按照下列方法进行计算:
玻璃化率%=玻璃化苗数/分化数×100%
1.2.3 数据分析
试验结果数据采用Microsoft Excel 2013软件进行统计;用DPS统计软件进行方差分析和Duncans多重比较分析差异显著性。
2 结果与分析
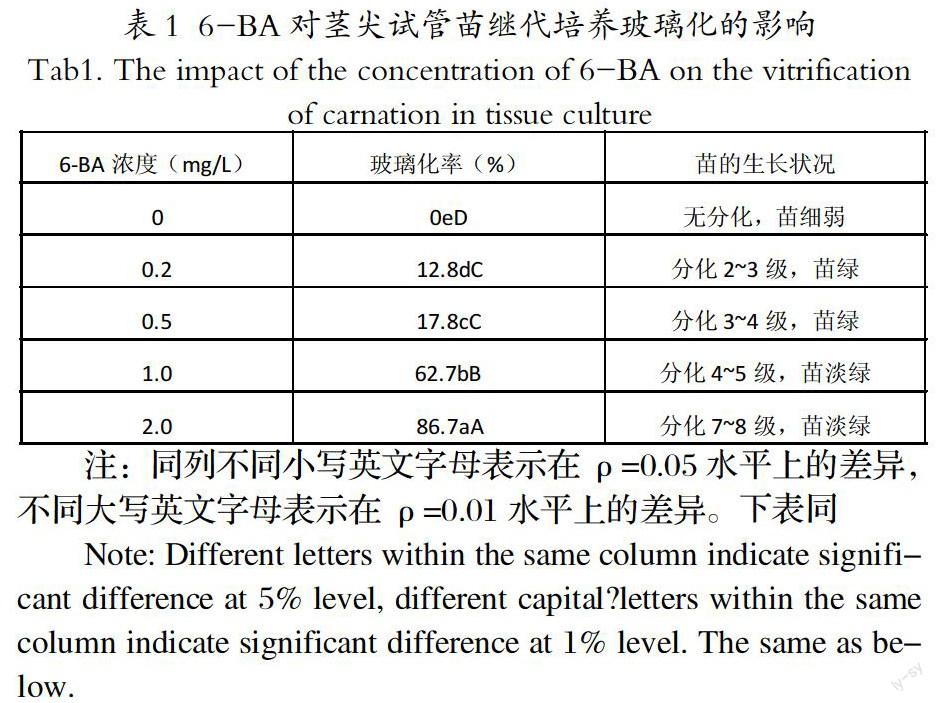
2.1 6-BA对茎尖组培苗继代培养玻璃化的影响
由表1中可知,在添加0.01 mg/L NAA的培养基中附加不同浓度的6-BA,6-BA对香石竹组培苗玻璃化的影响非常显著。随着6-BA浓度的增加,玻璃化苗数随之增加,6-BA浓度与玻璃化苗数呈正比例关系。当培养基中不含6-BA时,香石竹无玻璃化现象,但组培苗不分化,生长点生长缓慢,成苗率极低。添加0.2、0.5、1.0、2.0 mg/L的6-BA组培苗的玻璃化率分别为12.8%、17.8%、62.7%和86.7%,与不添加6-BA的玻璃化率差异均达到0.01显著水平。在6-BA浓度为0.2 mg/L和0.5 mg/L时,玻璃化率相差不大,苗的长势都表现良好,叶色浓绿,茎秆健壮,但6-BA浓度为0.5 mg/L时,苗的分化率略高;当6-BA浓度提高到 l.0 mg/L和2.0 mg/L时,组培苗的玻璃化率明显升高,苗分化较多但叶片多表现为水浸状,叶色较淡。综上考虑,6-BA浓度为0.5 mg/L比较适宜。
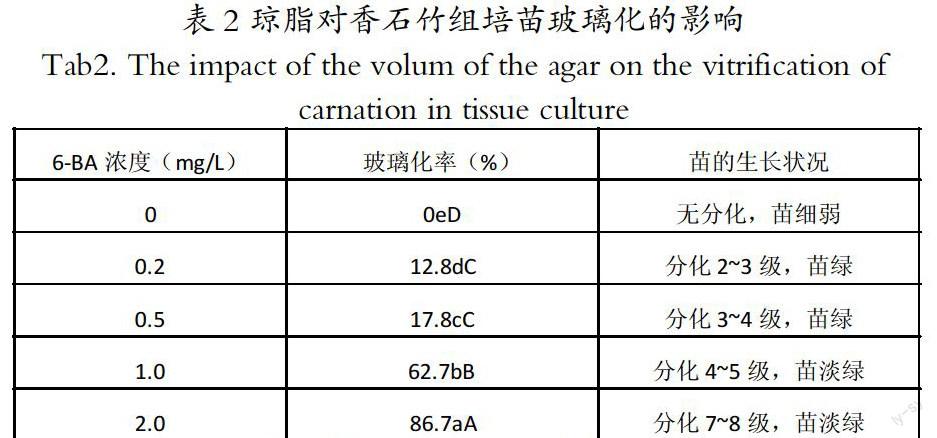
2.2 琼脂对香石竹组培苗玻璃化的影响
由表2可知,随着琼脂浓度的递增,香石竹的玻璃化率逐渐降低。6.0、8.0、10.0 g/L的琼脂浓度对香石竹的玻璃化较4.0 g/L琼脂都有抑制作用,差异均达到0.01显著水平。琼脂浓度为4.0g/L时组培苗玻璃化率最高,达到43.9%,组培苗生长较快,叶色微黄;在培养基中添加10.0 g/L的琼脂时,玻璃化率最低,为零,能有效降低组培苗的玻璃化,但组培苗生缓慢,叶绿色。适量增加琼脂浓度对克服玻璃苗有明显效果,但过高浓度的琼脂往往影响组培苗对矿质元素的吸收,不利于组培苗的生长,试验结果培养基中以附加8.0 g/L琼脂比较适宜,此时玻璃化率比较低,为24.5%,苗生长正常,叶色浓绿。
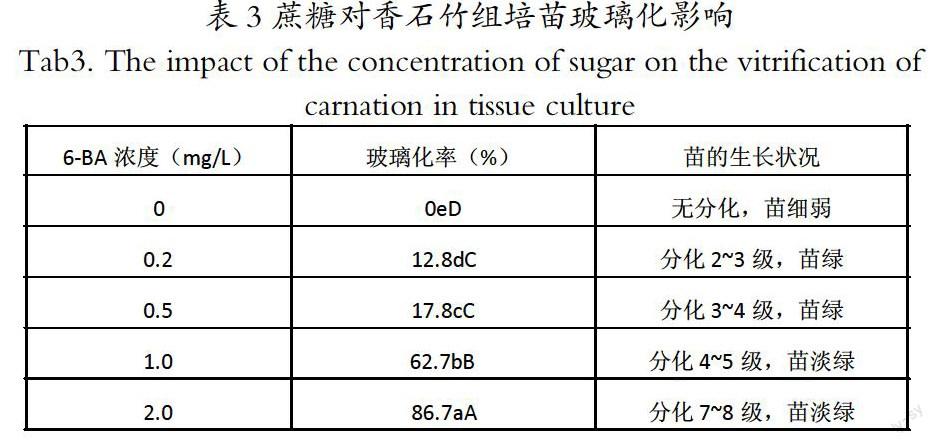
2.3 蔗糖对香石竹组培苗玻璃化影响
由表3可知,香石竹的玻璃化率随着蔗糖浓度的增加,呈明显递增趋势。10.0、20.0 g/L蔗糖下的玻璃化率分别为27.2%、26.7%,差异不显著,但组培苗的生长势较差,当蔗糖浓度为10.0 g/L时,组培苗的叶色发黄,茎尖出现坏死现象;蔗糖浓度为30.0 g/L时,玻璃化率最低,为20.0%,与其他四种浓度处理的结果均达到0.01显著水平,苗长势健壮,叶色绿;30.0~50.0 g/L时,玻璃化率明显提高;当蔗糖浓度在50.0 g/L时,玻璃化率达到了52.2%,达到0.01显著水平,此时组培苗生长势变差,叶色发黄,茎尖坏死现象较多。从本试验结果看出,在培养基中添加30.0g/L的蔗糖时,能有效改善组培苗的质量。
2.4 活性炭(AC)对组培苗玻璃化的影响
从表4中可以看出,在培养基中添加活性炭可有效地降低组培苗的玻璃化现象的发生。在未添加活性炭的培养基(作对照)中,组培苗玻璃化率高,达到69.4%,与添加活性炭的培养基相比,差异显著,均达到0.01显著水平,同时组培苗分化略少,苗淡绿;而加入AC后,随着AC浓度的升高,玻璃化率与对照相比显著降低,差异均达到0.01显著水平,同时苗分化较多。4.0、6.0g/L AC对组培苗玻璃化的抑制强度高,分别为39.4%、38.3%,比未添加AC分别降低了30.0%、31.1%,但两者之间没有显著差异,同时6.0 g/L浓度下的苗分化较多,且较绿,是抑制组培苗玻璃化的适宜浓度。
3 讨论与结论
香石竹组织培养中出现的玻璃化现象是许多因素综合作用的结果,因此,在生产实践中应该综合考虑各方面因素,选择最佳的培养条件。6-BA对香石竹组培苗玻璃化现象发生的影响最为显著, 增加培养基中6-BA的浓度,组培苗的玻璃化率有明显的提高,这与赵佐敏[9]对非洲菊和王小敏[10]等对薄荷的研究结果相一致。综合考虑增殖系数的因素,6-BA浓度应以0.5 mg/L为宜,在此条件下,香石竹的增殖系数最高,玻璃化苗率较低。
琼脂在培养基中不仅具有支撑组培苗平衡的作用,也影响培养基中可利用的水分[11]。琼脂浓度较低时,培养基中可利用水分过多,不利于培养基中的渗透压平衡,影响苗的生长和分化,新生的幼苗呈水浸状,导致玻璃化现象严重;琼脂浓度过高,培养基内可利用水分少,营养物质难以被培养的组织吸收利用,芽分化力减弱,增殖系数较低[12]。结合成本等因素,在香石竹组织培养中,琼脂的浓度可选择8.0 g/L。
植物细胞脱分化、再分化及器官的形成受培养基渗透压的影响,而蔗糖的浓度对培养基的渗透压起决定性作用,适当提高蔗糖的浓度,降低培养基的渗透势,从而降低玻璃化率,从本试验结果可知:培养基中附加蔗糖的浓度为30 g/L时,香石竹组培苗生长最好。
活性炭具有吸附能力,在培养基中加入适量的活性炭能减少一些有害物质的影响[13-16]。相同激素浓度条件下,附加活性炭的培养基与未附加活性炭的培养基相比,其组培苗玻璃化率明显降低,差异显著。任东植[17]等研究表明,高浓度的6-BA对玻璃化现象的发生有一定的促进作用,活性炭可以吸附培养基中生长调节剂,降低 6-BA的实际作用浓度,从而降低组培苗的玻璃化率。
综合试验结果,并考虑培养成本及培养周期等因素,确定以MS为基本培养基,附加0.5 mg/L 6-BA、30 g/L蔗糖、8.0 g/L琼脂的条件下进行培养,香石竹组培苗的增殖系数正常,组培苗的玻璃化率较低。本试验中的植物生长调节物质6-BA、琼脂、蔗糖和活性炭等对克服香石竹玻璃化虽然表现出一定的规律,但试验中设置的各处理因子的浓度梯度及不同处理因子之间的互作影响还需要进一步探究优化,以期能够得出最佳的培养基组分,为生产上提供参考,同时为玻璃化现象的控制和苗质的调控提供依据理论依据。
参考文献
[1]周长东. 香石竹组培快繁技术的研究[J]. 山西林业科技, 2005(2): 10-12.
[2]李瑶, 王利华, 叶鸣明, 等. 影响香石竹试管苗玻璃化的因素[J]. 植物生理学通讯, 1997, 33(4): 256-258.
[3]郭达初. 培养基对香石竹试管苗生长及其玻璃化的影响[J]. 浙江农业学报. 1990(2): 174-180.
[4]熊丽, 吴丽芳. 观赏花卉的组织培养与大规模生产[M]. 北京: 化学工业出版社, 2003: 103-108.
[5]袁凤杰, 俞琦英, 朱申龙. 菜用大豆品质和产量性状的评述[J]. 浙江农业科学, 2001(1): 1-3.
[6]郝瑞庆, 扬广东. 大白菜试管苗玻璃化发生机理初探[J]. 中国农学通报, 2002, 18(3): 45-47.
[7]肖玉兰, 仇明华. 克服香石竹试管苗玻璃化现象的研究 [J]. 云南农业大学学报, 1997, 12(3): 188-193.
[8]廖飞雄, 王代容, 徐维杰, 等. 香石竹试管苗培养性状及与玻璃化发生关系分析[J]. 江西农业大学学报, 2005, 27(6): 836-838.
[9]赵佐敏. 非洲菊组培苗玻璃化控制的研究初报[J]. 贵州农业科学, 2005, 33(3): 77.
[10]王小敏, 李维林, 赵志强, 等. 不同培养条件对薄荷试管苗玻璃化现象的影响[J]. 植物资源与环境学报, 2006, 30(3): 51-54.
[11]刘璐.香蜂花离体培养及其挥发油成分的GC-MS分析[D]. 福州:福建农林大学, 2008.
[12]何芳兰,李毅,赵明.影响高山杜鹃试管苗玻璃化的几个因素研究[J]. 西北林学院学报, 2008, 23(1): 104-107.
[13]张红, 王万新. 香石竹组培中的玻璃化现象及防止[J]. 北方园艺, 2008(8): 196-197.
[14]刘用生, 李友勇. 植物组织培养中活性炭的使用[J]. 植物生理学通讯, 1994(3): 214-216.
[15]卜学贤, 陈维伦. 活性炭对培养基中调节物质的吸附作用[J]. 植物生理学报, 1988, 14(4): 401-404.
[16]沈宁东, 郭辉, 韦梅琴. 活性炭对香石竹试管苗继代培养的影响[J]. 安徽农业科学, 2009, 37(3): 979-980.
[17]任东植, 李峰, 曲运琴, 等. 影响枣组培苗玻璃化的几个因素及其防治[J]. 植物生理学通讯, 2000, 36(2): 21-23.

