糖尿病大鼠尿道α1受体和NGF/ProNGF异常表达的研究
冯小迪 冀明 史本康


【摘要】 目的:研究雌性糖尿病大鼠尿道中α1受体和NGF/proNGF的表达,探讨糖尿病尿道功能障碍的发病机制。方法:利用膀胱尿道同步测压检测尿道舒张功能,分别用RT-qPCR、ELISA和Western blotting检测糖尿病大鼠尿道中α1受体、NGF、proNGF和P75NTR受体基因及蛋白的表达水平。结果:糖尿病组膀胱内压(BP)最高值低于对照组,比较差异有统计学意义(P<0.05)。糖尿病组大鼠最小尿道充盈压(UPP)高于对照组,应用α1受体拮抗剂坦索罗辛后UPP基线低于用药前,比较差异均有统计学意义(P<0.05)。糖尿病组α1A和α1D基因及蛋白表达水平均高于对照组;糖尿病组NGF基因及蛋白表达水平均低于对照组,同时proNGF蛋白表达水平高于对照组,导致NGF/proNGF比值降低;糖尿病组P75NTR基因及蛋白表达水平均低于对照组,以上比较差异均有统计学意义(P<0.05)。两组sortilin蛋白表达水平比较,差异无统计学意义(P>0.05)。结论:α1受体的高表达和NGF/proNGF比值降低可能在糖尿病尿道功能障碍的发病过程中起着重要作用,应用α1受体拮抗剂可以改善尿道功能。
【关键词】 糖尿病大鼠; α1受体; NGF; proNGF; P75NTR受体; 尿流动力学
【Abstract】 Objective:To investigate the expression of α1-adrenoceptor and NGF/proNGF in the urethra of diabetic rats and to explore the pathogenesis of urethra dysfunction of diabetes.Method:The urethral diastolic function was determined by bladder urethral pressure measurement.The expression levels of gene and protein of α1-adrenoceptor,NGF,proNGF and P75NTR in the urethra of diabetic rats were measured by using real-time quantitative polymerase chain reaction(RT-qPCR),enzyme-linked immunosorbent assay(ELISA) and Western blotting.Result:The maximum value of intravesical pressure in the diabetic group was lower than that in the control group,the difference was statistically significant(P<0.05).The lowest urethral pressure(UPP) of the diabetic group was higher than that of the control group,the base line of UPP after the usage of Tamsulosin(α1-adrenoceptor antagonist) was lower than that before the drug use,the differences were statistically significant(P<0.05).The expression levels of gene and protein of α1A and α1D in the diabetic group were higher than those in the control group,the expression levels of gene and protein of NGF in the diabetic group were lower than those in the control group,but the protein expression level of proNGF in the diabetic group was higher than that in the control group,which made the specific value of NGF/proNGF lower,the expression levels of gene and protein of P75NTR in the diabetic group were lower than those in the control group,the differences above were all statistically significant(P<0.05).The difference in the protein expression level of sortilin between the two groups was not statistically significant(P>0.05).Conclusion:The high expression of α1-adrenoceptor and the reduction of NGF/proNGF value may play an important role in the pathogenic process of urethra dysfunction of diabetes,the application of α1-adrenoceptor antagonist can effectively improve the urethra function.
【Key words】 Diabetic rats; α1-adrenoceptor; NGF; proNGF; p75NTR; Urodynamics
First-authors address:Hiser Medical Group of Qingdao City,Qingdao 266033,China
doi:10.3969/j.issn.1674-4985.2015.35.001
糖尿病膀胱病变主要以膀胱感觉受损、膀胱容量增加、逼尿肌收缩力受损和残余尿量增加为特点,上述损害主要归咎于糖尿病导致的外周神经病变[1-4]。与糖尿病膀胱功能障碍相比,糖尿病尿道功能障碍的发病机制阐述不够明确,之前的研究主要集中在尿流动力学角度[5-7]。研究表明,糖尿病可以提高尿道平滑肌对α1受体激动剂的敏感性,同时α1受体抑制剂可以缓解糖尿病尿道功能障碍,但是尿道α1受体的表达方面的研究没有得到应有的重视[5,8]。早期的研究表明,糖尿病患者支配尿道平滑肌的副交感和交感神经的病变可能最终导致尿道功能障碍。众所周知,神经生长因子(NGF)属于神经营养因子家族,存在于副交感和交感神经系统中,对神经元的存活、营养和发育起着重要的作用[9-11]。研究表明,NGF是由靶器官通过逆向轴浆运输来营养神经元,上述过程的缺失或弱化可能导致糖尿病神经病变[12-13]。同其他NGF类似,组织首先合成NGF的前体proNGF,随后经过蛋白酶的剪切生成成熟的NGF。proNGF被认为与P75NTR受体有较高亲和力,并且可以导致由P75NTR受体介导的神经元凋亡[14-15]。因此尿道中NGF/proNGF和P75NTR受体的表达值得进一步研究。本文就此问题展开研究,现报道如下。
1 材料与方法
1.1 实验动物 雌性Whistar大鼠30只,重量230~250 g,购自山东大学实验动物中心(许可证号:SCXX20050015),采用随机数字表法分为糖尿病组(DM)和对照组(control),每组15只。
1.2 方法
1.2.1 建立糖尿病大鼠模型 禁食18 h后,糖尿病组大鼠给予单次腹腔注射链脲菌素(STZ,Sigma公司)65 mg/kg,对照组注射同等体积枸橼酸缓冲液。72 h后尾静脉采血测血糖(罗氏卓越型血糖仪),确认空腹血糖大于300 mg/dL。
1.2.2 膀胱尿道同步测压 建模成功8周后,等容条件下检测膀胱内压(BP)及尿道充盈压(UPP)。按照Torimoto等[7]设计的方法,在氟烷吸入麻醉下,以PE50聚乙烯导管置入颈静脉以便给药。下腹正中切口,分离两侧输尿管,远端结扎,近端分别旷置体外。取双套管由膀胱顶部插入并固定于尿道内口,外管为PE160,用以隔离膀胱和尿道,并可持续注入生理盐水充盈尿道,内管为PE50,用以测定尿道充盈压。另外再置入一PE50导管于膀胱内,充盈膀胱并测定膀胱等容收缩压。手术结束后,更换为乌拉坦麻醉,通过膀胱导管缓慢注入生理盐水诱发膀胱收缩并记录膀胱等容收缩压,通过双套管外管外0.075 mL/s持续注入生理盐水灌注尿道,并经内管记录尿道充盈压。随后静脉应用坦索罗辛(0.5 mg/kg)后重复实验。实验结束后留取尿道标本。
1.2.3 酶联免疫吸附试验(ELISA) 尿道组织低温快速匀浆后加入1 mL pH7.4 Tris/EDTA缓冲液(用前新鲜加入cocktail蛋白酶抑制剂混合物),4 ℃,12 000 r/min,离心5 min,取上清。BCA法测样本上清液的总蛋白浓度,作为目标蛋白NGF的参照。四倍体积杜氏磷酸缓冲液(DPBS 0.02% KCl,0.8% NaCl,0.02% KH2PO4,0.115% Na2HPO4,0.0133% CaCl2·2H2O及0.01%MgCl2·6H2O,pH 7.35)稀释样本,1∶50加入1 mol/L HCl,调节样品pH值至2.0~3.0,充分酸化样品,以利于受体上的NGF的解离;充分混合后于室温下(25 ℃)下静置;加入等体积的1 mol/L NaOH,调节pH至7.6;酸化后的样本于-20 ℃保存。应用大鼠NGF ELISA试剂盒(美国Promega公司)检测样本NGF含量[16]。
1.2.4 实时定量PCR(RT-qPCR) Trizol法(美国Invitrogen公司)提取大鼠尿道组织RNA,紫外分析测定RNA的浓度及纯度。应用Toyobo反转录试剂盒反转录得到互补DNA。引物设计和合成交由济南博尚生物公司完成,引物序列如下:α1A receptor:forward 5-ACTGGATTCGCAGGACATTCT-3,reverse 5-TGGCTGCCGTTCTTCCTAGT-3;α1Dreceptor:forward 5-GGCACAGACAGGCACAATGA-3,reverse 5-CTGTTGCTCTTCCGCTCTGG-3;NGF:forward 5-AACAGGACTCACAGGAGCAA-3,reverse 5-CTTCCTGCTGAGCACACACA-3;p75:forward 5CGTGAACCAGACGCCCCCAC-3,reverse 5-CACGCTTGGTCAGGGGCAGG-3;β-tubulin: forward 5GCCAGAGTGGTGCAGGAAATA-3,reverse 5-TCACCACGTCCAGGACAGAGT-3。使用罗氏RT-qPCR扩增仪,应用Takara SYBR Green试剂盒,采用两步法实时定量PCR,每次在延伸阶段读取吸光度值,(1)95° C预变性30 s;(2)95° C变性5 s,60° C退火20 s,共40循环。计算每个样本的目的/内参比值,确定目的基因的表达水平。
1.2.5 蛋白电泳(Western blotting) 尿道组织冰上快速匀浆,RIPA裂解液冰上裂解30 min,12 000 r/min 4 ℃离心20 min,BCA法测定总蛋白浓度,加入5×上样缓冲液煮沸4 min后-20 ℃保存。配置10%凝胶,每孔30 μg上样,待溴酚蓝电泳至凝胶底部时切断电流,将蛋白电转至PVDF膜上,5%奶粉封闭1 h后,加入一抗(兔抗大鼠α1A和α1D多克隆抗体,兔抗大鼠NGF抗体1∶500,兔抗大鼠P75受体抗体1∶500,兔抗大鼠β-Tubulin内参抗体1∶500)4 ℃过夜,TBST洗膜后加入羊抗兔二抗1∶4000 25 ℃ 2 h,Millipore发光液显色,Kodak2000M曝光系统采集和分析图像。
1.3 统计学处理 采用Excel建立数据,SPSS 18.0进行统计学分析,计量资料以(x±s)表示,比较采用t检验(t检验),以P<0.05表示差异有统计学意义。
2 结果
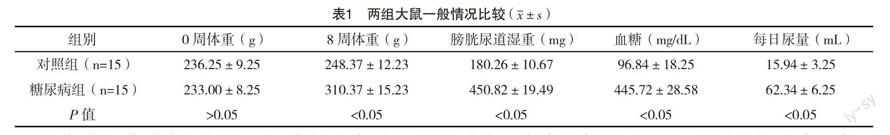
2.1 大鼠一般状况 糖尿病组大鼠多饮、多食、多尿症状显著,体重较对照组逐渐降低,解剖过程中发现腹部皮下脂肪含量较少,两组8周体重、膀胱尿道湿重、血糖及每日尿量比较,差异均有统计学意义(P<0.05),见表1。
2.2 膀胱尿道同步测压 尿流动力学检测显示(图1),对照组和糖尿病组BP基线大致相等,分别为(13.36±1.34)cm H2O和(12.24±1.57)cm H2O,比较差异无统计学意义(P>0.05)。糖尿病组BP最高值(32.61±2.24)cm H2O显著低于对照组的(46.80±3.18)cm H2O,比较差异有统计学意义(P<0.05)。糖尿病组BP基线在坦索罗辛应用后为(13.06±0.94)cm H2O,BP最高值在坦索罗辛应用后为(31.97±2.31)cm H2O,与应用前比较差异均无统计学意义(P>0.05)。对照组和糖尿病组UPP基线大致相等,分别为(50.13±1.27)cm H2O和(51.10±1.92)cm H2O,比较差异无统计学意义(P>0.05)。糖尿病组UPP最低值(35.21±2.67)cm H2O高于对照组的(16.80±1.28)cm H2O,比较差异有统计学意义(P<0.05)。应用坦索罗辛后,糖尿病组UPP基线(26.95±1.52)cm H2O显著低于应用坦索罗辛前,同时UPP最低值(15.74±2.43)cm H2O也显著低于应用坦索罗辛前,比较差异均有统计学意义(P<0.05)。
2.3 ELISA试验结果 糖尿病组NGF蛋白表达水平(52.05±7.77)pg/μg低于对照组的(99.59±10.76)pg/μg,比较差异有统计学意义(P<0.05),见图2。
2.4 RT-qPCR测定结果 糖尿病组大鼠尿道组织中NGF基因表达水平(0.164±0.020)低于对照组的(0.283±0.051),比较差异有统计学意义(P<0.05)。糖尿病组大鼠尿道组织中α1A基因表达水平(0.372±0.062)高于对照组的(0.095±0.013),α1D基因表达水平(0.289±0.045)高于对照组的(0.127±0.014),比较差异均有统计学意义(P<0.05)。糖尿病组大鼠P75NTR受体基因表达水平(0.020±0.0067)低于对照组的(0.048±0.0103),比较差异有统计学意义(P<0.05),见图3。
基因表达
2.5 蛋白电泳(Western blotting) 糖尿病组大鼠尿道组织中α1A蛋白表达水平(3.08±0.114)高于对照组的(0.34±0.059),α1D蛋白表达水平(2.47±0.214)高于对照组的(0.29±0.064),比较差异均有统计学意义(P<0.05)。糖尿病组大鼠P75NTR受体蛋白表达水平(0.528±0.135)低于对照组的(1.007±0.113),比较差异有统计学意义(P<0.05)。对照组和糖尿病组sortilin蛋白表达水平分别为(1.147±0.093)和(1.056±0.135),比较差异无统计学意义(P>0.05),见图4。
3 讨论
本研究表明糖尿病可以导致尿道功能障碍,同时应用α1受体激动剂可以改善症状,通过检测尿道组织中α1受体的表达情况可以来解释上述现象。已有研究表明,交感和副交感神经在尿道平滑肌的神经支配中起着重要的作用,其中NGF起着桥梁的作用,同时NGF也对维持膀胱和尿道的感觉起重要作用。因此笔者研究NGF/proNGF通路,并且发现糖尿病大鼠尿道中NGF表达降低,proNGF表达上升。
众所周知,尿道括约肌包括交感和副交感神经支配的平滑肌,还有躯体运动神经支配的横纹肌。α1受体介导交感神经支配的尿道平滑肌收缩,NO介导副交感神经支配的尿道平滑肌舒张[5,7-8]。在本研究中,测量UPP的同时并未应用筒箭毒消除横纹肌的影响,但是α1受体拮抗剂的作用足以说明α1受体在糖尿病尿道功能障碍中起着重要作用。
NGF在交感神经和外周感觉神经的存活、生长和发育过程中起着重要的作用,与其他神经营养因子家族成员类似,组织首先合成30 KD proNGF,随后剪切合成14 KD成熟NGF。上述过程可以解释某些组织中NGF基因和蛋白的表达不一致。在中枢和外周神经组织中主要以porNGF的形式存在,成熟NGF的含量极低,之前的研究表明靶器官到神经的NGF的逆行轴浆运输可能在糖尿病神经病变中起着重要作用,同时proNGF介导神经元凋亡[12,14]。本研究同之前的几项研究结果一致,糖尿病大鼠组织中NGF的基因和蛋白表达水平均显著降低[17-18]。基于上述结果,曾有多项实验尝试外源性补充NGF来治疗糖尿病神经病变,取得一定疗效[19]。
组织中存在两类NGF受体:高亲和力的酪氨酸激酶受体A(TrkA)和P75NTR受体。前者与磷酯酶C、丝氨酸激活的蛋白激酶和PI3K通路相偶联,下游的效应器包括蛋白激酶B(Akt)、Bad、Foekhead1、Bcl-2和cAMP反应元件结合蛋白。其中,Akt在促进神经元存活过程中起着重要的作用[20]。尽管NGF可独立激活TrkA介导的信号通路,但是研究表明NGF结合P75NTR受体可以强化上述过程[21-23]。Roux等[24]的研究表明,P75NTR受体可以激活Akt通路,促进PC12细胞的存活。本研究记过表明NGF及其P75NTR受体表达的降低在糖尿病神经病变发病过程中起着重要作用,这与其他相关研究结果相吻合[18]。
与成熟NGF不同,proNGF对P75NTR受体的亲和力高于TrkA受体。P75NTR受体和sortilin组成proNGF的结合位点。缺乏sortilin的情况下,proNGF剪切合成为成熟NGF。proNGF诱导神经元凋亡的具体机制仍未阐明,一种可能的机制是proNGF与sortilin/P75NTR结合形成三聚体,激活下游c-Jun N末端激酶-3、caspase-6和caspase-9,或者通过非细胞介导的TNF-α的释放来诱导凋亡[25]。在对前脑的研究中发现激活PI3K/Akt和丝裂原激活的蛋白激酶/Erk途径可以有效抑制proNGF介导的细胞凋亡,揭示了激活Trk是神经元存活和凋亡力量对比中的一个关键点,提示proNGF通过抑制Akt和Erk的激活来促进凋亡[26]。在本研究中,糖尿病大鼠尿道中proNGF的表达显著提高。假定神经组织中NGF和proNGF之间存在一个平衡,后者的增加抑制Akt和Erk通过,从而导致神经元的凋亡。P75NTR受体对神经元的作用存在较大争议,笔者认为其主要起正面作用,促进神经元存活。
失去交感神经的支配可以导致α1受体的上调。Baglole等[27]发现急性去交感神经可以上调小肠绒毛α1受体的表达。按照上述研究,可以推测NGF/proNGF通路的损伤导致交感神经支配的障碍,进而导致α1受体的上调,上述过程可能是糖尿病尿道功能障碍的发病机制。
本研究表明糖尿病可以导致尿道功能障碍,应用α1受体拮抗剂可以改善尿道功能。尿道中NGF/proNGF通路的改变导致外周神经的损伤及α1受体表达的上调。总之,α1受体的表达上调和NGF/proNGF通路的改变在糖尿病尿道功能障碍中起着重要的作用。
参考文献
[1] Rose A,Thimme A,Halfar C,et al.Severity of urinary incontinence of nursing home residents correlates with malnutrition, dementia and loss of mobility[J].Urologia Internationalis,2013,91(2):165-169.
[2] Frimodt-M?ller C.Diabetic cystopathy:epidemiology and related disorders[J].Annals of Internal Medicine,1980,92(2 Pt 2):318-321.
[3] Ueda T,Yoshimura N,Yoshida O.Diabetic cystopathy:relationship to autonomic neuropathy detected by sympathetic skin response[J].Journal of Urology,1997,157(2):580-584.
[4] Mitsui T,Kakizaki H,Kobayashi S,et al.Vesicourethral function in diabetic patients:association of abnormal nerve conduction velocity with vesicourethral dysfunction[J].Neurourology & Urodynamics,1999,18(6):639-645.
[5] Yang Z G,Dolber P C,Fraser M O.Diabetic urethropathy compounds the effects of diabetic cystopathy[J].J Urol,2007,178(5):2213-2219.
[6] Liu G,Lin Y,Yamada Y,et al.External urethral sphincter activity in diabetic rats[J].Neurourology & Urodynamics,2008,27(5):429-434.
[7] Torimoto K,Fraser M O,Hirao Y,et al.Urethral dysfunction in diabetic rats[J].The Journal of Urology,2004,171(5):1959-1964.
[8] Kazumasa T,Yoshihiko H,Hiroko M,et al.alpha1-Adrenergic mechanism in diabetic urethral dysfunction in rats[J].J Urol,2005,173(3):1027-1032.
[9] Levi-Montalcini R.The nerve growth factor 35 years later[J].Science,1987,237(4819):1154-1162.
[10] Thoenen H,Barde Y A.Physiology of nerve growth factor[J].Physiological Reviews,1980,60(4):1284-1335.
[11] Smith P G,Warn J D,Steinle J J,et al.Modulation of parasympathetic neuron phenotype and function by sympathetic innervation[J].Autonomic Neuroscience,2002,96(1):33-42.
[12] Hellweg R,Raivich G,Hartung H D,et al.Axonal transport of endogenous nerve growth factor(NGF) and NGF receptor in experimental diabetic neuropathy[J].Experimental Neurology,1994,130(1):24-30.
[13] Hellweg R,Hartung H D.Endogenous levels of nerve growth factor(NGF) are altered in experimental diabetes mellitus:a possible role for NGF in the pathogenesis of diabetic neuropathy[J].Journal of Neuroscience Research,1990,26(2):258-267.
[14] Lee R,Kermani P,Teng K K,et al.Regulation of cell survival by secreted proneurotrophins[J].Science,2001,294(5548):1945-1948.
[15] Frédéric L J,Bertrand M J,Olivier D B,et al.ProNGF induces TNFalpha-dependent death of retinal ganglion cells through a p75NTR non-cell-autonomous signaling pathway[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(8):3817-3822.
[16] ?oker Gurkan A,Arisan S,Arisan E D,et al.Association between IL-1RN VNTR,IL-1β-511 and IL-6(-174,-572,-597) gene polymorphisms and urolithiasis[J].Urologia Internationalis,2013,91(2):220-226.
[17] Sasaki K,Chancellor M B,Phelan M W,et al.Diabetic cystopathy correlates with a long-term decrease in nerve growth factor levels in the bladder and lumbosacral dorsal root ganglia[J].Journal of Urology,2002,168(3):1259-1264.
[18] Tong Y C,Cheng J T.Changes in bladder nerve-growth factor and p75 genetic expression in streptozotocin-induced diabetic rats[J].British Journal of Urology International,2005,96(9):1392-1396.
[19] Goins W F,Yoshimura N,Phelan M W,et al.Herpes simplex virus mediated nerve growth factor expression in bladder and afferent neurons:potential treatment for diabetic bladder dysfunction[J].Journal of Urology,2001,165(5):1748-1754.
[20] Kaplan D R,Miller F D.Neurotrophin signal transduction in the nervous system[J].Current Opinion in Neurobiology,2000,10(3):381-391.
[21] Bibel M,Hoppe E,Barde Y A.Biochemical and functional interactions between the neurotrophin receptors trk and p75NTR[J].The EMBO Journal,1999,18(3):616-622.
[22] Maliartchouk S,Saragovi H U.Optimal nerve growth factor trophic signals mediated by synergy of TrkA and p75 receptor-specific ligands[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience,1997,17(16):6031-6037.
[23] Wehrman T,He X,Raab B,et al.Structural and mechanistic insights into nerve growth factor interactions with the TrkA and p75 receptors[J].Neuron,2007,53(1):25-38.
[24] Roux P P,Bhakar A L,Kennedy T E,et al.The p75 neurotrophin receptor activates Akt (protein kinase B) through a phosphatidylinositol 3-kinase-dependent pathway[J].Journal of Biological Chemistry,2001,276(25):23 097-23 104.
[25] Te N A W.Sortilin:a receptor to regulate neuronal viability and function[J].Trends in Neurosciences,2012,35(4):261-270.
[26] Volosin M,Song W,Almeida R D,et al.Interaction of survival and death signaling in basal forebrain neurons:roles of neurotrophins and proneurotrophins[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience,2006,26(29):7756-7766.
[27] Baglole C J,Sigalet D L,Martin G R,et al.Acute denervation alters the epithelial response to adrenoceptor activation through an increase in alpha1-adrenoceptor expression on villus enterocytes[J].Br J Pharmacol,2006,147(1):101-108.
(收稿日期:2015-09-09) (本文编辑:王利)

