鸭肝炎病毒基因CRT-PCR快速检测型和A型一步法双重方法的建立和应用
李天芝 于新友 王金良 ( 山东绿都生物科技有限公司,山东 滨州 56600 山东省滨州畜牧兽医研究院,山东 滨州 56600)
鸭病毒性肝炎 (duckviralhepatitis,DVH)是由鸭肝炎病毒(duckhepatitisvirus,DHV)引起的一种急性、高度致死性传染病。临床上病死雏鸭主要表现为角弓反张,病理剖检以肝脏水肿,有针头大至黄豆粒大出血点为特征。主要危害1~3周龄雏鸭,死亡率高达90%~95%[1],给养鸭业带来巨大的经济损失[2、3]。该病于1945年首次在美国发现,随后相继在世界多数国家报道了该病的流行。最初将DHV分为Ⅰ型、Ⅱ型和Ⅲ型3种血清型,其中Ⅱ型DHV(DHV-Ⅱ)和Ⅲ型 DHV(DHV-Ⅲ)均属于星状病毒科,I型(DHV-Ⅰ)属于小RNA病毒科,目前国内流行的DVH主要是由小RNA病毒科的成员引起的[4],有学者建议根据基因结构将小RNA病毒科DHV分为基因A型(DHV-A)、B型(DHV-B)、C型(DHV-C),分别对应原有的DHV-Ⅰ、从中国台湾分离的新型鸭病毒性肝炎 (newtypeduckhepatitis virus,N-DHV)、从韩国和中国大陆分离的N-DHV[5]。为调查我国DHAV-C和DHAV-A流行情况,同时减少2个基因型检测的工作量,本文根据GenBank上已发表的DHAV-C和DHAV-A的基因序列,分别设计了2对能特异性扩增引物,建立了可同时检测DHAV-C和DHAV-A的一步法二重RT-PCR方法,为这2种基因型病毒快速检测和流行病学调查等提供了有效的技术支持。
1 材料和方法
1.1 病毒株与病料
基因C型鸭肝炎病毒(DHV-C)、基因A型鸭肝炎病毒(DHV-A)、鸭瘟病毒、鸭坦布苏病毒、鸭H9亚型禽流感病毒和鸭副黏病毒由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点开放实验室保存,临床检测病料为2014年7月至2015年7月采自山东省各地鸭场临床诊断为DHV感染的鸭肝脏等。
1.2 工具酶及试剂盒
pMD18-T载体、限制性内切酶、PCR相关试剂、DNAMarker、DNA凝胶回收试剂盒为宝生物工程(大连)有限公司产品,AxyPrep体液病毒DNA/RNA小量试剂盒为爱思进生物技术(杭州)有限公司产品。
1.3 RT-PCR引物设计与合成
用PrimerPremier5.0基因分析软件,参照GenBank中登录的DHV-C基因序列(DQ256134)设计1对引物,扩增DHV-C目的基因片段大小为270bp,引物序列如下:DHV-CF:5′ -GCGTCTAAGTCTTAATGGATT-3′,DHV-CR:5′-CGGGCACTCATGTTAT-GGAC-3′。参照GenBank中登录的DHV-A基因序列(DQ864514)设计1对引物,扩增DHV-A目的基因片段大小为479bp,引物序列如下:DHV-AF:5′-GCAGACTACCAAGGTTGT-3′ ,DHV-AR:5′ -ACCCACTGTCCTGTAACC-3′,引物由生工生物工程(上海)股份有限公司合成。
1.4 病毒基因组RNA的提取
按AxyPrep体液病毒DNA/RNA小量试剂盒使用说明书提取DHV-C和DHV-A的RNA,并提取其他几种参照病毒的核酸。
1.5 一步法双重RT-PCR扩增及条件优化
最适退火温度的确定:分 别 以 48℃ 、50℃ 、52℃ 、54℃、56℃、58℃、60℃的退火温度进行梯度一步法双重RT-PCR反应,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳退火温度。
最适引物浓度的确立:在25μLPCR反应体系中分别加入各对引物,使引物浓度分别为0.2μmol/L、0.4μmol/L、0.6μmol/L、0.8μmol/L、1.0μmol/L、1.2μmol/L,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳引物浓度,筛选出一步法双重RT-PCR反应体系的最佳反应模式。
1.6 特异性试验
分别提取DHV-C、DHV-A、鸭瘟病毒、鸭坦布苏病毒、鸭H9亚型禽流感病毒和鸭副黏病毒的核酸,用已建立的一步法双重RT-PCR方法进行扩增。
1.7 敏感性试验
分别提取DHV-C、DHV-A的RNA后定量,分别作10倍梯度稀释提取的病毒基因组RNA,每个稀释度取lμL为模板,采用已优化的一步法双重RT-PCR反应条件分别对上述不同稀释度的RNA进行一步法双重RT-PCR扩增,反应结束后进行凝胶电泳检测,以检测建立的一步法双重RT-PCR的敏感性。
1.8 重复性试验
用建立的一步法双重RT-PCR检测方法分别对DHV-C感染的8份阳性样品,DHV-A感染5份阳性样品及3份阴性样品重复检测3次,以验证本方法的重复性和稳定性。
1.9 临床样品的检测
取DHV疑似送检病料68份,利用建立的一步法双重RT-PCR方法进行检测。
2 结果与分析
2.1 反应条件的优化
通过对DHV-C、DHV-A两种引物浓度及一步法双重RT-PCR扩增温度、时间和循环次数等的优化,最后确定一步法双重RT-PCR中最佳引物浓度分别为DHV-C 0.6μmol/L、DHV-A0.6μmol/L。一步法双重RT-PCR的最佳反应模式为:50℃30min,95℃ 5min,94℃ 30s,54℃ 30s,72℃ 30s,35个循环,最后72℃延伸10min。
2.2 扩增产物的检测
将DHV-C和DHV-A的核酸分别进行一步法双重RT-PCR扩增,结果能扩增出与试验设计相符、DHV-C270bp、DHV-A479bp的特异性片段,而对照扩增不出任何条带(图1)。
2.3 特异性试验
用建立的一步法双重RT-PCR方法对DHV-C与 DHV-A混合样品、DHV-C、DHV-A、鸭瘟病毒、鸭坦布苏病毒、鸭H9亚型禽流感病毒和鸭副黏病毒在相同的条件下进行扩增。结果显示,DHV-C和DHV-A的RT-PCR产物的片段长度分别为265bp和479bp,与预期大小一致,而鸭瘟病毒、鸭坦布苏病毒、H9亚型禽流感病毒和鸭副黏病毒均未扩增出片段(图2),说明本研究建立的一步法双重RT-PCR方法特异性强。

图1 单项一步法RT-PCR扩增结果
2.4 敏感性试验
用紫外分光光度计测定的模板RNA浓度,依次做10倍梯度稀释,每个稀释度取1μL作为模板。结果显示用10pg的DHV-C和10pg的DHV-A作为模板该一步法双重RT-PCR仍然可以扩增出特异性条带(图3)。
2.5 重复性试验

图2 特异性试验
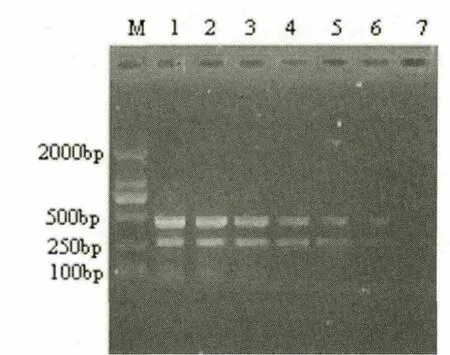
图3 敏感性试验
经过3次重复操作,结果一致,表明本研究建立的一步法双重RT-PCR方法是稳定可靠的。
2.6 临床样品的检测
对68份在山东省不同地区采集的DHV疑似病料,用建立的一步法双重RT-PCR和单项一步法RT-PCR进行了检测,两者符合率达100%,检出DHV-C阳性样品28份,DHV-A阳性样品11份。
3 讨论
参照GenBank中登录的DHV-C基因序列(DQ256134) 和 DHV-A基因序列(DQ864514),利用PrimerPremier5.0分别设计1对引物,通过一步法RT-PCR扩增出目的基因,分别连接到pMD18-T载体,送样测序,对测序结果与模板序列进行比对,其同源性均为100%,本试验确定的一步法双重RT-PCR中最适引物浓度分别为DHV-C 0.6μmol/L、DHV-A0.6μmol/L时,达到最佳反应效果。反复优化多重PCR的反应参数,尤其要注意PCR反应的退火温度要足够高,因为一步法双重RT-PCR反应体系中有多对引物,退火温度过低往往会导致非特异性扩增产物出现,提高退火温度则可有效减少非特异性扩增产物的生成,通过反复摸索条件,所确定的一步法双重RT-PCR中最适退火温度为54℃。特异性试验结果显示,本试验所建立的一步法双重RT-PCR检测DHV-C、DHV-A的方法分别能够扩增出270bp和479bp片段,而对常见的鸭源病毒,如鸭瘟病毒、鸭坦布苏病毒、鸭H9亚型禽流感病毒和鸭副黏病毒均无扩增产物,证明本方法具有较好的特异性。敏感性试验结果显示,对DHV-C、DHV-A的检测灵敏度均可以达到10pgRNA。
通过对68份DHV疑似病料检测结果显示,单项一步法RT-PCR与一步法双重RT-PCR检测方法结果的符合率为100%。可以在一份样品中同时检测出DHV-C和DHV-A2种病原体,达到对DHV-C和DHV-A的同步诊断,比单项扩增减少65%的时间和1/2的试剂,该法敏感性高、特异性强、快速简便、检测成本低,适合基层兽医工作者使用。本研究为国内DHV-C和DHV-A的鉴别诊断和流行病学调查等提供了一种简单、快速的分子生物学诊断方法。
[1]殷震,刘景华.动物病毒学(第 2版)[M].北京:科学出版社,1997:510-512.
[2]付玉志,张洪辉,李传峰,等.Ⅰ型鸭肝炎病毒在鸭胚成纤维细胞系中的增殖特性研究[J].中国预防兽医学报,2013,35(2):110-113.
[3]袁率珍,范书才,李虹,等.新型鸭肝炎病毒全基因组序列分析 [J].中国预防兽医学报,2010,32(7);507-511.
[4]施少华,程龙飞,傅光华,等.鸭肝炎病毒新血清型基因组序列分析 [J].微生物学报,2009,49(3):309-315.
[5]黄秋雪,汤承,岳华.基因C型鸭甲型肝炎病毒分子生物学研究进展[J].动物医学进展,2013,34(2):92-95.

