质子诱导AHH-1细胞PIG3基因的mRNA表达和细胞周期改变研究
孔福全,马南茹,隋 丽,*,王 潇,刘晓丹,张小玲,刘建成,周平坤,*
(1.中国原子能科学研究院 核物理研究所,北京 102413;2.军事医学科学院 放射与辐射医学研究所,北京 100850)
质子诱导AHH-1细胞PIG3基因的mRNA表达和细胞周期改变研究
孔福全1,马南茹1,隋 丽1,*,王 潇1,刘晓丹2,张小玲1,刘建成1,周平坤2,*
(1.中国原子能科学研究院 核物理研究所,北京 102413;2.军事医学科学院 放射与辐射医学研究所,北京 100850)
本文利用串列加速器加速的21MeV的质子束流对人正常淋巴细胞AHH-1进行辐照,研究了质子诱导AHH-1细胞PIG3基因的mRNA表达量和细胞周期改变的剂量和时间相关性。实时定量聚合酶链式反应(PCR)结果显示,质子辐照后,PIG3基因mRNA的表达量随剂量的增大而增大,表现出很好的剂量相关性。在不同的剂量点下,表达量随时间的变化趋势也大致相似,峰值出现的时间点除8Gy剂量点出现在12h外,其他剂量点均在照后6h达到。理论拟合曲线和实验数据也呈现出很好的一致性。细胞周期检测结果显示,在每个剂量点下,G2/M期细胞随着时间的延长呈现先增加后减少的趋势。以上结果说明PIG3基因mRNA的表达量在生物剂量计的应用上可能具有一定的基础和潜力,值得进一步研究。
质子;PIG3基因;剂量;生物剂量计
核能的普及应用、核武器等战略核力量的存在以及载人航天飞行的快速发展,使人类面临核与空间辐射的威胁大幅增加。第一时间获得人员的受照剂量,评估辐射对人体造成的危害是实施正确救治措施的基础。剂量仪、探测器等物理剂量测量方法可给出精确的剂量值。但面临突然发生、无法预料的核事故或核恐怖袭击时,物理剂量可能不能及时得到,这时生物剂量计就展现出了物理剂量计所不可比拟的优点。近年来国内外已得到应用或正在研究的生物剂量估计方法有多种,但各种方法均有其局限性[1-3]。
Polyak等[4]、龙贤辉等[5-6]研究了人淋巴母细胞AHH-1辐照后基因表达的变化,发现PIG3(p53诱导的基因3)基因起到了一定的作用[7]。刘晓丹等[8]进行了γ辐射诱导淋巴母细胞AHH-1中PIG3表达的剂量相关性研究,发现PIG3基因mRNA的表达水平与剂量和时间具有一定的效应关系。潘艳等[9]进行了γ辐射诱导人外周血淋巴细胞永生化细胞32F中PIG3基因mRNA表达的剂量相关性研究,也发现了表达量与剂量和时间的效应关系。另有研究[10]表明,受0.05~0.2Gy的γ射线诱导后,AHH-1细胞的PIG3基因mRNA的表达量有所升高,并且PIG3基因mRNA的表达量与辐照剂量呈一元二次关系。
本文拟采用质子束流对人类正常淋巴母细胞AHH-1进行辐照,研究质子诱导AHH-1细胞PIG3基因mRNA的表达量与辐照剂量之间的关系,以及其随时间的变化。
1 实验材料及方法
1.1 试剂及仪器
RPMI 1640培养基,美国Hyclone公司;新生胎牛血清,美国Hyclone公司;TRNzol-A+总RNA提取试剂,天根生化科技(北京)有限公司;GoldScript cDNA合成试剂盒,美国Invitrogen公司;Quantscript RT Kit Quant cDNA第1链合成试剂盒(KR103),天根生化科技(北京)有限公司;Real Master Mix(SYBR Green,FP202),天根生化科技(北京)有限公司;Chromo4实时荧光PCR仪,美国Bio-Rad公司;紫外分光光度计(由外单位检测),德国Eppendorf公司;流式细胞仪,美国Becrman Coulter公司。
1.2细胞培养及照射
所用细胞为人类正常淋巴母细胞AHH-1,源自人类外周血B淋巴细胞,由军事医学科学院赠送。AHH-1细胞为悬浮细胞,以RPMI 1640培养基培养,同时补加10%的新生胎牛血清。培养条件:37℃、5%CO2/95%空气、100%相对湿度下生长。培养至指数生长期,以备照射。
1.3 质子辐照实验
辐照前离心收集指数生长期的淋巴母细胞AHH-1,用少量培养基吹打均匀并分装于200μL微量离心试管(EP管)中,用中国原子能科学研究院HI-13串列加速器的Q3D磁谱仪进行质子辐照,加速器产生的质子能量为22MeV,经过100μm的膜窗、300μm的铝箔及50cm的空气后,质子能量下降到约21MeV。
样品辐照时将EP管固定于样品板并置于正对束流中心位置处,面向质子出射窗口进行照射。通过多次重复测量,得到样品点质子注量与监测点质子注量的比值。由式(1)计算21MeV质子在水中的辐照剂量与注量的转换关系:
D=1.6×10-9×LET×F/ρ(1)式中:D为剂量,Gy;LET为传能线密度,keV/μm;F为离子注量,cm-2;ρ为粒子通过的物质的密度,g/cm3。
利用SRIM程序模拟计算得到21MeV质子在水中的LET为2.5keV/μm,由式(1)计算得到产生1Gy剂量所需的质子注量为2.5× 108cm-2,实现2、6、8Gy吸收剂量分别需要1×109、3×109、4×109cm-2的质子注量。
质子辐照后收集细胞,更换新的RPMI 1640培养基继续培养。分别于质子辐照后的6、12、24、48h离心收集细胞;除去培养液,用磷酸盐缓冲液(PBS)清洗1次;再用1mL PBS缓冲液重悬细胞。取0.9mL重悬细胞用于实时荧光定量PCR确定PIG3基因mRNA的表达水平,0.1mL用于流式细胞仪细胞周期的检测。
1.4 PIG3基因mRNA的表达量检测
1)细胞总RNA提取
在辐照后指定时间离心收集细胞,将收集的细胞用PBS洗涤2次,加入适量Trnzol,充分裂解后于-20℃临时保存。收集完成后统一按试剂说明书提取总RNA,准确定量后于-80℃保存备用。
2)cDNA合成
所有实验组均取2μg等量的总RNA,用Quantscript RT Kit Quant cDNA第1链合成试剂盒(KR103)进行cDNA反转录合成。反转录合成体系的体积为20μL,具体操作按产品说明书进行。
3)实时定量PCR
反转录用Bio-Rad公司的Chromo4实时荧光PCR仪,按照用户手册操作。PCR试剂采用Real Master Mix,采用的实时定量聚合酶链式反应引物是依据Cenebank数据库中PIG3和β-肌动蛋白的基因序列所设计合成的,PIG3和β-肌动蛋白引物序列及PCR条件列于表1。每个实验点各取1μL的第1链cDNA合成产物,在20μL的反应体系中进行PCR反应,每次反应均以β-肌动蛋白为对照。每个样品同时做3个循环样。在每次实时定量PCR反应后进行溶解曲线分析,以排除引物二聚体的影响。
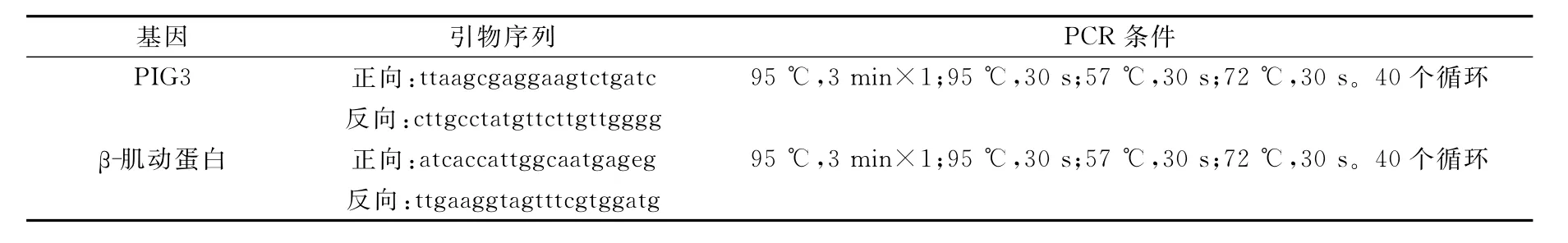
表1 PCR引物序列和PCR条件Table 1 PCR primer sequence and PCR condition
4)PCR检测数据分析
以β-肌动蛋白基因为内参基因,用比较循环阈值Ct(每个反应管内的荧光信号到达设定阈值时所经历的循环数)的方法相对定量PIG3基因mRNA的表达水平,即以0Gy照射的AHH-1细胞中PIG3基因mRNA的表达量为1,其他样品中PIG3基因mRNA的表达量均为标准样品的n倍,依据式(2)计算PIG3基因mRNA的相对表达量RQ:

其中,ΔΔCt为目的基因的Ct与内参基因的Ct的差值。
5)细胞周期测定
于照后不同时间收集细胞,用PBS清洗2次,加预冷的75%乙醇固定24h以上;检测前离心除去固定液,加RNA酶,于37℃水浴30min;再次离心除去RNA酶,加溴化乙锭(PI)室温染色30min,用流式细胞仪检测细胞周期。
2 实验结果和讨论
2.1 质子诱导AHH-1细胞PIG3基因mRNA的表达量随剂量和时间的变化
图1为经质子辐照后6、12、24、48h,淋巴母细胞AHH-1的PIG3基因mRNA的表达量与质子剂量的关系及拟合曲线。由图1可见,在质子辐照后的6、12、24、48h,AHH-1细胞PIG3基因mRNA的表达水平均随剂量的增加而增大,0、2、6、8Gy剂量点间保持了剂量-效应的二次关系。但因8Gy剂量点PIG3基因mRNA的表达量在照后12h达到峰值,而2Gy和6Gy剂量点PIG3基因mRNA的表达量在照后12h已下降,故在12h点PIG3基因mRNA的表达量与辐照剂量关系的二次拟合表现相对较差。在质子辐照后的24h,各剂量点PIG3基因mRNA的表达量均处于缓慢下降过程,PIG3基因mRNA的表达量与辐照剂量呈现出良好的二次关系。
图2为质子辐照后PIG3基因mRNA的表达量随时间的变化。由图2可见,随剂量的变化,PIG3基因mRNA的表达量的峰值时间也不同。较低剂量点(2Gy和6Gy)在照后0~6h,PIG3基因mRNA的表达量随时间的延长而增加,并在照后6h达到峰值,PIG3基因mRNA的相对表达量分别为10.2和19.5;照后6~12h,PIG3基因mRNA的表达量快速下降,达到6h点的一半左右;照后12~24h,PIG3基因mRNA的表达量继续下降,但变化趋势减缓;照后24~48h,PIG3基因mRNA的表达量继续下降,在照后48h时,PIG3基因mRNA的相对表达量分别为3.2和4.4,仍高于对照水平。质子高剂量点(8Gy)在照后0~12h内PIG3基因mRNA的表达水平随时间不断增大,在照后12h达到最大值,此时PIG3基因mRNA的相对表达量为48.8;照后12~24h期间,PIG3基因mRNA的表达量迅速下降;照后24~48h期间,PIG3基因mRNA的表达量继续下降,48h点PIG3基因mRNA的相对表达量为5.29,仍明显高于对照水平。
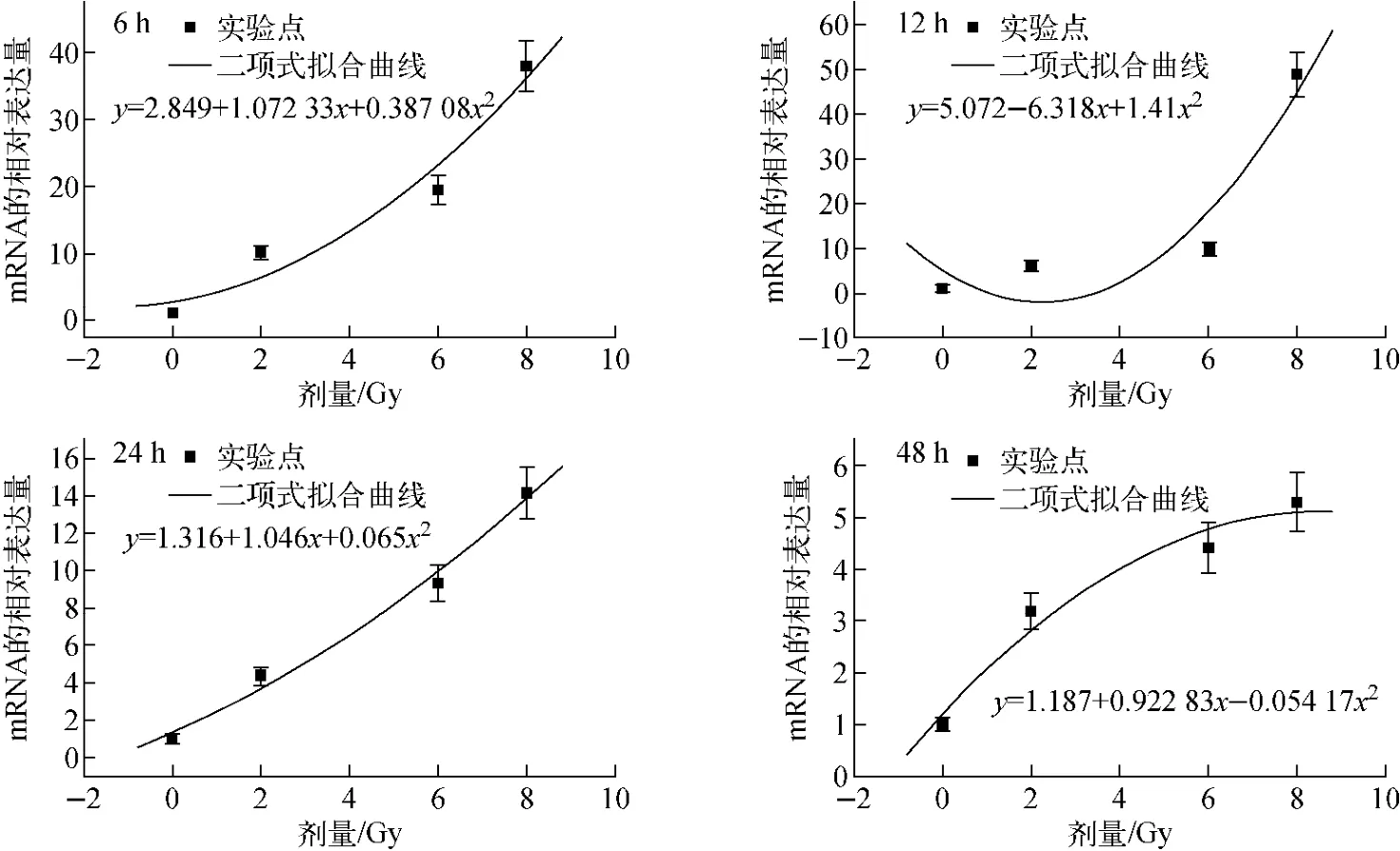
图1 质子辐照后AHH-1细胞PIG3基因mRNA表达量-剂量关系曲线Fig.1 Relationship curve of PIG3gene mRNA expression of AHH-1cell with dose after proton irradiation

图2 质子辐照后PIG3基因mRNA的表达量随时间的变化Fig.2 Variation of PIG3gene mRNA expression of AHH-1cell with time after proton irradiation
由图2还可看出,PIG3基因mRNA的表达量随剂量的增大呈现出明显增大的趋势,在不同的时间点其表达量的变化虽有所不同,但整体趋势一致。PIG3基因mRNA的表达量随时间的变化关系均表现为随着时间的延长先增大后减小,3个剂量点的曲线形状基本相似,表达量最大的时间点2Gy和6Gy的大致相同,8Gy的相对延后。从图1、2的拟合曲线可看出,PIG3基因mRNA的表达量与时间和剂量具有一定的对应关系。
由图1、2可看出,在本实验中,质子辐照正常淋巴母细胞AHH-1后,PIG3基因mRNA的表达量随剂量的变化趋势在不同的辐照后时间点基本一致,而在不同的剂量下其随时间的变化趋势也大致相同,因此可认为质子辐照正常淋巴母细胞AHH-1后,PIG3基因mRNA的表达量与剂量和时间均有很好的效应关系,因此,PIG3基因在生物剂量计的未来应用中具有一定的潜力。
2.2 质子诱导AHH-1细胞周期分布随剂量和时间的变化
图3为质子辐照后6、12、24、48h时AHH-1细胞周期的分布。由图3可见,在照后6h,所有受照剂量点G2/M期细胞比例均明显增加,表现出一定的G2/M期阻滞,在6Gy剂量点处G2/M阻滞最强,G2/M期细胞比例为50.9%;此外,在高剂量点(6Gy和8Gy)G1期细胞比例显著减小,表现出G1期抑制。在照后12h后,2Gy点G2/M期阻滞强度低于6h时的,8Gy点G2/M期细胞比例在所有时间点中为最大值,6Gy剂量点G2/M期阻滞与6h时的相比无显著变化。在所有时间点中,3个剂量点中6Gy点处G2/M阻滞最强烈,G2/M期细胞比例最大时为52.2%。在照后24h,所有剂量点G1期细胞比例与6、12h相比均有所增加,除8Gy剂量点外,均大致恢复到正常水平;而G2/M期细胞比例与6、12h相比均明显减小,此时G2/M期阻滞强度与剂量呈现正相关,在8Gy剂量点处达到最大值,对应G2/M期细胞比例约为21.3%。照后48h,所有剂量点G2/M期细胞比例均降至正常水平以下,而各剂量点G1期阻滞强度继续增强,2Gy和6Gy点G1期细胞比例超过对照点,表现出G1期阻滞。
图4为不同剂量质子辐照后AHH-1细胞周期分布随时间的变化。从图4可看出,随着辐照剂量的不同,AHH-1细胞周期分布随时间的变化趋势也不同。2Gy点细胞损伤较小,对辐射的反应较快,在照后6h,G2/M期阻滞就达到峰值;在照后6~48h,G2/M期细胞比例呈不断下降的趋势;G1期细胞比例则随时间先减小后增大,在照后48h表现出G1期阻滞。经过8Gy的质子辐照,G2/M期细胞比例随时间先增大后减小,在照后12h达到峰值。G1期细胞比例随时间先减小后增大,在照后6~24h,G1期细胞比例均低于对照组。6Gy剂量点细胞周期分布变化介于2Gy和8Gy剂量点之间,G2/M期细胞比例随时间先增大后减小,在照后48h下降至正常水平以下;照后6h和12h,G2/M期细胞比例分别为50.9%和52.2%,推测G2/M期阻滞峰值时间在6~12h之间。G1期细胞比例随时间先减小后增大,在照后6~12h表现为G1期抑制;在照后24~48h,6Gy点的G1期细胞比例超过对照点,表现出G1期阻滞。

图3 质子辐照后不同时间点AHH-1细胞周期分布与剂量的关系Fig.3 Changes in cell cycle at different time with doses after proton irradiation

图4 不同剂量质子辐照后AHH-1细胞周期分布与照后时间的关系Fig.4 Changes in cell cycle at different doses with time after proton irradiation
由图3、4可看出,经质子辐照后,淋巴母细胞均发生了显著的G2/M期阻滞。在同一剂量下,随着照后时间的延长,G2/M期细胞比例先增大后减小。在同一时间点下,6h和12h时G2/M期细胞比例随剂量的增大表现为先增大后减小,24h时G2/M期细胞比例随剂量的增大持续增大,48h时G2/M期细胞比例随着剂量的增大则是先呈现无规律减少直至最后消失。
3 结论
实验结果表明,质子束流辐照后,在不同的时间点PIG3基因mRNA的表达量均与剂量呈现效应关系,曲线的变化大致相似,最大表达量的时间点也基本一致。拟合曲线和实验数据的吻合程度也很高。由此可看出,PIG3基因mRNA与辐照剂量和辐照后的时间均具有很好的效应关系,因此在生物剂量计的应用上可能具有一定的基础和潜力,有必要对其进行进一步的实验和理论分析。
[1] 国际原子能机构,世界卫生组织.辐射血液学手册[M].北京:原子能出版社,1975.
[2] 闵锐.电离辐射生物剂量研究现状[J].国外医学:放射医学核医学分册,2004,28(3):121-127.
MIN Rui.Current progress in research of ionizing radiation biodosimetry[J].Foreign Medical Science:Section of Radiation Medicine and Nuclear Medicine,2004,28(3):121-127(in Chinese).
[3] 蒋本荣,姚波.淋巴细胞微核检测可用作辐射生物剂量计[J].中华放射医学与防护杂志,1996,16(2):105-108.
JIANG Benrong,YAO Bo.Lymphocyte micronucleus assay can be used as a biological dosimeter in radiation accident[J].Chinese Journal Radiological Medicine Protection,1996,16(2):105-108(in Chinese)
[4] POLYAK K,XIA Z W,EIER J L,et al.A model for p53-induced apoptosis[J].Nature,1997,389:300-305.
[5] 龙贤辉,徐勤枝,贺性鹏,等.2Gy和10Gyγ射线照射正常人淋巴母细胞基因表达转录谱的比较[J].中华放射医学与防护杂志,2006,26(2):110-113.
LONG Xianhui,XU Qinzhi,HE Xingpeng,et al.Comparison of transcription profiles between 2Gy and 10Gy irradiated human lymphoblastoid cells[J].Chinese Journal Radiological Medicine Protection,2006,26(2):110-113(in Chinese).
[6] 龙贤辉,徐勤枝,贺性鹏,等.5cGyγ射线照射正常人淋巴母细胞基因表达转录谱的变化[J].辐射防护,2006,26(2):78-83.
LONG Xianhui,XU Qinzhi,HE Xingpeng,et al.Alterations of transcriptional profile in normal human lymphoblastoid cells by 5cGy ofγ-ray exposure[J].Radiation Protection,2006,26(2):78-83(in Chinese).
[7] NICHOLLS C D,SHIELDS M A,LEE P W,et al.UV-dependent alternative splicing uncouples p53activity and PIG3gene function through rapid proteolytic degradation[J].J Biol Chem,2004,279(23):24 171-24 178.
[8] 刘晓丹,张士猛,李兵,等.60Coγ射线诱导正常人淋巴母细胞XPC mRNA表达的剂量相关性研究[J].癌变·畸变·突变,2011,31(6):434-441.
LIU Xiaodan,ZHANG Shimeng,LI Bing,et al.Dose-dependent inducible expression of XPC mRNA in human normal lymphoblastoid cells by60Coγ-rays[J].Carcinogeneisi,Teratogenesis &Mutagenesis,2011,31(6):434-441(in Chinese).
[9] 潘艳,李玉文,封江彬,等.60Coγ射线照射淋巴细胞诱导PIG3和GADD45基因mRNA变化[J].辐射研究与辐射工艺学报,2008,26(5):309-313.
PAN Yan,LI Yuwen,FENG Jiangbin,et al.Changes of PIG3and GADD45gene expression induced by60Coγ-rays in lymphoblastoid cells[J].J Radiat Res Radiat Process,2008,26(5):309-313(in Chinese).
[10]QIN Xia,ZHANG Shimeng,LI Bing,et al.p53-dependent upregulation of PIG3transcription byγ-ray irradiation and its interaction with KAP1in responding to DNA damage[J].Chinese Science Bulletin,2011,51(30):3 112-3 171.
mRNA Expression of Genes PIG3 and Cell Cycle Change of AHH-1 Cell Induced by Proton
KONG Fu-quan1,MA Nan-ru1,SUI Li1,*,WNAG Xiao1,LIU Xiao-dan2,ZHANG Xiao-ling1,LIU Jian-cheng1,ZHOU Ping-kun2,*
(1.China Institute of Atomic Energy,P.O.Box275-18,Beijing102413,China;2.Beijing Institute of Radiation Medicine,Academy of Military Medical Science,Beijing100850,China)
AHH-1cell was irradiated with proton(21MeV)at Q3Dmagnetic spectrometer of the tandem accelerator to study the dose-and time-effect of PIG3gene mRNA expression in AHH-1cell.Real-time quantitative PCR results show that PIG3gene mRNA expression increases with doses at the different time after proton irradiation.And the PIG3gene mRNA expression changes along with time at each dose.The peak of the PIG3gene mRNA expression appears at 6hfor every dose except the 8Gy at 12h.The results of cell cycle show that the percent of G2/M first increases and then decreases with time.These results show that PIG3gene mRNA expression in the application of biological dosimeter is potential.
proton;PIG3gene;dose;biological dosimeter
Q691.5
:A
:1000-6931(2015)05-0955-06
10.7538/yzk.2015.49.05.0955
2014-01-20;
2014-05-23
孔福全(1979—),男,河北沧州人,副研究员,博士,辐射生物专业
*通信作者:隋 丽,E-mail:lisui@ciae.ac.cn;周平坤,E-mail:zhoupk@nic.bmi.ac.cn

