Kinesin-2家族在模式生物中的功能研究进展
苗珊珊,杨匡,赵呈天
(中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003)
研究进展
Kinesin-2家族在模式生物中的功能研究进展
苗珊珊,杨匡,赵呈天*
(中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003)
Kinesin-2蛋白是Kinesin超级蛋白家族的一个亚家族,成员包括KIF3A,KIF3B,KIF3C以及KIF17。作为分子马达蛋白,Kinesin-2家族成员参与了细胞内多种蛋白复合体及囊泡的运输,对细胞行使各种生物学功能非常重要。近年来发现Kinesin-2在纤毛内物质运输方面发挥重要作用,其功能缺陷可导致纤毛发育异常,进而影响组织器官的发育,并最终导致多种纤毛疾病的形成。本综述将对近期Kinesin-2的研究进展进行介绍,将着重介绍kinesin-2家族成员在模式生物研究中的新进展。
Kinesin-2;模式生物;纤毛;斑马鱼
Kinesin驱动蛋白是生物体内参与物质运输的一类重要分子马达蛋白,该蛋白可利用ATP水解所释放的能量驱动自身及所携带的货物分子沿着微管做连续运动,进而为膜细胞器、蛋白复合体及mRNA等的运输提供动力。目前已发现超过45种kinesin蛋白,根据其结构特征可分为15个kinesin亚家族,其中kinesin-2亚家族是目前已知的参与纤毛内物质运输的主要动力蛋白[1]。
纤毛存在于绝大多数细胞中,由细胞膜表面突起而形成,其结构相对保守,由9个微管二聚体形成的轴丝构成了纤毛的主体支撑结构。根据其结构及运动特征,纤毛可分为运动纤毛和原生纤毛(不动纤毛)两种,其中运动纤毛微管具有动力臂结构,可进行有规则的摆动从而为细胞的运动或表面的液体流动提供动力,而不动纤毛微管不具有动力臂,通常不能自主进行摆动,近年来发现不动纤毛与细胞的多种生理活动密切相关,参与调控多种重要的信号通路,包括Wnt,Hedgehog等[2,3]。对纤毛重要性的认识来源于近年来对纤毛发育缺陷相关遗传疾病的研究,纤毛缺陷可导致内脏反转,多指(趾),视觉、嗅觉及听觉的减退,多囊肾,不孕不育等多种临床疾病,一些严重的纤毛疾病(如Meckel-Gruber综合症)可导致胎儿发育的畸形[4,5]。因此,认识纤毛发育的分子机制成为近期的一个热点研究领域。
纤毛内蛋白运输机理的研究是纤毛相关疾病研究的一个核心问题,目前发现纤毛疾病多由纤毛内的重要功能蛋白的运输缺陷所导致,如跨膜蛋白PKD1和PKD2的运输缺陷导致多囊肾的形成,视蛋白opsin的运输缺陷导致色素性视网膜变性等[5]。作为纤毛内运输的主要马达蛋白,对kinesin-2蛋白家族的研究是近期的一个研究重点,包括对其结构,功能及运输机理的研究等。目前发现,kinesin-2蛋白的作用非常广泛,除了在纤毛内发挥运输功能之外,也同时在神经轴突内的运输,有丝分裂,细胞粘连及极性,RNA运输等多个方面发挥功能[6],鉴于篇幅的限制,本综述将无法在这些方面一一展开,将着重介绍kinesin-2成员在几种重要的模式生物发育中的重要功能。
1 Kinesin-2家族成员介绍,结构特征
Kinesin-2家族成员主要包括KIF3A,KIF3B,KIF3C及KIF17,该家族成员在不同物种中的命名有些差异(表1)。Kinesin-2家族蛋白的共同结构特征为:具有结合微管能力的马达结构域均位于蛋白的N端,C端具有货物蛋白的结合特性,而中间部分含有Coiled-Coil蛋白结构域以利于蛋白二聚化的形成。其中KIF3A可与KIF3B(或KIF3C)相互结合,同时其末端可与货物结合蛋白KAP3相互作用,形成Kinesin-II异源三聚体参与货物运输。KIF17自身可以二聚化参与货物的运输[6]。但是这些运输方式并不是绝对的,比如细胞质蛋白RNF33的运输依赖于KIF3A/KIF3B二聚体的存在,但并不需要KAP3[7]。此外,KIF3C除与KIF3A结合外,也有独立于KIF3A运输之外的功能[8],这些结果表明Kinesin-2蛋白家族功能及运输形式的多样性。
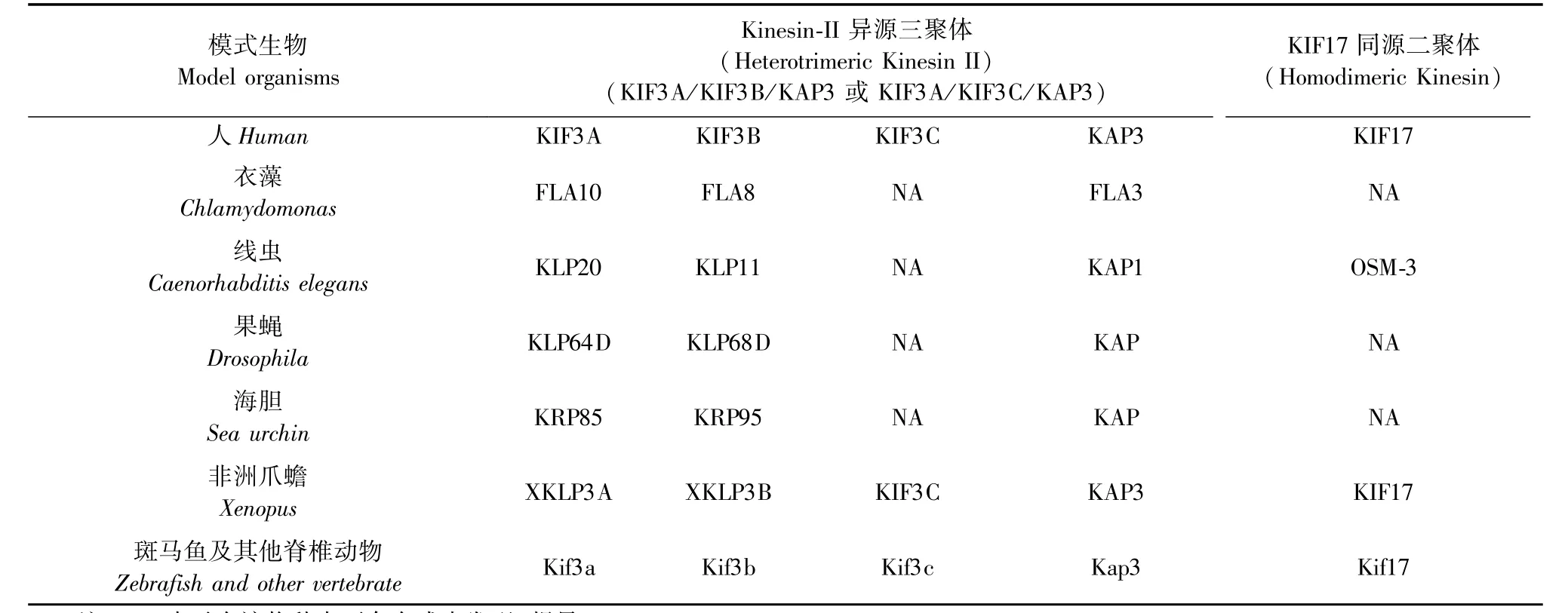
表1 Kinesin-2蛋白成员在不同模式生物中的名称Tab.1 Members of kinesin-2 family proteins in differentmodel organisms
2 模式生物中Kinesin-2研究进展
2.1 衣藻—K inesin-2功能研究的最早模型
纤毛是kinesin-2最主要的运输场所,而这种运输是通过一种叫IFT(intraflagellar transport)的蛋白复合体来完成的。利用微分干涉显微技术,Kozminski等[9]首先在衣藻的纤毛(鞭毛)中观测到了IFT的存在。对IFT运输复合体的研究主要是在衣藻上完成的,目前发现IFT复合体由超过20种IFT蛋白构成,其中包括由6个蛋白组成的IFT-A亚基和约14个蛋白组成的IFT-B亚基[10,11]。IFT蛋白复合体对纤毛内一些重要的结构蛋白(如tubulin)的运输是必需的,而这种运输所需要的动力主要来自于kinesin-2蛋白。目前,衣藻中并没有发现类KIF17同源二聚体的存在,kinesin-II异源三聚体是衣藻鞭毛中主要的运输复合体。衣藻fla10温度敏感型突变体在正常温度(22度)可维持鞭毛正常的功能,在温度转变成32度时,随着FLA10蛋白的缺失,IFT运输逐渐停止,衣藻鞭毛开始分解,并被重吸收至胞体内,而且,衣藻细胞无法产生新的鞭毛,说明kinesin-2复合体对于衣藻鞭毛的形成是必需的[12,13]。衣藻kinesin-2不仅对鞭毛的形成及维持至关重要,在配子之间的结合过程中也发挥关键作用[14]。最近,在对衣藻kinesin-2蛋白FLA8的研究中,清华大学的Liang等[15]发现一个保守的丝氨酸(S663)磷酸化位点,该位点的磷酸化与否可调控kinesin-2与IFT蛋白的结合,进而调节IFT蛋白在鞭毛内的运输。
2.2 线虫—K inesin-2机制研究的奠基模型
对kinesin-2运输机理的研究最重要的贡献来自于对线虫嗅觉纤毛的研究。依据微管排列结构的差异,线虫嗅觉神经元的纤毛可分为近端区和远端区,其中近端区纤毛由9对微管二聚体组成,远端区由9支微管单体组成。在缺失kinesin-II的突变体中,线虫嗅觉神经元ASH/ASI纤毛的轴丝结构正常,而在缺失Osm-3的突变体中,该纤毛轴丝的远端区不能形成[16],在同时缺失kinesin-II和Osm-3的突变体中,IFT停止运输,纤毛轴丝完全缺失[17,18]。Snow等[18]设计了一系列精细的实验,利用荧光标记IFT蛋白,并对其在不同突变体内的运输进行活体观测,发现在线虫纤毛近端区kinesin-II异源复合体和Osm-3同源复合体协同参与物质运输,而在远端区则是Osm-3独自进行蛋白运输。kinesin-II与Osm-3的运输速度也存在差异,荧光标记IFT的实验表明kinesin-II运输IFT的速度在0.4–0.5μm/s,而Osm-3的运输速度相对较快,约1.1–1.3μm/s,在ASH/ASI纤毛的近端区,kinesin-II与Osm-3同时运输货物蛋白,运输速度处于两者单独运输的速度之间[18]。进一步研究发现,BBS蛋白BBS-7和BBS-8在运输中起着稳定IFT蛋白复合体的作用[19]。当然,这种kinesin-2成员之间的协同运输机制并不是唯一的,在线虫的AWB神经元纤毛中,kinesin-II和Osm-3具有相对独立的运输机制[20,21]。对IFT蛋白复合体所运输的货物蛋白到底是什么,一直都缺乏一些直接的证据。Hao等[22]筛选到了一批缺失ASH/ASI纤毛远端区的线虫突变体,并通过实验给出了令人信服的证据,证明纤毛轴丝的基本结构单位—tubulin,通过IFT蛋白复合体来运输。
2.3 斑马鱼—脊椎动物的理想模型
作为脊椎动物模型,斑马鱼在研究kinesin-2及纤毛的发育机制方面具有独特的优势。斑马鱼具有人类多数的器官,纤毛结构与功能与人类似,可以模拟纤毛缺陷所引起的多囊肾,视网膜凋亡,左右不对称缺陷,脑积水等多种疾病,是理想的研究人类纤毛疾病的模式生物。
在斑马鱼上,对kinesin-2蛋白功能的研究主要是通过突变体分析,目前我们及其他一些实验室已经鉴定出了kinesin-2家族的所有斑马鱼突变体。jj203是鉴定出的第一个斑马鱼kinesin-2突变体,在该突变体中由于Kif3b蛋白的突变导致嗅觉神经元、内耳macula、神经丘(neuromast)以及原肾管处的纤毛缺失,表明Kif3b对于这些细胞内的纤毛发育所必需。另一方面,在感光细胞中,Kif3b的缺失导致视杆细胞的快速凋亡,而视锥细胞则发育滞后,并与后期得到部分恢复,这可能与Kif3c的互补功能有关[23]。类似的,通过注射显性抑制型嵌合质粒抑制Kif3b的功能,也可以抑制感光细胞发育[24]。最近,我们发现在kif3b突变体中仍有相当一部分纤毛存在,包括神经系统中绝大多数神经细胞的纤毛以及内耳crista的纤毛等,这可能与Kif3b与Kif3c之间存在互补功能有关(未发表数据)。Kif3b及Kif3c均通过Kif3a发挥运输功能,理论上如果敲除Kif3a可以起到同时抑制Kif3b及Kif3c的作用[8]。的确,在斑马鱼kif3a突变体中,所有的纤毛均不能正常形成(未发表数据),同时突变体具有明显的体轴弯曲和多囊肾现象[25]。
与线虫不同,斑马鱼kif17突变体未见明显发育异常,且可存活至成体,表明Kif17并非斑马鱼发育所必需[23]。在胚胎发育早期,kif17突变体除嗅觉纤毛发育有细微缺陷外,未见其他纤毛的发育异常,同时对幼鱼及成体感光细胞染色也表明,Kif17并非感光细胞存活所必需[23]。有趣的是,通过反义寡核苷酸(morpholino)抑制Kif17的实验表明,Kif17蛋白是感光细胞外节段发育所必需[26]。突变体与morpholino敲降实验的差异可能与morphonino的非特异性有关[27]。但是,最近的研究发现基因敲除和基因敲降并不能完全等同[28],也可能在kif17突变体中激活了一些下游的信号通路,导致胚胎发育的缺陷得到补救,而基因敲降并没有引起这些改变。进一步研究kif17突变体中kinesin-II相关基因的表达是否增加,运输机制是否增强将会对认识脊椎动物kinesin-2的作用机制有帮助。
2.4 小鼠—纤毛疾病的哺乳动物模型
小鼠是最重要的哺乳动物发育生物学模型,易于从事各种复杂的转基因操作和突变体研究。在小鼠中,对kinesin-2家族的研究也比较多。KIF3A在小鼠中首先被Kondo等[29]发现,之后在对Kif3a突变的小鼠研究中,Marszalek等[30]发现小鼠Kif3a突变体存在纤毛发育异常及体轴不对称缺陷,胚胎畸形并早期致死。鉴于KIF3A在胚胎发育中的重要功能,多个实验室利用条件敲除技术,对KIF3A在不同组织内的功能进行了研究,发现KIF3A突变与感光细胞凋亡,多囊肾以及骨骼发育缺陷等多种疾病密切相关[31ˉ35]。上述发育缺陷与KIF3A在纤毛内的运输功能密切相关,近来研究发现,KIF3A也存在一些非纤毛相关的作用机制,如参与调控Wnt信号途径,内耳细胞极性等[36,37]。
相对KIF3A,对KIF3B及KIF3C的研究较少。KIF3B在小鼠中首先被Yamazaki等[38]发现,并证明KIF3B与KIF3A可以相互结合参与物质运输。之后,Nonaka等[39]构建了Kif3b突变体,证明KIF3B是小鼠Node处纤毛发生所必须的,其突变将导致node纤毛发育异常,进而影响胚胎早期左右不对称的发育。KIF3C在小鼠中主要在神经系统中表达[40],对其功能的研究也主要集中在神经系统方面。小鼠Kif3c突变体可以正常存活,说明KIF3C并非小鼠发育所必需的[41]。近期的研究表明KIF3C在调节微管的稳定性方面发挥作用,缺失KIF3C的突变体小鼠虽可正常存活,但在神经细胞受到损伤后,其再生功能受到明显抑制[42]。
小鼠KIF17的功能可能与斑马鱼类似,在纤毛发生方面并不具有明显的作用。对KIF17的研究主要集中在对其在海马神经元内的功能研究:小鼠KIF17可以在海马神经元中参与NMDA受体NR2B的运输,因此过量表达KIF17的转基因小鼠在记忆及行为测试能力方面得到显著增强,而KIF17敲除的小鼠虽然可以正常存活,但记忆能力明显降低[43ˉ46]。
2.5 其他模型生物的研究
相对上述几种模式生物,kinesin-2在其他模式生物中的研究相对较少,但也有一些重要的发现。比如,kinesin-2蛋白最早是在海胆细胞中通过抗体纯化出来的[47]。而在果蝇上的研究表明KLP64D/ KIF3A的缺失可导致胚胎过早死亡,原因可能与kinesin-II在弦音感觉器官(chordotonal organ)的原生纤毛内的运输功能密切相关[48,49]。值得注意的是,果蝇缺失KLP64D对精子的发育没有显著影响[48]。同时,与脊椎动物功能类似,kinesin-II在果蝇上也参与了对Wnt信号通路的调控[2,50]。
3 结论及展望
纤毛内蛋白的运输依赖于kinesin-2蛋白的存在,对其运输机制的研究对纤毛相关遗传疾病的机理研究和基因理疗具有重要的意义。虽然目前对kinesin-2家族在纤毛内的运输功能得到了认同,仍有许多问题需要解决。首先,脊椎动物的纤毛非常多样化,不同组织的纤毛是否具有不同的运输机制?虽然线虫的研究结果表明异源复合体(kinesin-II)和同源复合体(Osm-3)可协同参与纤毛内的运输,但这种运输方式在脊椎动物中是否存在仍不明确。同时,斑马鱼和小鼠中的研究表明KIF17与纤毛的形成并无直接的联系,说明脊椎动物纤毛内的运输机制与线虫并不相同。未来对kinesin-2家族成员在不同组织纤毛内的运输机理研究将显得非常重要,因为这些研究将对进一步认识纤毛疾病的组织器官特异性提供理论依据;其次,越来越多的实验表明,kinesin-2成员除了参与纤毛内的运输之外,在细胞极性的形成,有丝分裂过程,黑色素的运输,神经轴突的发育以及RNA的运输等多个方面发挥作用,说明kinesin-2家族成员的功能非常多样化,这些功能与kinesin-2在纤毛内的运输功能是否存在差异,还需要进一步的研究去验证。此外,纤毛内除了kinesin-2是否还有其他kinesin的存在?目前在纤毛中已经发现kinesin-3家族成员KLP-6参与了IFT的运输,该蛋白是否在脊椎动物纤毛中有类似的机制还不清楚[21]。同时,一些参与调控微管长度的kinesin,包括KIF19A,KIF7以及KIF24等[51ˉ53],它们是如何与kinesin-2蛋白相互协调控制纤毛发育的,也是未来的一个研究方向。
[1] Hirokawa N,Tanaka Y.Kinesin superfamily proteins(KIFs):Various functions and their relevance for important phenomena in life and diseases[J].Exp Cell Res,2015,334(1):16ˉ25.
[2] Satir P,Christensen ST.Overview of structure and function of mammalian cilia[J].Annual Rev Physiol,2007,69:377ˉ 400.
[3] Goetz SC,Anderson KV.The primary cilium:a signalling centre during vertebrate development[J].Nature Rev Genet,2010,11(5):331ˉ344.
[4] Oh EC,Katsanis N.Cilia in vertebrate development and disease[J].Development,2012,139(3):443ˉ448.
[5] Hildebrandt F,Benzing T,Katsanis N.Ciliopathies[J].New Engl JMed,2011,364(16):1533ˉ1543.
[6] Scholey JM.Kinesin-2:a family ofheterotrimeric and homodimeric motors with diverse intracellular transport functions[J].Annu Rev Cell Dev Biol,2013,29:443ˉ469.
[7] Huang CJ,Huang CC,Chang CC.Association of the testis-specific TRIM/RBCC protein RNF33/TRIM60 with the cytoplasmic motor proteins KIF3A and KIF3B[J].Mol Cellular Biochem,2012,360(1ˉ2):121ˉ131.
[8] Muresan V,Abramson T,Lyass A etal.KIF3C and KIF3A form a novel neuronal heteromeric kinesin that associates with membrane vesicles[J].Mol Biol Cell,1998,9(3):637ˉ652.
[9] Kozminski KG,Johnson KA,Forscher P et al.A motility in the eukaryotic flagellum unrelated to flagellar beating[J].Proc Nat Acad Sci U SA,1993,90(12):5519ˉ5523.
[10] Cole DG,Snell WJ.Snap shot:Intraflagellar transport[J]. Cell,2009,137(4):784ˉ784 e781.
[11] Taschner M,Bhogaraju S,Lorentzen E.Architecture and function of IFT complex proteins in ciliogenesis[J].Different Res Biol Diversity,2012,83(2):S12ˉ22.
[12] Kozminski KG,Beech PL,Rosenbaum JL.The Chlamydomonas kinesin-like protein FLA10 is involved in motility associated with the flagellarmembrane[J].JCell Biol,1995,131(6 Pt 1):1517ˉ1527.
[13] Walther Z,Vashishtha M,Hall JL.The Chlamydomonas FLA10 gene encodes a novel kinesin-homologous protein[J].JCell Biol,1994,126(1):175ˉ188.
[14] Pan J,Snell WJ.Kinesin-II is required for flagellar sensory transduction during fertilization in Chlamydomonas[J].Mol Biol Cell,2002,13(4):1417ˉ1426.
[15] Liang Y,Pang Y,Wu Q et al.FLA8/KIF3B phosphorylation regulates kinesin-II interaction with IFT-B to control IFT entry and turnaround[J].Dev Cell,2014,30(5):585ˉ597.
[16] Perkins LA,Hedgecock EM,Thomson JN et al.Mutant sensory cilia in the nematode Caenorhabditis elegans[J].Dev Biol,1986,117(2):456ˉ487.
[17] Pan X,Ou G,Civelekoglu-Scholey G etal.Mechanism of transport of IFT particles in C.elegans cilia by the concerted action of kinesin-IIand OSM-3 motors[J].JCell Biol,2006,174(7):1035ˉ1045.
[18] Snow JJ,Ou G,Gunnarson AL et al.Two anterograde intraflagellar transportmotors cooperate to build sensory cilia on C. elegans neurons[J].Nature Cell Biol,2004,6(11):1109ˉ 1113.
[19] Ou G,Blacque OE,Snow JJ etal.Functional coordination of intraflagellar transport motors[J].Nature,2005,436(7050):583ˉ587.
[20] Mukhopadhyay S,Lu Y,Qin H et al.Distinct IFTmechanisms contribute to the generation of ciliary structural diversity in C.elegans[J].EMBO J,2007,26(12):2966ˉ2980.
[21] Morsci NS,Barr MM.Kinesin-3 KLP-6 regulates intraflagellar transport in male-specific cilia of Caenorhabditis elegans[J]. Curr Biol:CB,2011,21(14):1239ˉ1244.
[22] Hao L,Thein M,Brust-Mascher I et al.Intraflagellar transport delivers tubulin isotypes to sensory cilium middle and distal segments[J].Nature Cell Biol,2011,13(7):790ˉ798.
[23] Zhao C,Omori Y,Brodowska K etal.Kinesin-2 family in vertebrate ciliogenesis[J].Proc Nat Acad Sci U S A,2012,109(7):2388ˉ2393.
[24] Insinna C,Humby M,Sedmak T et al.Different roles for KIF17 and kinesin II in photoreceptor development and maintenance[J].Dev Dyn,2009,238(9):2211ˉ2222.
[25] Ryan S,Willer J,Marjoram L et al.Rapid identification of kidney cystmutations by whole exome sequencing in zebrafish[J]. Development,2013,140(21):4445ˉ4451.
[26] Insinna C,Pathak N,Perkins B etal.The homodimeric kinesin,Kif17,is essential for vertebrate photoreceptor sensory outer segment development[J].Dev Biol,2008,316(1):160ˉ170.
[27] Kok FO,Shin M,NiCW etal.Reverse genetic screening reveals poor correlation between morpholino-induced and mutant phenotypes in zebrafish[J].Dev Cell,2015,32(1):97ˉ108.
[28] Rossi A,Kontarakis Z,Gerri C et al.Genetic compensation induced by deleterious mutations but not gene knockdowns[J]. Nature,2015,524:230ˉ233.
[29] Kondo S,Sato-Yoshitake R,Noda Y et al.KIF3A is a new microtubule-based anterogrademotor in the nerve axon[J].JCell Biol,1994,125(5):1095ˉ1107.
[30] Marszalek JR,Ruiz-Lozano P,Roberts E et al.Situs inversus and embryonic ciliary morphogenesis defects in mouse mutants lacking the KIF3A subunit of kinesin-II[J].Proc Nat Acad Sci U SA,1999,96(9):5043ˉ5048.
[31] Marszalek JR,Liu X,Roberts EA etal.Genetic evidence for selective transport of opsin and arrestin by kinesin-II inmammalian photoreceptors[J].Cell,2000,102(2):175ˉ187.
[32] Koyama E,Young B,Nagayama M etal.Conditional Kif3a ablation causes abnormal hedgehog signaling topography,growth plate dysfunction,and excessive bone and cartilage formation during mouse skeletogenesis[J].Development,2007,134(11):2159 ˉ2169.
[33] Liu B,Chen S,Johnson C et al.A ciliopathy with hydrocephalus, isolated craniosynostosis, hypertelorism, and clefting caused by deletion of Kif3a[J].Reprod Toxicol,2014,48:88 ˉ97.
[34] Lin F,Hiesberger T,Cordes K et al.Kidney-specific inactivation of the KIF3A subunit of kinesin-II inhibits renal ciliogenesis and produces polycystic kidney disease[J].Proc Nat Acad Sci U SA,2003,100(9):5286ˉ5291.
[35] Qiu N,Xiao Z,Cao L et al.Disruption of Kif3a in osteoblasts results in defective bone formation and osteopenia[J].J Cell Sci,2012,125(Pt8):1945ˉ1957.
[36] Sipe CW,Lu X.Kif3a regulates planar polarization of auditory hair cells through both ciliary and non-ciliary mechanisms[J]. Development,2011,138(16):3441ˉ3449.
[37] Corbit KC,Shyer AE,Dowdle WE et al.Kif3a constrains betacatenin-dependentWnt signalling through dual ciliary and nonciliarymechanisms[J].Nature Cell Biol,2008,10(1):70ˉ 76.
[38] Yamazaki H,Nakata T,Okada Y et al.KIF3A/B:a heterodimeric kinesin superfamily protein thatworks as amicrotubule plus end-directed motor formembrane organelle transport[J].JCell Biol,1995,130(6):1387ˉ1399.
[39] Nonaka S,Tanaka Y,Okada Y etal.Randomization of left-right asymmetry due to loss ofnodal cilia generating leftward flow of extraembryonic fluid in mice lacking KIF3B motor protein[J]. Cell,1998,95(6):829ˉ837.
[40] Yang Z,Goldstein LS.Characterization of the KIF3C neural kinesin-likemotor from mouse[J].Mol Biol Cell,1998,9(2):249ˉ261.
[41] Yang Z,Roberts EA,Goldstein LS.Functionalanalysisofmouse kinesin motor Kif3C[J].Mol Cell Biol,2001,21(16):5306ˉ 5311.
[42] Gumy LF,Chew DJ,Tortosa E etal.The kinesin-2 familymember KIF3C regulatesmicrotubule dynamics and is required for axon growth and regeneration[J].J Neurosci,2013,33(28):11329ˉ11345.
[43] Yin X,Takei Y,Kido MA et al.Molecularmotor KIF17 is fundamental formemory and learning via differential support of synaptic NR2A/2B levels[J].Neuron,2011,70(2):310ˉ325.
[44] Guillaud L,Setou M,Hirokawa N.KIF17 dynamics and regulation of NR2B trafficking in hippocampal neurons[J].JNeurosci,2003,23(1):131ˉ140.
[45] Wong RW,Setou M,Teng J et al.Overexpression ofmotor protein KIF17 enhances spatial and working memory in transgenic mice[J].Proc Nat Acad Sci U S A,2002,99(22):14500ˉ 14505.
[46] Setou M,Nakagawa T,Seog DH etal.Kinesin superfamilymotor protein KIF17 and mLin-10 in NMDA receptor-containing vesicle transport[J].Science,2000,288(5472):1796ˉ1802.
[47] Cole DG,Chinn SW,Wedaman KP et al.Novel heterotrimeric kinesin-related protein purified from sea urchin eggs[J].Nature,1993,366(6452):268ˉ270.
[48] Sarpal R,Todi SV,Sivan-Loukianova E et al.Drosophila KAP interacts with the kinesin IImotor subunit KLP64D to assemble chordotonal sensory cilia,but not sperm tails[J].Cur Biol,2003,13(19):1687ˉ1696.
[49] Ray K,Perez SE,Yang Z etal.Kinesin-II is required for axonal transport of choline acetyltransferase in Drosophila[J].J Cell Biol,1999,147(3):507ˉ518.
[50] Vuong LT,Mukhopadhyay B,Choi KW.Kinesin-II recruits Armadillo and Dishevelled for Wingless signaling in Drosophila[J].Development,2014,141(16):3222ˉ3232.
[51] Niwa S,Nakajima K,MikiH etal.KIF19A is amicrotubule-depolymerizing kinesin for ciliary length control[J].Dev Cell,2012,23(6):1167ˉ1175.
[52] He M,Subramanian R,Bangs F et al.The kinesin-4 protein Kif7 regulatesmammalian Hedgehog signalling by organizing the cilium tip compartment[J].Nature Cell Biol,2014,16(7):663ˉ672.
[53] Kobayashi T,TsangWY,Li J et al.Centriolar kinesin Kif24 interacts with CP110 to remodelmicrotubules and regulate ciliogenesis[J].Cell,2011,145(6):914ˉ925.
Research progress on the function of kinesin-2 fam ily proteins in model organisms
MIAO Shan-shan,YANG Kuang,ZHAO Cheng-tian
(Institute of Evolution&Marine Biodiversity,Ocean University of China,Qingdao,Shandong 266003,China)
Kinesin-2 family proteins,including KIF3A,KIF3B,KIF3C and KIF17,aremembers of the kinesin superfamily motor proteins,which transport various proteins and vesicles in the cell and play diverse biological functions. Recently,studies onmembers of kinesin-2 family proteins suggest that they play fundamental roles during ciliary transport,whose defects can lead to abnormal cilia development,themajor cause of human ciliopathies.In this review,we will summarize the functions of thismotor protein family during ciliogenesis and focus mainly on their roles in the development of model organisms.
Kinesin-2;Model organisms;Cilia;Zebrafish
Q95-33
A
1005-4847(2015)05-0517-06
10.3969/j.issn.1005ˉ4847.2015.05.015
2015-08-07
国家自然科学基金项目(31372274,81301718。
苗珊珊(1990ˉ),在读硕士,研究方向:胚胎发育。Email:miaoshan777@126.com
赵呈天,教授,研究方向:胚胎发育。E-mail:chengtian_zhao@ouc.edu.cn