TNF-α 对卵泡内膜细胞睾酮分泌及细胞增殖的影响
吴海明 (广东省惠州市第二妇幼保健院,广东 惠州 516001)
多囊卵巢综合症(PCOS)是一种发病机理尚不清楚的复杂性全身性内分泌神经代谢机制失控症候群,以性腺轴失调为主要症状,一般认为引起该病症发生的原因包括遗传因素、胰岛素抵抗、下丘脑神经内分泌功能异常、肾上腺功能出现亢进等因素,但因上述任一学说均无法对PCOS 病理变化及临床表现进行全面解释,该病症仍是妇科内分泌领域的难点和研究热点[1-2]。部分研究认为,PCOS 的发病原因可能类似动脉粥样硬化以及糖尿病等炎性反应性疾病,其发病原因与白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)以及C-反应蛋白(CRP)等炎性反应因子的高水平表达有关[3-4],为探讨PCOS 发病机制与炎性反应因子TNF-α 之间的关系,在此以猪卵泡内膜细胞为对象进行研究,现报告如下。
1 资料与方法
1.1 仪器与试剂:本研究所用主要仪器包括γ 放射免疫计数器、流式细胞仪、倒置荧光显微镜以及二氧化碳细胞培养箱等,型号分别为安徽合肥中国科技大学中佳公司Gc-91、BDFACSCaibur、Nikon Eclipse TE2000-U 以及HEPA CLASS 100。所用试剂及试剂盒主要包括睾酮放射免疫测定试剂盒,由北京北方生物技术研究所生产;36%乙酸溶液,来自上海化学试剂公司;胎牛血清(FBS,杭州四季青);CFDA SE 细胞增殖与示踪检测试剂盒,来自碧云天生物技术研究所;还包括胰蛋白酶(Sigma),透明质酸酶(Sigma),胶原酶Ⅱ(TBD),DMEM/F12[1∶1培养液(Hyclone)]以及猪重组TNF-α(prospec)。
1.2 方法:取新鲜猪卵巢放置于内含双抗的冰生理盐水中保存2 h,之后进行试验,试验前采用生理盐水对卵巢进行反复冲洗,于平皿中选取直径5 mm 左右的健康卵泡,并采用显微解剖剪于解剖显微镜下将其对半剪开以流出卵泡液。之后挂出卵泡表面颗粒细胞,并使用显微镊剥离呈现帽状的卵泡内膜。剥离后反复采用生理盐水冲洗,之后剪碎加入内含胰蛋白酶、透明质酸酶以及胶原酶Ⅱ的酶液中,并置于二氧化碳培养箱内37℃恒温消化半小时,消化期间可采用移液管反复吹打以加速消化进程。消化后100 目滤网滤过,经过5 min 200 g离心去酶和生理盐水水洗后,将获得的卵泡内膜细胞悬浮于含1%双抗的DMEM/F12 培养基中台盼蓝染色备用[5]。采用CFDA 检测试剂盒对上述备用之猪卵泡内膜细胞进行CFDA 标记,DMEM/F12 稀释,形成细胞悬液。将所得悬浮液加入24 孔培养板中,每孔1 ml,于培养板中加入TNF-α,获 得 浓 度 分 别 为0 pg/ml、10 pg/ml、100 pg/ml 以 及1 000 pg/ml的四个组别浓度,其中不含TNF-α 的组别视为对照组,其余三组为试验组,每种浓度设置3 个重复样。放置于5%二氧化碳培养箱内37℃恒温培养48 h 后换液,换液后72 h 采用流式细胞仪检测卵泡内膜细胞增殖情况[6]。此外,加入TNF-α 后24 h、48 h 及72 h 三个时间点分别采用RIA,即放射免疫分析法测定对照组及试验组中细胞上清液睾酮浓度,并进行对比和统计分析。
1.3 统计学处理:该次研究结果数据均采用Excel 数据库整理且所有统计数据全部在SPSS19.0 统计学软件上予以处理,组间差异均采用χ2检验,P <0.05 为差异有统计学意义。
2 结果
于培养液中加入TNF-α 后,设置浓度分别为10 pg/ml、100 pg/ml 以及1 000 pg/ml 三个组别的试验组,以及一个未加入TNF-α 的对照组分别于24 h、48 h 以及72h 对猪卵泡内膜细胞睾酮水平进行放射免疫分析测定,睾酮水平未见显著变化,与对照组相比差异无统计学意义(P >0.05),具体如表1 所示。培养72 h 后,采用流式细胞仪对培养液总卵泡内膜细胞浓度进行检测,并设置不添加TNF-α 的对照组进行对比,试验组中为卵泡内膜细胞平均荧光强度(MFI)低于对照组,除了TNF-α 浓度为10 pg/ml 的组别,其他组别与对照组对比差异有统计学意义(P <0.05),具体如下表2 所示。可见TNF-α 对卵泡内膜细胞的增殖有明显促进作用,但对于细胞睾酮水平无明显影响。
表1 TNF-α 刺激下卵泡内膜细胞分泌之睾酮变化
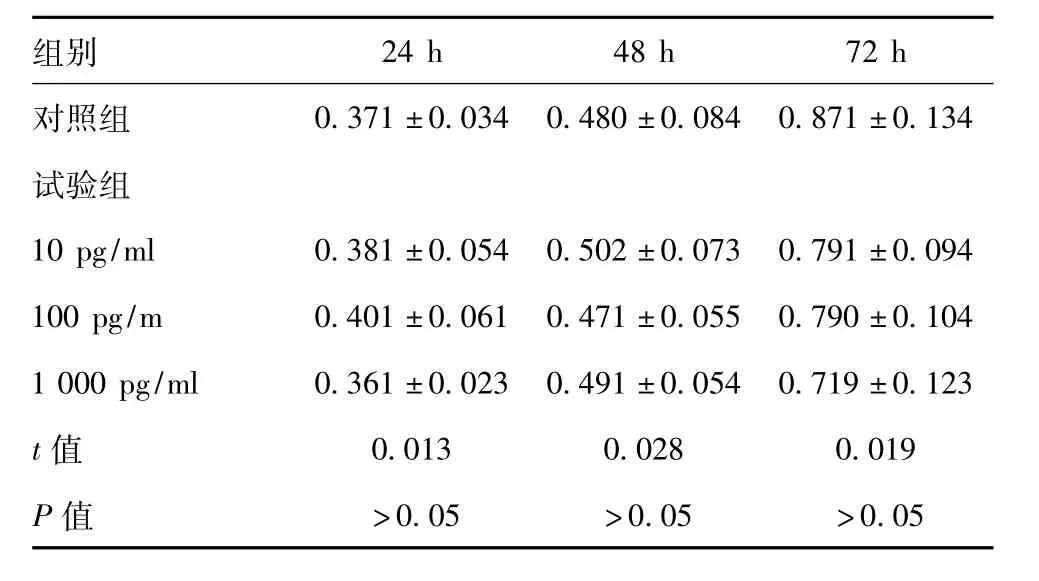
表1 TNF-α 刺激下卵泡内膜细胞分泌之睾酮变化
组别24 h 48 h 72 h对照组0.371±0.034 0.480±0.084 0.871±0.134试验组10 pg/ml 0.381±0.054 0.502±0.073 0.791±0.094 100 pg/m 0.401±0.061 0.471±0.055 0.790±0.104 1 000 pg/ml 0.361±0.023 0.491±0.054 0.719±0.123 t 值 0.013 0.028 0.019 P 值 >0.05 >0.05 >0.05
表2 TNF-α 对猪卵泡内膜细胞增殖情况影响
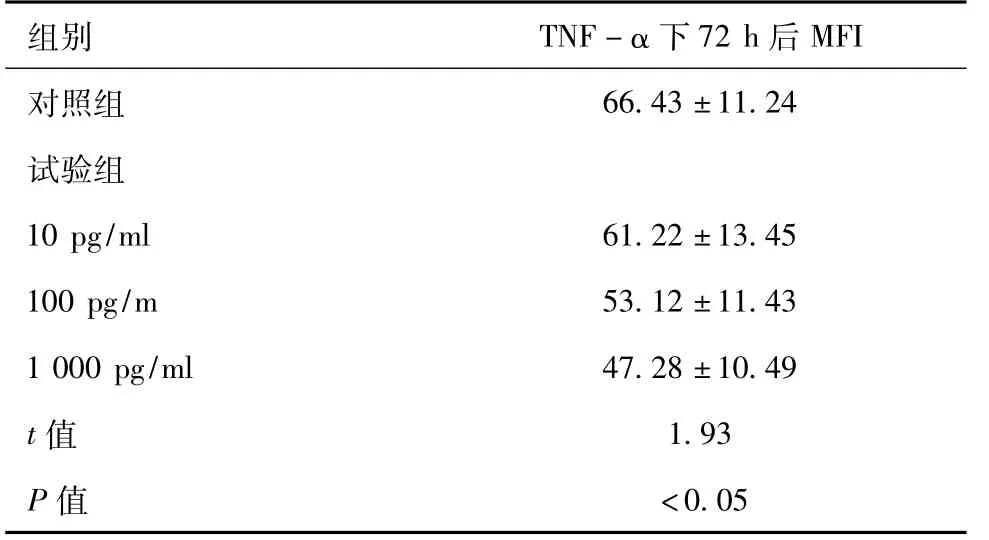
表2 TNF-α 对猪卵泡内膜细胞增殖情况影响
组别 TNF-α 下72 h 后MFI对照组66.43±11.24试验组10 pg/ml 61.22±13.45 100 pg/m 53.12±11.43 1 000 pg/ml 47.28±10.49 t 值 1.93 P 值 <0.05
3 讨论
TNF-α 最初由Shalaby 于巨噬细胞的培养中得到并命名,其来源包括各种表皮细胞、平滑肌细胞以及成纤维细胞和内皮细胞、免疫细胞等,经过活化的单核巨噬细胞是其最主要的产生来源。TNF-α 具有多种较强的生物学活性,可有效提高机体内中性粒细胞的吞噬杀伤能力,加强抗体依赖细胞介导的细胞毒反应,对机体的抗感染功能有着重要作用,还可有效抑制病毒复制,抑制或杀伤肿瘤细胞,并对机体内脂肪代谢和糖代谢的调节有着重要意义[7-8]。
研究显示,TNF-α 在PCOS 患者中水平明显升高,与该病症的发生有着紧密联系,因而对TNF-α 代谢机理的研究对于PCOS 疾病发生机制研究有着重要价值。本文研究发现,将体外培养的卵泡内膜细胞培养液中加入TNF-α 后,对卵泡内膜细胞的睾酮分泌无明显作用,但显著增强卵泡内膜细胞的增殖能力,该作用可能与PCOS 患者发生的卵泡内膜增生性病变和卵巢白膜增厚情况有着密切联系[9]。部分研究表明,TNF-α 对细胞增殖的激活机制可能与C-Jun 氨基末端激酶等信号传导有关,此外TNF-α 还可以通过引发胰岛素抵抗而间接影响PCOS 的进展[10]。
[1] 杨 华,曾娟花.血清TNF 与2 型糖尿病肾病及其中医证型关系的临床研究[J].西部中医药,2014,27(1):11.
[2] 倪 暾,农媛冰.经阴道超声对多囊卵巢综合征和多卵泡综合征的鉴别诊断价值[J].吉林医学,2011,32(31):6534.
[3] 安 婧,田秀珠,土增荣,等.二甲双胍对多囊卵巢综合征大鼠卵巢肿瘤坏死因子-α 表达及血清激素的影响[J].中国药物与临床,2010,10(9):1000.
[4] 刘艳巧,党慧敏,刘润侠,等.助孕胶囊对多囊卵巢大鼠血清性激素及卵巢肿瘤坏死因子α 表达的影响[J].湖南中医药大学学报,2007,27(4):32.
[5] 吴勇宏,雷 健,柯于鹤,等.冠心通脉胶囊对冠心病心绞痛患者白细胞介素6 和肿瘤坏死因子α 的影响[J].中医临床研究,2014,1(4):12.
[6] 费志医.剖宫产术中发现卵巢多发性卵泡囊肿58 例临床分析[J].吉林医学,2010,31(21):3432.
[7] 余 帆.肥胖型多囊卵巢综合征患者血清炎症因子的变化及二甲双胍干预效果的临床研究[J].中国妇幼保健,2011,26(25):3878.
[8] lks CM,Francis J.Central adiposity,systemic inflammation,and the metabolic syndrome[J].Curr Hypertens Rep,2010,12(2):99.
[9] Guzelmeric K,Alkan N,Pirimoglu M,et al.Chronic inflammation and elevated homocysteine levels are associated with increased body mass index in women with polycystic ovary syndrome[J].Gynecol Endocrinol,2009,23(9):505.
[10] Benson S,Janssen OE,Hahn S,et al.Obesity,depression,and chronic low-grade inflammation in women with polycystic ovary syndrome[J].Brain Behav Immun,2008,22(2):177.

