小分子干扰RNA沉默GLI1基因抑制U87胶质瘤细胞的增殖
马剑波孙恺马冲曹垒赵建平陈陆馗
·基础研究·
小分子干扰RNA沉默GLI1基因抑制U87胶质瘤细胞的增殖
马剑波1孙恺2马冲3曹垒3赵建平3陈陆馗4
目的 通过研究小分干扰RNA(siRNA)沉默胶质瘤相关癌基因1(GLI1)后对U87胶质瘤细胞的细胞增殖的影响。 方法 通过合成并转染siRNA抑制U87细胞内GLI1的表达,并记为GLI1 siRNA组,转染无意义的siRNA和未转染siRNA的细胞作为对照组。采用MTT法分析各组U87细胞的增殖,采用流式细胞技术分析各组细胞周期变化。 结果 Western blotting结果显示,与对照组和空白对照组相比,实验组U87细胞内GLI1的表达量显著下降(P<0.05);MTT实验发现,U87细胞的活性与阴性对照组和空白对照组相比显著下降,并且随着培养时间的延长,细胞的活性下降程度越明显(P<0.05);通过流式细胞术分析细胞周期显示,与对照组相比,实验组U87细胞的细胞周期被阻滞于G1期,并且其S期细胞的数量明显下降(P<0.05)。 结论 抑制GLI1的表达可有效抑制U87胶质瘤细胞的增殖,提示GLI1可作为胶质瘤的一种潜在治疗靶点。
胶质瘤相关癌基因1; siRNA; 胶质瘤
胶质瘤相关癌基因1(glioma associated oncogene 1,GLI1)是GLI家族中参与Sonic hedgehog(Shh)信号通路的重要转录因子。HH/Gli1(Hedgehog/Gli1)信号通路是参与人类胚胎期形成发育的经典信号通路,在胚胎发育期甚至发育期后的细胞生长及分化过程中扮演了至关重要的角色。GLI1是Hedgehog/ Gli1细胞通路中主要的下游转录因子之一,其表达的GLI1蛋白也受该通路的调节。GLI1的表达可作为Hedgehog/Gli1细胞通路激活的典型标志[1-3]。研究表明,Hedgehog/Gli1通路参与调节细胞的生长,存活和分化等生物学过程,其中GLI1被证实与许多恶性肿瘤密切相关。然而,对于GLI1在中枢神经系统肿瘤中发挥的作用,目前尚不清楚。本研究通过设计合成针对于GLI1的小分子干扰RNA(siRNA),观察其抑制GLI1的表达后对胶质瘤细胞生长的影响,从而为胶质瘤的治疗提供新的选择方向。
材料与方法
一、材料
U87胶质瘤细胞购自中国上海生命科学院生物细胞研究所;抗GLI1单克隆抗体购自美国Cell Signal Technology公司。
二、方法
1.细胞培养:U87细胞培养于含10%灭活胎牛血清的培养基中,并置于含5%CO2的37℃细胞培养箱内培养。每2~3 d传代1次,取对数生长期的细胞用于实验。
2.设计并合成siRNA:根据GLI1基因的cDNA序列,本实验采用与国际siRNA设计原则相符的全基因组分析和序列同源性分析两种方法进行设计,目标siRNA序列由上海吉玛制药技术有限公司提供,目标序列为5′-GGACCACCGCATCTCTACA-3′。
3.siRNA转染:利用LipofectamineTM2000转染试剂,我们将U87细胞接种于6孔板中,siRNA GLI1组和异阴性对照组的siRNA最终浓度为100 nmol/L。培养72 h后,观察并测定RNA干扰情况,并进行下一步细胞学分析。
4.细胞生长分析:取对数生长期细胞,制成单细胞悬液,调整细胞浓度至104/mL并接种于96孔培养板,设6个复孔(空白对照组,阴性对照组,实验组),分别于转染后12、24、48、72 h每孔加人5 μl MTT(5 g/L),继续培养4 h弃上清,加二甲基亚砜150 μl,室温静置15 min,振荡10 min至紫色结晶完全溶解,置酶标仪490 nm波长处测各孔吸光度值。试验重复3次,绘制细胞增殖曲线。
5.Western blotting分析GLI1蛋白的表达:将U87细胞加入至150 ml细胞裂解液中,于冰上孵育30 min,随后在4℃下12 000 r/min离心15 min,收集上清液。蛋白经电转移转至硝酸纤维素膜,4℃封闭过夜。TBST洗膜30 min后加入一抗(Gli1∶1 000,GAPDH 1∶1 000),室温下孵育2 h;TBST洗膜30 min,加入二抗(1∶6 000)室温孵育1 h,TBST洗膜30 min,加入ECM试剂,暗室曝光,显影,定影,并拍照。
6.流式细胞术分析细胞周期:用0.9 ml磷酸盐缓冲液悬浮细胞制成单细胞悬液,用70%乙醇固定细胞并置于4℃过夜。离心弃乙醇,用磷酸盐缓冲液洗涤细胞2次。加碘化丙啶染色液30 μl,于4℃下避光作用15 min。采用Cell Quest Pro软件观察G0期、G1期、S期各期细胞所占的百分比。
三、统计学分析
应用统计软件SPSS 13.0进行统计学处理。不同时间点阴性对照组与实验组两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
结果
1.siRNA GLI1的抑制效应:以GAPDH作为内参,实验组U87细胞内GLI1的表达量显著下降,而阴性对照组和空白对照组GLI1表达量几乎没有发生变化(图1)。这提示小分子干扰RNA沉默GLI1(si-GLI1)可有效地抑制胶质瘤细胞内GLI1蛋白的表达。
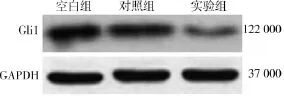
图1 Western blotting分析GLI1蛋白的表达
2.si-GLI1对细胞增殖的影响:通过MTT实验发现,与阴性对照组和空白对照组的细胞相比,实验组细胞的活性显著下降,并且随着培养时间的延长,细胞的活性下降程度越来越明显(P< 0.05)(图2)。
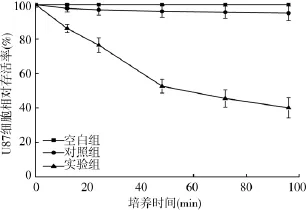
图2 MTT检测转染siRNA-GLI1后不同时间段各组U87细胞增殖的相对存活率(%)
3.si-GLI1对细胞周期的影响:流式细胞术数据表明,与阴性对照组细胞相比,实验组细胞的细胞周期被阻滞于G1期,同时S期细胞的数量明显下降(P<0.05)(图3)。
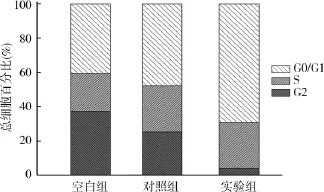
图3 流式细胞术检测各组U87细胞的细胞周期
讨论
据统计,恶性胶质瘤患者的5年生存率低于5%[4]。尽管通过手术切除联合术后化疗治疗恶性胶质瘤已经得到广泛应用,但其实际治疗效果却不尽人意。因此,详细阐明胶质瘤的病理机制成为人们找到治愈恶性胶质瘤的途径的关键要素。
RNA干扰技术(RNAi)最为一种新型的基因沉默技术手段,可以有效地抑制特定目的基因的表达,并具有其他传统技术无法比拟的优越性,通过少量双链RNA分子介导的逐步放大的RNA干扰过程,从而简单、迅速地封闭目的基因[5]。目前,利用siRNA干扰技术干扰Gli-1蛋白表达,抑制其转录活性,可以控制前列腺癌细胞增生,促使癌细胞凋亡[6]。本实验通过应用该技术,成功的抑制了U87胶质瘤细胞的增殖。
Shh信号通路高度保守,并且参与调节胚胎发育的重要环节。Shh通路的异常激活对致癌基因的产生具有重要作用。同时,Shh信号通路也是参与人类恶性胶质瘤细胞增殖的关键通路[7-9]。Shh信号通路主要由Hh配体,受体Ptch、Smo,蛋白激酶A,以及下游的转录因子GLI1组成。正常情况下,PTCH 与SMO结合,抑制了转录因子GLI1对靶基因的转录;在有Hh配体时,HH与PTCH结合,解除对SMO的抑制,进而解除了对GLI1的抑制,最终启动对靶基因的转录[10-11]。研究表明,Hh信号通路的异常激活可诱发许多肿瘤疾病的发生与发展[12-15]。上述结果表明抑制GLI1的表达可有效抑制U87胶质瘤细胞的增殖,这提示笔者针对胶质瘤设计的GLI1 siRNA可以抑制癌基因的表达,为胶质瘤的基因治疗提供了一种新的思路。
[1] Hui CC,Angers S.Gli proteins in development and disease[J]. Annu Rev Cell Dev Biol,2011,27(7):513-537.
[2] Atwood SX,Chang AL,Oro AE.Hedgehog pathway inhibition and the race against tumor evolution[J].J Cell Biol,2012,199 (2):193-197.
[3] Gopinath S,Malla R,Alapati K,et al.Cathepsin B and uPAR regulate self-renewal of glioma-initiating cells through GLI-regulated Sox2 and Bmi1 expression[J].Carcinogenesis,2013,34 (3):550-559.
[4] Wan Y,Sun G,Wang Z,et al.miR-125b promotes cell proliferation by directly targeting Lin28 in glioblastoma stem cells with low expression levels of miR-125b[J].Neuroreport, 2014,25(5):289-296.
[5] Dorsett Y,Tuschl T.siRNAs:applications in functional genomics and potentialas therapeutics[J].Nat Rev Drug Discov,2004,3(4):318-329.
[6] Sanchez P,Hernández AM,Stecca B.Inhibition of prostate cancer proliferation by interference with SONIC HEDGEHOGGLI1 signaling[J].Proc Natl Acad Sci USA,2004,101(34):12561-12566.
[7] Tao Y,Mao J,Zhang Q,et al.Overexpression of Hedgehog signaling molecules and its involvement in triple-negative breast cancer[J].Oncol Lett,2011,2(5):995-1001.
[8] Braun S,Oppermann H,Mueller A,et al.Hedgehog signaling in glioblastoma multiforme[J].Cancer Biol Ther,2012,13(7):487-495.
[9] Wang X,Venugopal C,Manoranjan B,et al.Sonic hedgehog regulates Bmi1 in human medulloblastoma brain tumor-initiating cells[J].Oncogene,2012,31(2):187-199.
[10] Epstein DJ.Regulation ofthalamicdevelopmentby sonic hedgehog[J].Front Neurosci,2012,6(4):57.
[11] Komada M. Sonic hedgehog signaling coordinates the proliferation and differentiation of neural stem/progenitor cells by regulating cellcycle kinetics during developmentofthe neocortex[J].Congenit Anom(Kyoto),2012,52(2):72-77.
[12] Colvin Wanshura LE,Galvin KE,Ye H,et al.Sequential activation of Snail1 and N-Myc modulates sonic hedgehoginduced transformation of neural cells[J].Cancer Res,2011,71 (15):5336-5345.
[13] Wong H,Alicke B,WestKA,etal.Pharmacokineticpharmacodynamic analysis of vismodegib in preclinical models of mutational and ligand-dependent Hedgehog pathway activation[J].Clin Cancer Res,2011,17(14):4682-4692.
[14] Uchida H,Arita K,Yunoue S,et al.Role of sonic hedgehog signaling in migration of cell lines established from CD133-positive malignant glioma cells[J].J Neurooncol,2011,104(3):697-704.
[15] Jagani Z,Mora-Blanco EL,Sansam CG,et al.Loss of the tumor suppressor Snf5 leads to aberrant activation of the Hedgehog-Gli pathway[J].Nat Med,2010,16(12):1429-1433.
Silencing GLI1 by siRNA inhibits the proliferation of glioma U87 cells
Ma Jianbo1,Sun Kai2,Ma Chong3,Cao Lei3,Zhao Jianping3,Chen Lukui4.1Southeast University Medical College,Nanjing 210009 China;2Weifang Medical University,Weifang 261053 China;3Department of Neurosurgery,Xuzhou Central Hospital China;4Department of Neurosurgery,Zhongda Hospital Southeast University,Nanjing 210009 China
Chen Lukui,Email:neuro_clk@hotmail.com.
ObjectiveTo investigate the effect of glioma associated oncogene 1(GLI1) reduction by small interference RNAs (siRNA)on cell proliferation and glucose metabolism of U87 glioma cells.MethodssiRNA for GLI1 was transfected into U87 glioma cells to inhibit the expression of GLI1.The non-transfected cells and cells transfected with non-sense siRNA were used as controls.The proliferation of U87 cells was assessed by MTT assay,and the cell cycle stage was detected by flow cytometry.ResultsThe results of Western blotting showed that GLI1’s expression was significantly down-regulated in GLI1 siRNA group compared to the two control groups(P<0.05);cell proliferation was assessed by MTT assays,cell proliferation was significantly inhibited 3 days after treatment of GLI1 siRNA compared with control groups,and declined with persistently along with the extension of the culture time(P<0.05);the results of flow cytometry showed that the cell cycle was blocked at G1 phase,and the number of cells in S phase declined significantly compared with control groups(P<0.05).ConclusionInterference of GLI1 expression can markedly inhibit the proliferation of U87 glioma cells,indicating that GLI1 can serve as a promising therapeutic target for glioma.
GLI1; siRNA; Glioma
2015-06-28)
(本文编辑:张丽)
10.3877/cma.j.issn.2095-9141.2015.05.008
210009南京,东南大学医学院1;261053潍坊,潍坊医学院2;221009徐州,徐州市中心医院神经外科3;210009南京,东南大学附属中大医院神经外科4
陈陆馗,Email:neuro_clk@hotmail.com
马剑波,孙恺,马冲,等.小分子干扰RNA沉默GLI1基因抑制U87胶质瘤细胞的增殖[J/CD].中华神经创伤外科电子杂志,2015,1(5):286-288.

