拟南芥钙依赖型蛋白激酶突变体cpk3-1和cpk6-1 PCR鉴定及其在CO2通路中的作用
王蕾,张显文,田保华,薛绍武*
(1.山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006;
2.华中农业大学 生命科学技术学院,湖北 武汉 430070;3.山西大学 生命科学学院,山西 太原 030006)
植物通过气孔吸收CO2进行光合作用,同时由于蒸腾作用不可避免的散失水分。植物可以根据外界环境条件调节气孔开度大小来调控水分的散失,同时又保证足够CO2的吸收 保卫细胞离子跨膜运输和有机溶质含量的变化引起保卫细胞膨压和体积的变化,气孔开度也会随之变化[2]。细胞质钙离子(Ca2+)被公认为是植物应对各种胁迫刺激时重要的第二信使,它在植物细胞信号转导过程中起着重要作用[3]。一般认为,细胞响应众多外界胁迫刺激时主要是通过细胞质游离Ca2+浓度([Ca2+]cyt)变化来调控,当受到外界刺激时,细胞外Ca2+的流入以及细胞内钙库的释放,引起[Ca2+]cyt的升高,继而激活可以与Ca2+结合的蛋白质或酶,从而引起细胞反应。在保卫细胞中,[Ca2+]cyt可以调控保卫细胞离子通道和质子泵的活性。[Ca2+]cyt升高可以激活S-型阴离子通道和外向整流钾()通道,从而调控气孔运动[4-5]。
钙依赖性蛋白激酶(calcium dependent protein kinase,CDPK),属于Ser/Thr型蛋白激酶,分子量40~90 k Da,它有3个主要的功能区,其中一个是类似于Ca M的调节区,包含4个EF手型结构,可以结合4个Ca2+[6]。CDPK与Ca2+结合后,酶随即被激活,从而引起下游反应。CDPK作为钙感受器在植物体内分布广泛,在植物生长发育调控及植物应对生物和非生物胁迫中发挥重要作用[7];在众多激素信号网络中,CDPK也是重要的调节因子[8]。拟南芥中有34个CDPK成员,CPK6和CPK3属于CDPK家族的成员[9]。拟南芥CPK 6基因位于第二条染色体上。Xu等研究表明,拟南芥(Arabidopsis thaliana)体内过表达CPK6后,响应盐胁迫和干旱胁迫时,植物体内的丙二醛含量低于野生型,脯氨酸的含量高于野生型,植株的抗旱、耐盐胁迫的能力明显提高,表明CPK6在应对盐胁迫和干旱胁迫过程中起正调控作用。在脱落酸(ABA)和茉莉酸甲酯(MJ)诱导拟南芥气孔关闭过程中,CPK6对阴离子通道和Ca2+通透的非选择性阳离子通道(ICa)起着正调控作用[9-10]。同时,Ye等[11]研究表明CPK6参与了酵母诱导子(YEL)诱导的气孔关闭过程。这些结果说明CPK6是植物响应生物和非生物胁迫诱导气孔关闭信号通路中的重要信号分子。拟南芥CPK 3位于第四条染色体上。CPK3也参与了ABA诱导气孔关闭过程中,可以使Ca2+激活的质膜S型阴离子通道蛋白磷酸化[12]。但是CPK3在MJ和YEL诱导的气孔关闭中不发挥作用,CPK3可能只在干旱诱导的气孔关闭过程中起作用,在应对生物胁迫中不起作用[12]。CPK6和CPK3参与了众多信号分子通路中,在CO2信号通路中有何作用目前尚不清楚。本研究通过PCR技术建立了鉴定钙依赖性蛋白激酶T-DNA插入突变体的快捷方法,并在此基础上,研究了CPK6与CPK3是否参与到CO2的信号过程中,为进一步研究CDPKs的功能提供一些线索。
1 材料与方法
1.1 植物材料及其培养条件
拟南 芥 野 生 型 (Columbia-0,col-0),T-DNA 插 入 突 变 体cpk3-1(SALK-107620)、cpk6-1(SALK-093308)种子购自美国俄亥俄州立大学 Arabidopsis Biological Resource Center(ABRC)。种子先用体积分数70%的酒精加入体积系数0.1%Triton X-100消毒处理,然后将灭菌处理的种子种在盛有1/2 MS培养基的培养皿中,在冰箱4℃春化2 d后转移到人工气候培养箱中,在培养基中生长10 d左右再转移到土中放入生长箱培养。生长环境条件为(22±1)℃,16 h光照/8 h黑暗,相对湿度70%-90%。
1.2 主要试剂
DNA Marker购自北京全式金生物技术有限公司,2×Taq Master Mix、DEPC、Tris等DNA和RNA提取试剂为上海生物工程公司产品,Taq DNA Polymerase,Real-time PCR试剂盒购自 To KaRa公司,R Nasefree DNaseⅠ购自 Thermo Scientific公司,MLV逆转录酶购自Promega公司,Trizol reagent RNA 提取试剂盒为Invitrogen公司产品,引物均由上海生工生物工程股份有限公司合成。
1.3 单株植物总DNA的提取
将拟南芥植株单株编号,参照并改良Edwards等[13]的方法,将DNA extraction buffer+Nuclei lysis buffer+5%sarkosyl(三者比例为1∶1∶0.4)+0.02 mol/L的NaHSO3,混匀作为缓冲液混合物,65℃温育并不断摇晃,直至清亮透明。剪取4-5周大小的拟南芥叶1-2片于1.5 mL离心管中,加入200μL缓冲液混合物,用电钻将叶片打碎后再加500μL缓冲液混合物。将打碎的叶片组织65℃温育40~60 min,1次/10 min,轻轻颠倒混匀。加入750μL氯仿+异戊醇(24∶1),混匀。10℃条件下,12 000 r/min离心8 min。转移上清至一新的1.5 mL离心管中,加2/3-1体积的冷异丙醇,轻轻颠倒混匀。-20℃静置30 min,10℃下,12 000 r/min离心10 min弃上清,用70%乙醇洗涤沉淀。再在10℃下,12 000 r min离心2 min弃上清。在超净台中风干,并加入灭菌的dd H2O溶解DNA。4℃溶解后,-20℃保存作为PCR扩增的DNA模板。
1.4 PCR扩增体系
采用三引物PCR法,以提取的单株植物总DNA为模板,进行PCR扩增。
PCR扩增反应体系:模板DNA 2μL、2×Taq Master Mix 10μL、0.1 mmol/L引物2μL加dd H2O补足20μL。PCR反应条件:94℃预变性3 min;94℃ 变性30 s,58.8℃退火30 s,72℃ 延伸1 min,40个循环;最后72℃ 延伸7 min,4℃保存。
纯合植株获得基因型鉴定所用的引物序列分别为:Salk_LBb1.3:(LB1.3)5’-ATTTTGCCGATTTCGGAAC-3’;cpk3-1:(P31)5’-CTCGTTCCACCACATCTAC-3’(P32)5’-AATTCCCCTCCTTCACACA-3’;cpk6-1:(P63)5’-CCGCGTAAAAGACCTTTCTTC-3’(P64)5’-AGCATAGTCAACACCTGTGGC-3’。
1.5 总RNA的提取和RT-PCR
液氮研磨组织叶片,每个1.5 m L样品管分装0.1 g组织样品;每管加入1 m L Trizol试剂,迅速混匀;室温下静置5 min;加入200μL的氯仿,剧烈震荡摇晃15 s,室温下静置5 min左右;12 000 r/min离心10 min;将上清转移到新离心管中,加0.5 m L异丙醇,混匀,-20℃下沉淀10 min;12 000 r/min离心15 min;弃去上清,加1 m L 75%乙醇清洗RNA,振荡片刻后,7 500 r/min离心5 min,小心弃上清;可重复此操作,确保沉淀中的乙醇被清洗干净,室温静置5~15 min,使RNA沉淀恰好干燥,加入20μL DEPC水溶解RNA,取2μL琼脂糖电泳检测RNA质量与浓度,将剩余RNA保存于-20℃冰箱中备用。
反转录过程和RT-PCR过程的操作均参照标准方法[14]。
反转录后进行基因表达量检测的引物序列分别为:TPC1:(PP01)5’-TTTGTTGATGTGCTGGTTGA-3’(PP02)5’-TAGAGCACGAAGAACACCGA-3’;ACA9:(PP03)5’-TTCATTCACTGGAAGGGAGC-3’(PP04)5’-CCAGTCACCATTCGTACCTT-3’;ACA11:(PP05)5’-ACCTACAGAAAGGGCGATAC-3’(PP06)5’-TGTAGCCACCATTAGGAAGA-3’;CAX1:(PP07)5’-TGACACTCGTTATCGCATTG-3’(PP08)5’-TATGGGTGTTGTATGCCTCA-3’;SLAC1:(PP09)5’-ATTCCACTTTCGCCGACATC-3’(PP10)5’-CTAGGGCAAGCCACAAGACA-3’;MRP5:(PP11)5’-CGCCGCAGTTACATTCGCTAC-3’(PP12)5’-ATTTGCCCAAGCCATCCACC-3’;AKT1:(PP13)5’-ACTACTTTTGGGTCCGATGC-3’(PP14)5’-TTGGGAGTGCATCAAGAGTT-3’;AKT2:(PP15)5’-GCTTCTTGTCCGTGAACCTA-3’(PP16)5’-GTAAGCAGTGAGGCCAAGAT-3’;KAT1:(PP17)5’-GAACCAGAACCTTTAGGGATT-3’(PP18)5’-TTCCAGCGGTTTCACTACTT-3’;KC1:(PP19)5’-TCGTGTAGCCGAACTCTTTA-3’(PP20)5’-GGAGCGGAATAGATGTTGGT-3’;KCO1:(PP21)5’-CACCTCCTCATCCGAGTAAA-3’(PP22)5’-AAGCTGAGATAACCGGCATT-3’;SKOR:(PP23)5’-ATGGCAACTGTTGGTTATGG-3’(PP24)5’-CCAATACACCGTGACAAACA-3’;GORK:(PP25)5’-GGAGTGATTGGTTTGCTTGT-3’(PP26)5’-TCGCAGCGGTTACTATGAGT-3’;ACTIN7:(PP27)5’-GGCCGATGGTGAGGATATTCAGCCACTTG-3’(PP28)5’-TCGATGGACCTGACTCATCGTACTCACTC-3’。
1.6 全叶片气孔导度的测定
取生长4周左右的植株,用光合分析仪(Li6400)对植物叶片进行气孔导度的测定,每1编号最少测3株幼苗,每个编号至少测3株野生型(Col)的植株作为对照,每株植株测1片叶。分别用不同CO2浓度处理每个叶片:400μL/L 0.5 h,800μL/L 1 h,100μL/L 0.5 h,对所得数据进行分析作图。
1.7 CO2对离子通道编码基因表达量的影响
分别选取400μL/L和800μL/L CO2环境下生长的野生型植株和突变体cpk6-1、cpk3-1、cpk3-1/6-1植株叶片,提取总RNA,进行反转录,对四种材料中与离子通道相关的编码基因的表达量进行检测。
2 结果与分析
2.1 CDPK功能缺失突变体cpk6-1、cpk3-1以及cpk3-1/6-1纯合株的鉴定
cpk6-1 T-DNA片段插入点在第二个外显子上,在翻译起始密码子下游60个碱基对的位置,cpk3-1 T-DNA片段插入点在第一个外显子上 图1A 当用引物组合LP+RP进行PCR检测时,野生型植株(Col)目的基因的两条染色体上都没有T-DNA片段的插入,所以只有一条PCR产物带;杂合体植株(heterozygous lines,HZ)目的基因的两条染色体上有一条发生了T-DNA插入突变,所以也会产生一条分子量大小与LP+RP扩出的条带分子量相同的产物带;而纯合体植株(homozygous lines,HM)目的基因的两条染色体上都有T-DNA片段的插入,所以没有产物带产生。同理,当用LB1.3+RP进行PCR检测时,野生型植株没有产物带产生,而杂合体植株与纯合体植株都有一条分子量大小相同的产物带(图1B)。综合两种引物对组合检测结果,鉴定获得纯合体植株。
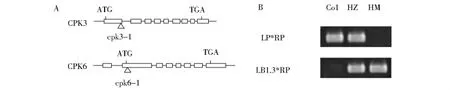
Fig.1 T-DNA insertion sites of cpk6-1 and cpk3-1(A)as well as detection with PCR (B)图1 cpk6-1和cpk3-1 T-DNA插入位点以及PCR检测结果
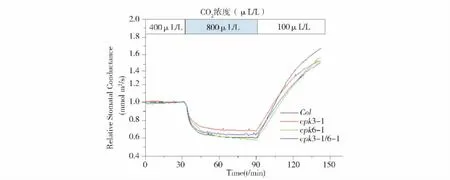
Fig.2 Compare the stomatal conductance of mutants cpk6-1、cpk3-1 and cpk3-1/6-1 with col wild-type plant under different CO2 treatment图2 不同浓度CO2 处理野生型(Col)与突变体cpk6-1、cpk3-1以及cpk3-1/6-1气孔导度变化
2.2 不同浓度CO2 处理突变体cpk6-1、cpk3-1以及cpk3-1/6-1气孔导度变化
为了观察CDPK是否参与CO2的信号过程,我们测定了突变体cpk6-1、cpk3-1以及cpk3-1/6-1在不同浓度CO2处理下的气孔导度变化。从图2中可以看出,野生型对照组与突变体测得的气孔导度曲线轨迹相似,说明在响应不同浓度的CO2时,野生型和突变体cpk3-1、cpk6-1以及cpk3-1/6-1之间没有明显差异(P=0.282(cpk3-1);0.061 2(cpk6-1);0.125(cpk3-1/6-1))。
2.3 CO2对离子通道编码基因表达量的影响
已有研究表明[15],高浓度CO2处理保卫细胞可以激活阴离子通道电流。在此我们研究了野生型植物和突变体cpk6-1、cpk3-1以及cpk3-1/6-1在不同浓度CO2处理下,离子通道表达量的变化。在野生型和三种突变体中,内向整流K+通道(K+in)编码基因KAT1、AKT1、AKT2以及阴离子通道SLAC1与其调节因子编码基因MRP5,外向整流K+通道(K+out)编码基因GORK、KCO1,只有在不同CO2浓度处理后基因表达量表现出差异;相同CO2浓度处理条件下野生型和突变体之间没有明显差异。说明不同浓度CO2处理影响了KAT1、AKT1、AKT2、SLAC1、MRP5、GORK、KCO1的表达量,然而CPK3和CPK6可能没有参与CO2对上述通道基因的表达(图3A)。
Ca2+通道的编码基因TPC1,Ca2+-ATPase编码基因及Ca2+-H+的反向转运蛋白编码基因ACA9、ACA11及CAX1 Kin通道编码基因中KCl及Kout通道编码基因中SKOR 在不同CO2浓度处理前后,野生型和突变体的表达量都没有表现出差异。说明TPC1、Ca2+-ATPase、ACA9、ACA11、CAX1、KC1、SKOR的表达量不受CO2的影响,CPK3和CPK6对这些基因的表达也没有影响(图3B)。图4表示在400μL/L和800μL/L CO2生长条件下野生型和突变体cpk6-1、cpk3-1、cpk3-1/6-1植物离子通道相关基因的表达量的变化。结论与图3一致。
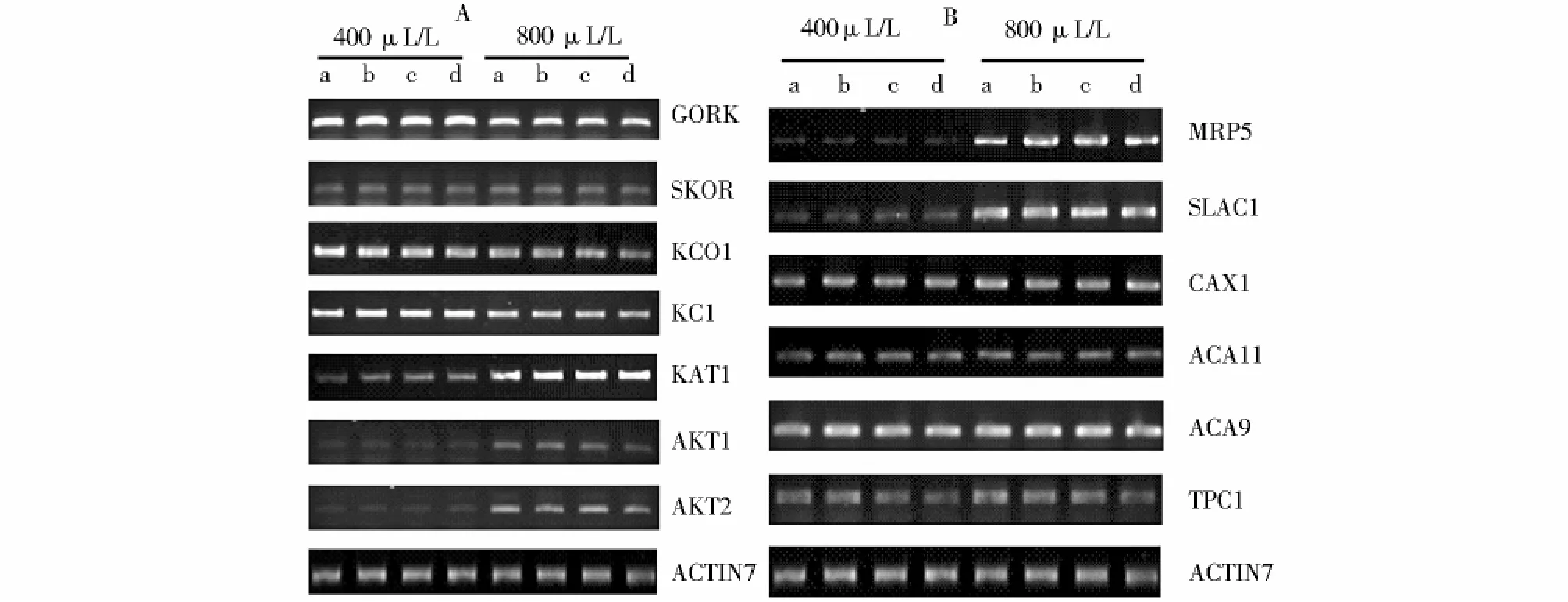
Fig.3 Effect of CO2 on expression of ion channel-related genes Expression of potassium channel-related genes(A),anion channel-and calcium channel-related genes(B)affected by normal and high CO2 in the mutants and wild-type plants图3 CO2对离子通道编码基因表达量的影响
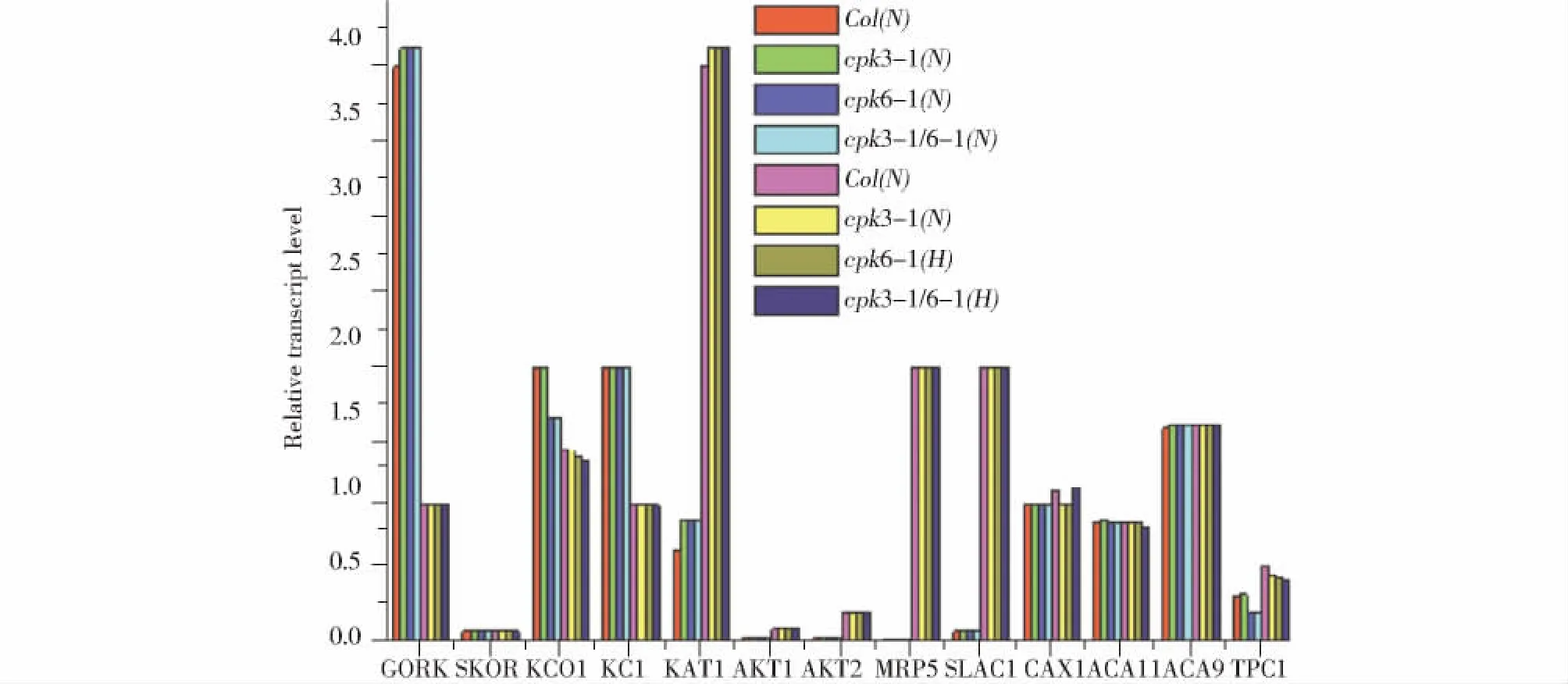
Fig.4 Relative expression level of ion channel-related genes under treatment with normal(N:400μL/L)and high(H:800μL/L)CO2图4 不同浓度CO2对离子通道相关编码基因表达量的影响(图中数据来自图3数据的分析。N:400μL/L CO2,H:800μL/L CO2)
3 讨论
人们很早就认识到低浓度CO2诱导气孔开放,高浓度CO2诱导气孔关闭,但是直到近些年来才逐渐发现参与CO2调控气孔运动的基因。发现参与CO2调控气孔运动的基因是H T 1(HIGH LEAF TEMPERATURE 1),它编码一种蛋白激酶。在功能缺失的突变体ht1中,叶片气孔对CO2反应超敏感,表明HT1是CO2信号中负调控因子 Hu等 研究发现,碳酸酐酶CA1和CA4是高浓度CO2诱导气孔关闭过程中的上游调节因子。CPK3和CPK6在激素ABA诱导气孔关闭过程中起着重要调节作用[9]。本实验通过测定叶片气孔导度应对不同浓度CO2的变化,没有发现CPK3和CPK6参与调节高浓度CO2诱导气孔关闭过程。
当植物受到生物和非生物刺激时,植物细胞能够感受这些刺激并做出响应,多数可以通过细胞质中游离Ca2+浓度变化传递信号。气孔运动主要由保卫细胞膨压变化控制的,保卫细胞质膜上离子通道的活动控制着膨压的变化[2]。保卫细胞通道电流、阴离子通道电流都受到胞质Ca2+的调控[17-18]。当保卫细胞受到高浓度CO2和碳酸氢根诱导后,胞质Ca2+升高,激活慢型阴离子通道,诱导气孔关闭[18-19]。在气孔开放过程中,质膜H+-ATPases能够将细胞内的H+泵至胞外,质膜超极化所产生的电化学梯度作为动力驱动K+、Cl-、NO3-和 Malate2-进入胞内,使保卫细胞的膨压升高,气孔开放[20,21]。然而,低浓度CO2诱导气孔开放的机制目前还不清楚。由于离子通道的活动与气孔运动关系密切,因此研究了不同浓度CO2生长条件下植物离子通道的转录表达水平,并且试图解析CPK3和CPK6是否影响CO2对离子通道的转录表达。本实验发现不同浓度的CO2处理植物在转录水平影响了离子通道相关基因的表达,然而CPK3和CPK6没有参与该过程。
拟南芥中CDPKs家族有34个成员,研究其他成员的功能是未来需要探讨的课题。
[1] 李合生.现代植物生理学(第3版)[M].北京:高等教育出版社,2012:45-53.
[2] Kim T H,Bohmer M,Hu H,et al.Guard Cell Signal Transduction Network:Advances in Understanding Abscisic Acid,CO2,and Ca2+Signaling[J].Annual Review of Plant Biology,2010,61:561-591.
[3] Kudla J,Batistic O,Hashimoto K.Calcium Signals:the Lead Currency of Plant Information Processing[J].The Plant Cell,2010,22(3):541-563.
[4] Schroeder J,Hagiwara S.Cytosolic Calcium Regulates ion Channels in the Plasma Membrane of Vicia Faba Guard Cells[J].Nature,1989,338:427-430.
[5] Ward J M,Schroeder J I.Calcium-activated K+channels and Calcium-induced Calcium Release by Slow Vacuolar Ion Channels in Guard Cell Vacuoles Implicated in the Control of Stomatal Closure[J].The Plant Cell,1994,6(5):669-683.
[6] Cheng S H,Willmann M R,Chen H C,et al.Calcium Signaling Through Protein Kinases.The Arabidopsis Calcium-dependent Protein Kinase Gene Family[J].Plant Physiology,2002,129(2):469-485.
[7] Zou J J,Wei F J,Wang C,et al.Arabidopsis Calcium-dependent Protein Kinase CPK10 Functions in Abscisic Acid-and Ca2+-mediated Stomatal Regulation in Response to Drought Stress[J].Plant Physiology,2010,154(3):1232-1243.
[8] Ludwig A A,Romeis T,Jones J D.CDPK-mediated Signalling Pathways:Specificity and Cross-talk[J].Journal of Experimental Botany,2004,55(395):181-188.
[9] Mori I C,Murata Y,Yang Y,et al.CDPKs CPK6 and CPK3 Function in ABA Regulation of Guard Cell S-type Anion-and Ca2+-permeable Channels and Stomatal Closure[J].PLoS Biology,2006,4(10):e327.
[10] Munemasa S,Hossain M A,Nakamura Y,et al.The Arabidopsis Calcium-dependent Protein Kinase,CPK6,Functions as a Positive Regulator of Methyl Jasmonate Signaling in Guard Cells[J].Plant Physiology,2011,155(1):553-561.
[11] Ye W,Muroyama D,Munemasa S,et al.Calcium-dependent Protein Kinase CPK6 Positively Functions in Induction by Yeast Elicitor of Stomatal Closure and Inhibition by Yeast Elicitor of Light-induced Stomatal Opening in Arabidopsis[J].Plant Physiology,2013,163(2):591-599.
[12] Arimura G,Sawasaki T.Arabidopsis CPK3 Plays Extensive Roles in Various Biological and Environmental Responses[J].Plant Signaling & Behavior,2010,5(10):1263-1265.
[13] Edwards K,Johnstone C,Thompson C.A Simple and Rapid Method for the Preparation of Plant Genomic DNA for PCR analysis[J].Nucleic Acids Research,1991,19(6):1349.
[14] Sambrook J,Russell D W.Molecular Cloning:A Laboratory Manual[M].New York:Cold Spring Harbor,1987.
[15] Hu H,Boisson-Dernier A,Israelsson-Nordstrom M,Bohmer M,Xue S,Ries A,Godoski J,Kuhn J M,Schroeder J I.Carbonic Anhydrases are Upstream Regulators of CO2-controlled Stomatal Movements in Guard Cells[J].Nature Cell Biology,2010,12(1):87-93.
16 Hashimoto M Negi J Young J et al.Arabidopsis HT1 Kinase Controls Stomatal Movements in Response to CO2J.Nat Cell Biol,2006,8(4):391-397.
[17] Siegel R S,Xue S,Murata Y,et al.Calcium Elevation-dependent and Attenuated Resting Calcium-dependent Abscisic Acid Induction of Stomatal Closure and Abscisic Acid-induced Enhancement of Calcium Sensitivities of S-type Anion and Inward-rectifying K Channels in Arabidopsis Guard Cells[J].The Plant Journal,2009,59(2):207-220.
[18] Xue S,Hu H,Ries A,et al.Central Functions of Bicarbonate in S-type Anion Channel Activation and OST1 Protein Kinase in CO2Signal Transduction in Guard Cell[J].The EMBO Journal,2011,30(8):1645-1658.
[19] Young J J,Mehta S,Israelsson M,et al.CO2Signaling in Guard Cells:Calcium Sensitivity Response Modulation,a Ca2+-independent Phase,and CO2Insensitivity of the Gca2 Mutant[J].Proc Natl Acad Sci U S A,2006,103(19):7506-7511.
[20] Schroeder J I,Raschke K,Neher E.Voltage dependence of K Channels in Guard-cell Protoplasts[J].Proc Natl Acad Sci U S A,1987,84(12):4108-4112.
[21] Kwak J M,Murata Y,Baizabal-Aguirre V M,et al.Dominant Negative Guard Cell K+channel Mutants Reduce Inwardrectifying K+Currents and Light-induced Stomatal Opening in Arabidopsis[J].Plant Physiol,2001,127(2):473-485.

