双酶水解玉米醇溶蛋白制备抗氧化肽的工艺优化
徐 飞,成向荣,2,Riyadh,施用晖,2,乐国伟,2,*
(1.江南大学食品学院,营养与功能因子中心,江苏无锡 214122;2.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122)
双酶水解玉米醇溶蛋白制备抗氧化肽的工艺优化
徐 飞1,成向荣1,2,Riyadh1,施用晖1,2,乐国伟1,2,*
(1.江南大学食品学院,营养与功能因子中心,江苏无锡 214122;2.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122)
为了制备抗氧化活性肽,利用 Alcalase 碱性蛋白酶和中性蛋白酶分步酶解玉米醇溶蛋白。在单因素的基础上,以1.1-二苯基苦基苯肼(DPPH·)自由基清除率、羟基自由基清除率和水解度(DH)为响应值,采用响应面(RSM)中心组合实验,选取Alcalase碱性蛋白酶加酶量、中性蛋白酶与Alcalase碱性蛋白酶活力之比、底物浓度为自变量,探讨最佳酶解工艺条件。采用Design-Expert软件,通过响应面优化确定修正后各因素的最佳工艺条件为:Alcalase碱性蛋白酶加酶量12880 U/(g底物)、中性蛋白酶与 Alcalase 碱性蛋白酶活力之比为1∶4,底物浓度为3.4%。在此修正条件下,DPPH· 自由基清除率为42.98%,水解度为32.18%,与预测值的相对误差为1.04%。浓度为20 mg/mL时,玉米醇溶蛋白的DPPH· 自由基清除率和羟基自由基清除率分别为同浓度VC的85.8%和67.0%。
玉米醇溶蛋白,Alcalase碱性蛋白酶,中性蛋白酶,响应面分析法
生物活性肽是特殊蛋白质分子片段,往往具有众多的生理活性,如降血压[1]、降胆固醇[2-3]、抗疲劳[4]、抗肿瘤作用[5],抗氧化作用[6]和促进乙醇代谢[7]等。活性肽是特殊的蛋白质氨基酸片段,天然状态下的活性肽含量少,而且不易实现分离[8]。有研究表明,双酶协同水解比单一的蛋白酶进行水解效果更好,水解度更高[9-11]。目前研究主要以水解度为指标对玉米醇溶蛋白酶解工艺进行优化,但是有研究表明蛋白质酶解产物的水解度与其抗氧化活性在一定范围内不存在线性关系,抗氧化活性不一定随着水解度增大而增大[12]。单纯的追求高水解度,有可能会使抗氧化活性降低[13]。因此,本文选取水解玉米蛋白常用的Alcalase碱性蛋白酶和中性蛋白酶进行分步酶解实验,并以DPPH·自由基清除率、羟基自由基清除率和水解度(DH)为检测指标对酶解工艺进行优化,寻找最佳的水解条件以制备高活性抗氧化活性肽。
1 材料与方法
1.1 材料与仪器
玉米醇溶蛋白 吴江市八坼药用辅料厂;Alcalase碱性蛋白酶(20×104U/g) Novo 公司;中性蛋白酶(5×104U/g) 夏盛公司;二苯代苦味酰基苯肼(DPPH·) Sigma公司;福林酚试剂 国药集团化学试剂有限公司;菲啰啉 国药集团化学试剂有限公司;抗坏血酸 国药集团化学试剂有限公司;其它试剂 均为分析纯。
高速大容量冷冻离心机 Eppendorf公司;Delta320 pH计 梅特勒-托利多仪器(上海)有限公司;DF-101S 集热式磁力加热搅拌器 金坛市医疗仪器厂;FD-1CE冷冻干燥机 北京天佑科技有限公司;DK-600型 电热恒温水槽 上海精宏实验设备有限公司;UV-2100 型紫外可见分光光度计 尤尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 双酶分步酶解方法 首先,配制浓度为0.03%的Na2SO3水溶液,量取一定体积加入到水解反应器中,用1 mol/L的NaOH溶液调节pH至8.5,同时将温度稳定在55 ℃,然后边搅拌边快速加入玉米醇溶蛋白粉,形成分散悬浮液,然后加入Alcalase碱性蛋白酶进行水解反应。反应过程中以1 mol/L的NaOH水溶液维持溶液pH恒定。待水解2 h后用0.1 mol/L HCl水溶液调节溶液pH至7.5,温度降至50 ℃,然后加入适量的中性蛋白酶,水解1 h后立即在95 ℃水浴中静置灭酶10 min,然后在4 ℃、10000 r/min下离心20 min,收集上清液,定容到同一浓度进行活性测定。
1.2.2 DPPH·自由基清除能力的测定 将待测样品定容到同一浓度,取1.5 mL待测样品,加入 1×10-4mol/L DPPH·的无水甲醇溶液1.5 mL,混合均匀后在室温下避光反应30 min,然后在517 nm下测定吸光度,空白组以等体积无水甲醇代替DPPH·溶液,对照组以等体积蒸馏水代替样品,以无水乙醇空白调零[14]。DPPH·自由基清除率的计算公式为:
式中:ODi-样品组(样品+DPPH·);ODj-空白组(样品+无水甲醇);OD0-对照组(蒸馏水+DPPH·)。
1.2.3 清除羟基自由基活性的测定 采用Sminoff[15]的水杨酸钠方法,并略有改动。取2.3mmol/LFeSO4溶液1mL,加入2.3mmol/L水杨酸钠-乙醇溶液1mL,样品溶液0.5mL,最后加入1mL2.2mmol/LH2O2溶液,37 ℃反应1h后,于510nm下测定吸光值。计算公式如下:

1.2.4 蛋白含量测定 采用Folin-酚试剂法测定蛋白质含量[16]。
1.2.5 水解度的测定 pH-stat法[17]和甲醛滴定法[18]。
1.3 实验设计
1.3.1 双酶分步水解玉米醇溶蛋白的单因素实验 分别固定Alcalase碱性蛋白酶和中性蛋白酶最适温度和pH,以Alcalase碱性蛋白酶加酶量、中性蛋白酶与Alcalase碱性蛋白酶活力之比、底物浓度作为实验因素,以DPPH·自由基清除率、羟基自由基清除率和水解度(DH)作为考察指标进行实验设计。
1.3.2 双酶分步水解的响应面优化实验 固定酶液pH、温度和酶解时间条件,在单因素实验基础上,运用Box-Behnken中心组合设计实验,选择Alcalase碱性蛋白酶加酶量(X1)、中性蛋白酶与Alcalase碱性蛋白酶活力之比(X2)、底物浓度(X3)为因素变量,以酶解液DPPH·自由基清除率(Y1)羟基自由基清除率(Y2)和水解度(DH,Y3)为作为响应变量。实验设计与分析采用Design-expert.V8.0.6。

表1 单因素实验因素和水平
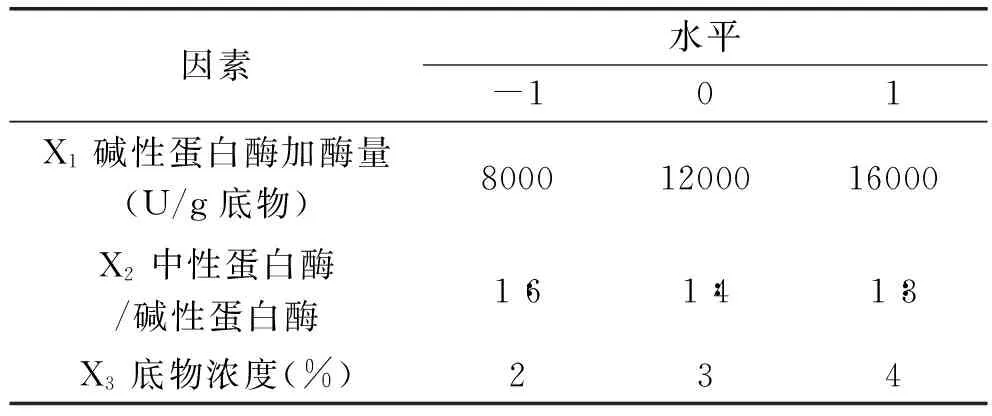
表2 响应面实验设计因素水平及编码
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 Alcalase碱性蛋白酶加酶量对玉米醇溶蛋白水解效果的影响 固定底物浓度4%,中性蛋白酶与Alcalase碱性蛋白酶活力之比为1∶6,考察不同Alcalase碱性蛋白酶加酶量对DPPH·自由基清除、羟基自由基清除率和水解度(DH)的影响,结果如图1所示。
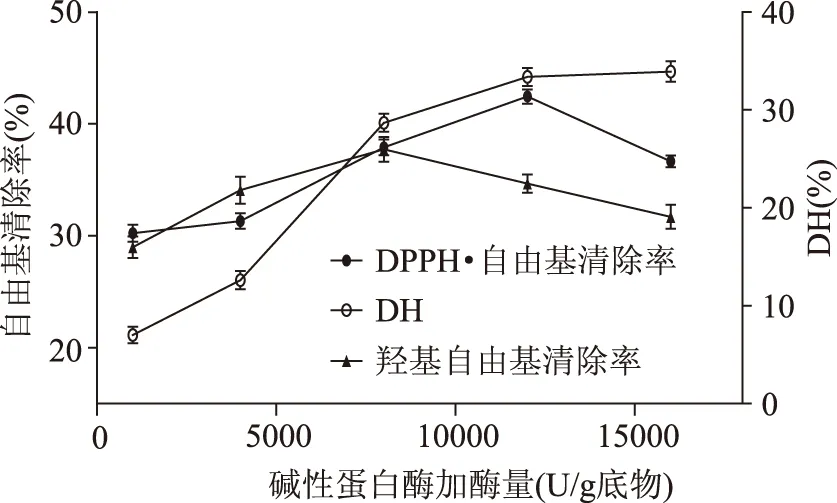
图1 Alcalase碱性蛋白酶加酶量对玉米醇溶蛋白水解效果的影响Fig.1 Effect of Alcalase dosage on hydrolysis of zein
由图1可知,加酶量达到12000 U/(g底物)时,DPPH·自由基清除率达到最大值42.5%;当加酶量达8000 U/(g底物)时,羟基自由基清除率达到最大值37.7%。水解度随着加酶量的增大而增大,但是DPPH·自由基清除率和羟基自由基清除率达到最大值以后活性反而下降,这可能是由于随着水解度增大,具有抗氧化活性的多肽继续水解为无抗氧化活性的短肽或氨基酸,导致抗氧化活性降低[13]。
2.1.2 中性蛋白酶与Alcalase碱性蛋白酶活力之比对玉米醇溶蛋白水解效果的影响 固定底物浓度为4%,Alcalase碱性蛋白酶加酶量为12000 U/(g底物),考察不同中性蛋白酶与Alcalase碱性蛋白酶活力之比对DPPH·自由基清除率、羟基自由基清除率和水解度(DH)的影响。结果如图2所示。
由图2可知当中性蛋白酶与Alcalase碱性蛋白酶活力之比达到1∶6之时,羟基自由基清除率达到最大值。酶活力之比为1∶4时,DPPH·自由基清除率达到最大值。图1和图2中,随着中性蛋白酶与Alcalase碱性蛋白酶活力之比以及加酶量增大,水解度也逐渐增大,但当酶活力之比达到一定值以后变化趋于平缓。这可能是由于加酶量过度增大,蛋白酶之间产生竞争性抑制[19],从而限制水解效率。
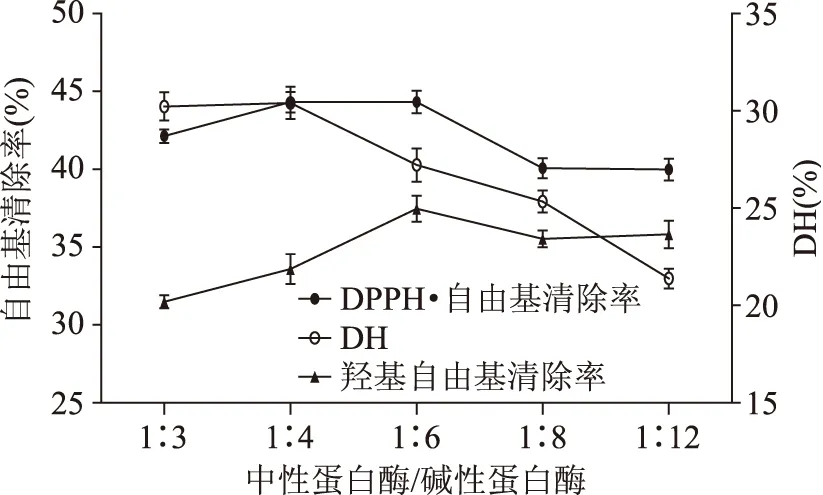
图2 中性蛋白酶与Alcalase碱性蛋白酶活力之比对玉米醇溶蛋白水解效果的影响Fig.2 Effect of Neutral protease/Alcalase on hydrolysis of zein
2.1.3 底物浓度对玉米醇溶蛋白水解效果的影响 固定Alcalase碱性蛋白酶加酶量为12000 U/(g底物),中性蛋白酶与Alcalase碱性蛋白酶活力之比为1∶6,考察不同底物浓度对DPPH·自由基清除率、羟基自由基清除率和水解度(DH)的影响。结果如图3所示。
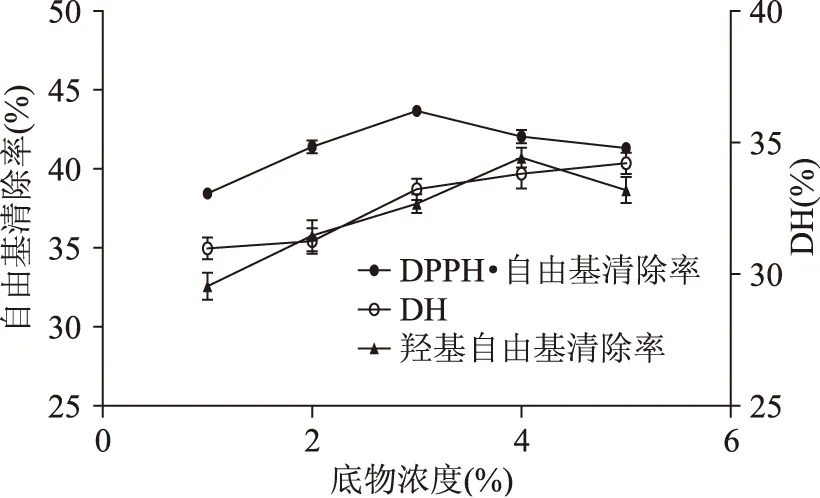
图3 底物浓度对玉米醇溶蛋白水解效果的影响Fig.3 Effect of substrate concentration on hydrolysis of zein
由图3可知当底物浓度达到3%时,DPPH·自由基清除率达到最大值;当底物浓度达到4%时,羟基自由基清除率达到最大值。水解度(DH)随着底物浓度的增大而增大,但整体变化缓慢。这可能是因为浓度过高,不利于玉米醇溶蛋白的充分分散,降低了酶与底物的接触,从而影响了水解[20]。
综上所述,响应面实验设计因素水平及编码见表2。
2.2 响应面实验设计及结果
2.2.1 回归方程的建立 对Alcalase碱性蛋白酶加酶量、中性蛋白酶与Alcalase碱性蛋白酶活力之比、底物浓度3个因素分别在3个水平上进行中心组合设计,共15次实验,其中12次为分析因子,3次为中心点估计误差。实验设计及结果如表3。
由表3可见,达到最大DPPH·自由基清除率、羟基自由基清除率具有一定的相似性,但是抗氧化活性与水解度的因素条件并不完全一致,说明水解度和抗氧化活性之间不是线性关系。
利用Design-Expert软件对表3中的实验数据进行回归分析,以DPPH·自由基清除率(Y1)为因变量,各因素为自变量,对模型进行多次拟合,得到碱性蛋白酶加酶量(X1)、中性蛋白酶/碱性蛋白酶(X2)、底物浓度(X3)为:
Y=43.43+1.15X1+0.15X2+0.19X3-0.047X1X2+0.79X1X3-0.49X2X3-1.18X12-0.88X22-3.85X32
对该模型方程进行方差分析,结果及模型系数显著性检验如表4。
结合软件分析结果和成本问题,确定制备抗氧化活性肽的最优酶解工艺条件为:Alcalase碱性蛋白酶加酶量为12880 U/(g底物),中性蛋白酶与Alcalase碱性蛋白酶活力比例为1∶4,底物浓度为3.4%。在此条件下DPPH·自由基清除率和水解度预测值分别为43.43%和32.84%。
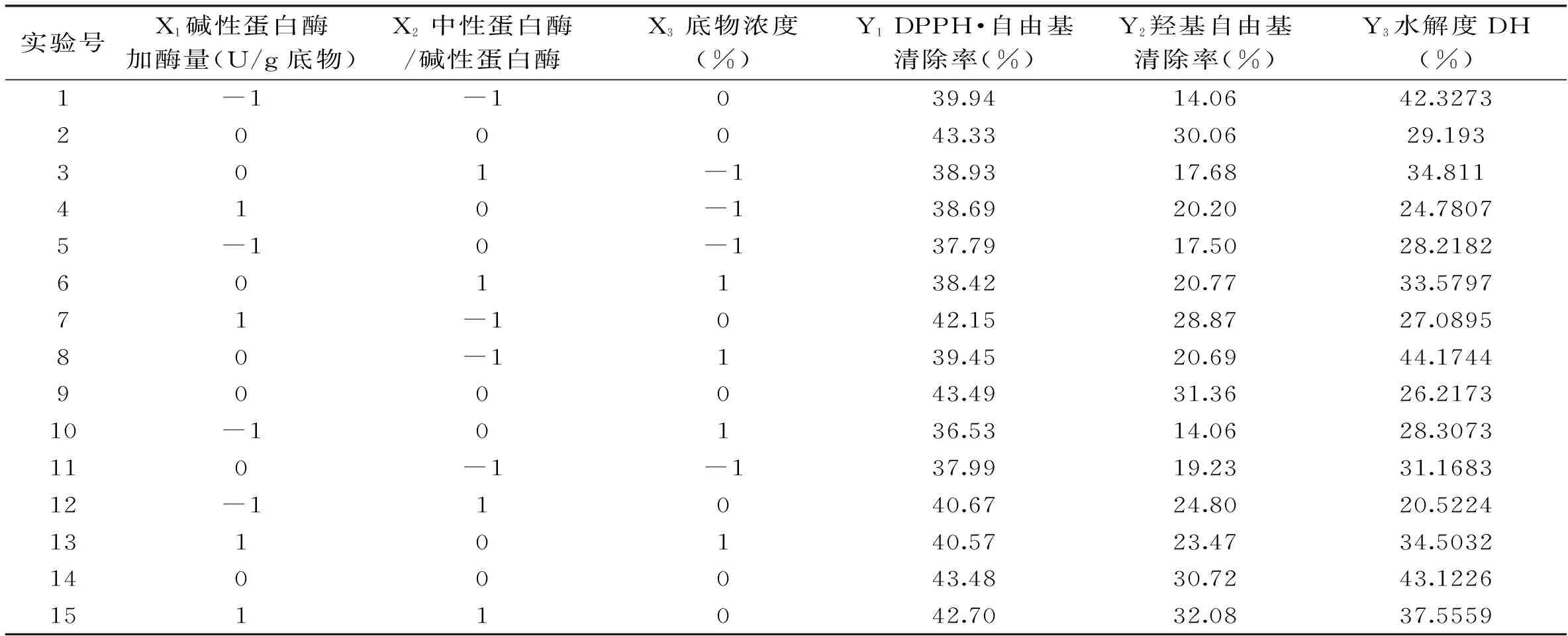
表3 Box-Behnken 实验设计及结果
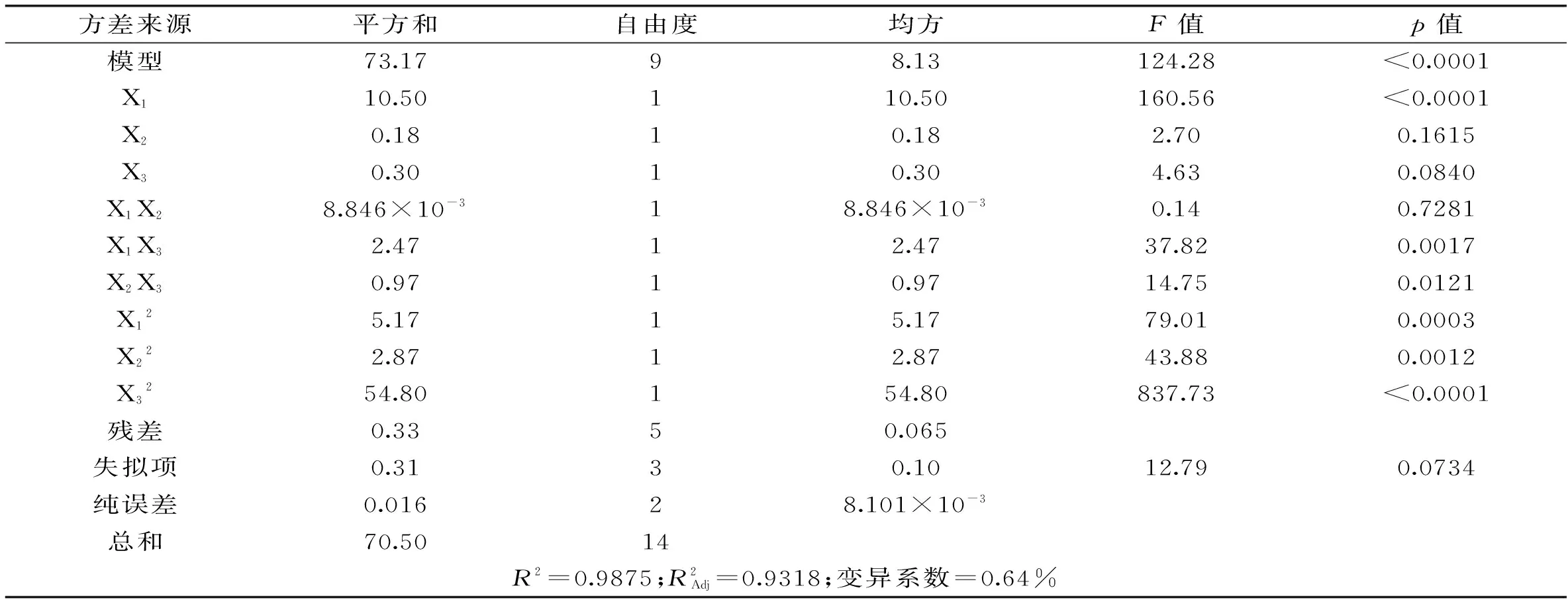
表4 玉米醇溶蛋白水解液DPPH·自由基清除能率的回归模型方差分析及模型系数显著性检验
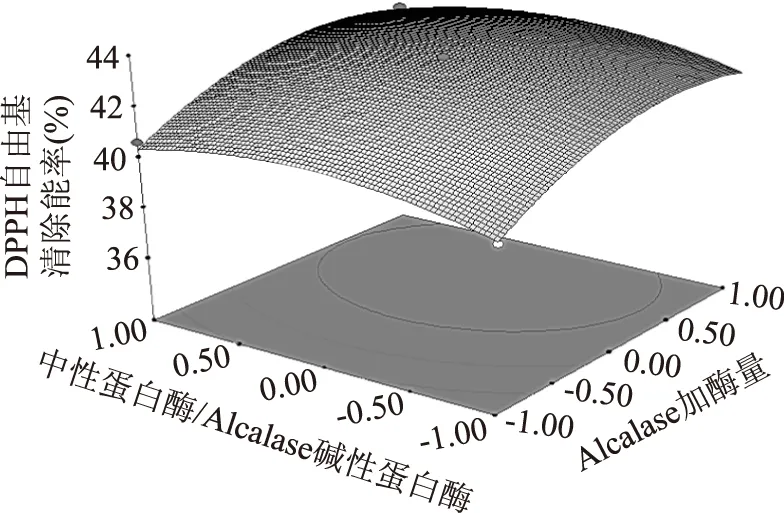
图4 酶活力之比和Alcalase 2.4L 加酶量之间的响应面图Fig.4 The response surface graph between the neutral protease/Alcalase and Alcalase dosage
注:p<0.05.影响显著;p<0.01.影响极显著。
2.2.2 响应面分析 各因素对DPPH·自由基清除率的交互作用见图4、图5和图6。图4可以看出中性蛋白酶与Alcalase碱性蛋白酶活力之比不变,随着Alcalase碱性蛋白酶加酶量的增加,DPPH·自由基清除率也随之增加;Alcalase碱性蛋白酶加酶量不变,随着中性蛋白酶与Alcalase碱性蛋白酶活力之比的增大,DPPH·自由基清除率变化不明显。
由图5可见:底物浓度不变,随着Alcalase碱性蛋白酶加酶量的增加,DPPH·自由基清除率随之增加,达到最大值时略有下降;Alcalase碱性蛋白酶加酶量不变,随着底物浓度的增加,DPPH·自由基清除率先上升,达到最大值以后开始下降,变化比较明显。由图6可见:底物浓度不变,随着中性蛋白酶与Alcalase碱性蛋白酶活力之比的增大,DPPH·自由基清除率略有增加,然后趋于平缓;中性蛋白酶与Alcalase碱性蛋白酶活力之比不变,随着底物浓度的增加,DPPH·自由基清除率显著增加,达到最大值后又显著下降,呈现二次函数关系。

图5 底物浓度和Alcalase碱性蛋白酶加酶量之间的响应面图Fig.5 The response surface graph between the substrate concentration and Alcalase dosage
2.2.3 最佳提取工艺的优化及验证 为验证模型的可靠性和实验操作方便,采用修正后的酶解条件即Alcalase碱性蛋白酶加酶量为12880 U/(g底物),中性蛋白酶与碱性蛋白酶活力之比为1∶4,底物浓度为3.4%进行玉米醇溶蛋白的酶解实验,平行3次,取平均值,测得玉米醇溶蛋白酶解液DPPH·自由基清除率和水解度分别为42.98%和32.18%,与预测值之间的误差为1.04%,与Design-Expert软件的预测值基本一致。

图6 底物浓度和酶活力之比之间的响应面图Fig.6 The response surface graph between the substrate concentration and neutral protease/Alcalase
2.2.4 抗氧化活性对比分析 将不同浓度的玉米醇溶蛋白抗氧化肽的DPPH·自由基清除率和羟基自由基清除率分别与对应浓度的VC的DPPH·自由基清除率和羟基自由基清除率进行比较,如图7和8图所示。
由图7、图8可知,当底物浓度为20 mg/mL时,玉米醇溶蛋白的DPPH·自由基清除率和羟基自由基清除率分别为同浓度VC的85.8%和67.0%。

图7 玉米抗氧化肽与VC的DPPH·自由基清除率Fig.7 The scavenging rate of DPPH· free radical of the Zein peptide and VC
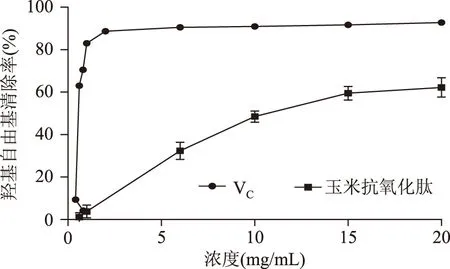
图8 玉米抗氧化肽与VC的羟基自由基清除率Fig.8 The hydroxyl radical rate of the Zein peptide and VC
3 结论
Alcalase碱性蛋白酶与中性蛋白酶分步酶解的最佳条件为:Alcalase碱性蛋白酶加酶量为12880 U/(g底物),中性蛋白酶与Alcalase碱性蛋白酶为1∶4,底物浓度为3.4%。此条件下,DPPH·自由基清除率最大值为43.43%,水解度为32.84%。实验结果说明抗氧化活性与水解度之间并不成线性相关。Alcalase碱性蛋白酶和中性蛋白酶分步水解玉米醇溶蛋白工艺是可行的。
[1]Blanca Hernandez-Ledma,Isdra Recio,Mercedes Ramos,Lourdes Amigo. Preparation of ovine and carprine β-lactoglobulin hydrolysates with ACE-injibittory activity[J]. Dairy Journal,2002,12(10):805-812.
[2]张秋子,王泽南,陈聪,等.碎米制备高果糖浆的工艺研究[J].食品科学,2010,18(24):134-136.
[3]Mills E N C. Biochemical interactions of food-derived peptides[J]. Trends in Food Science & Technology,1992,(3):64-68.
[4]王梅.F值寡肽的制备及抗疲劳与抗缺氧作用[J].粮油食品科技,1999,7(3):6-7.
[5]L Zhang,J Li,K Zhou. Chelating and radical scavenging activities of soy protein hydrolysates prepared from microbial proteases and their effect on meat lipid peroxidation[J]. Bioresource Technol,2010,101:2084-2089.
[6]Wang Xiaojie,Zheng Xiqun,Kopparapu Narasimha-kumar,et al. Purification and evaluation of a novel antioxidant peptide from corn protein hydrolysate[J]. Process Biochemistry,2014,49(9):1562-1569.
[7]Yamaguchi M,Nishikiori F,Michiko I,et al. The Effects of Corn Peptide Ingestion on Facilitating Alcohol Metabolism in Healthy Men[J].Bioscience Biotechnology and Biochemistry,1997,61(9):1774-1481.
[8]陈芳.玉米黄粉酶法制备高F值低聚肽的研究[M].西南农业大学,2003.
[9]张宇昊,王强,周素梅,等. 分步酶解制备花生短肽的研究[J]. 农业工程学报,2008,24(5):275-279.
[10]林虬,黄微,宋永康,等. 双酶分步水解法制备棉籽多肽的蛋白筛选[J]. 中国粮油学报,2012,27(2):76-80,86.
[11]金晶,徐志宏,魏振承,等. 双酶分步水解制备菜籽蛋白肽[J]. 食品与生物技术学报,2010,29(1):50-55.
[12]吴欣欣. 玉米蛋白酶解物抗氧化活性研究[M].河南工业大学,2013.
[13]王雪.乳清抗氧化肽的制备及分离纯化产业化技术研究[M].大庆:黑龙江八一农垦大学,2012.
[14]Shimada K,Fujikawa K,Yahara K,et al. Antioxidative properties of xanthan on the antioxidantion of soybean oil in cyclodextrin emulsion[J]. journal of Agricultural and Food Chemistry,1992,40(6):945-948.
[15]Smirnoff N,Cumbes Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemstry,1989,28(4):1057-1060.
[16]Seronei,Cheison S C,Wang Zhang. Preparation of whey protein hydrolystaes using a single and two-stage enzymatic membrane reactor and their immunological and antioxidant properties:characterization by multivariate data analusis[J]. J Agric Food Chem,2007,55(10):3896-3904.
[17]AdIer-Nissen J. Enzymic hydrolysis of food protein.london:Elsevier Applied Science Publishers[M],1989,9:165-166.
[18]杨惠芬,李明元,沈文. 食品卫生理化检验标准手册[M].北京:中国标准出版社,1997.
[19]刘秀红,张东杰.响应面分析法优化大豆抗氧化肽水解条件的研究[J].黑龙江八一农垦大学学报,2009,21(5):44-49.
[20]钟振声,陈钰,文锡莲.木瓜蛋白酶与中性蛋白酶水解大豆分离蛋白的研究[J].现代食品科技,2009,25(9):1039-1042.
Optimization of dual-enzymatic preparation of antioxidant peptides from zein
XU Fei1,CHENG Xiang-rong1,2,Riyadh1,SHI Yong-hui1,2,LE Guo-wei1,2,*
(1.Institute of Nutrition and Food Safety,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
In order to prepare antioxidative peptides,zein powder was subjected to stepwise hydrolysis initially with Neutral protease followed by Alcalase. DPPH· cleavage activity and degree of hydrolysis were used to evaluate antioxidative activity of hydrolysates. Furthermore,response surface methodology(RSM)was employed to optimize hydrolysis conditions,including Alcalase dosage,Neutral protease/Alcalase,and substrate concentration. The modified optimum conditions obtained were as follows:Alcalase dosage of 12880 U/g,Neutral protease/Alcalase of 1∶4,and substrate concentration of 3.4%. Under the modified condition,DPPH· radical scavenging activity of 42.98% and DH of 32.18% were obtained,and the relative error of forecast value was 1.04%. When the concentration was 20 mg/mL,the DPPH· radical scavenging activity and the hydroxyl radical rate were 85.8% and 67% of VC,respectively.
zein;alcalase;neutral protease;response surface methodology
2015-01-13
徐飞(1988-),男,硕士,研究方向:营养与功能因子,E-mail:edward20130827@163.com。
*通讯作者:乐国伟(1956-),男,博士,教授,从事分子营养与应用营养研究,E-mail:lgw@jiangnan.edu.cn。
“十二五”科技支撑计划(2012BAD33B05)。
TS201.2
B
1002-0306(2015)21-0218-06
10.13386/j.issn1002-0306.2015.21.037

