弓形虫核苷三磷酸水解酶-II真核表达质粒的构建与鉴定
陈 镭,李成朋,陈 弟,赵徐寒晖,蒋 凯,林佳鑫,刘阳阳,胡 昕,谭 峰
弓形虫核苷三磷酸水解酶-II真核表达质粒的构建与鉴定
陈 镭1,李成朋1,陈 弟1,赵徐寒晖1,蒋 凯1,林佳鑫2,刘阳阳2,胡 昕2,谭 峰3
目的 构建弓形虫核苷三磷酸水解酶-II(NTPase-II)基因真核表达质粒pcDNA3.1(+)-NTPase-II并在COS-7细胞中进行瞬时表达。方法 以pBAD-HisB-NTPase-II质粒为模板,PCR扩增NTPase-II目的基因,将其克隆到pcDNA3.1(+)真核表达载体中,双酶切及测序鉴定重组质粒。阳离子脂质体法转染COS-7细胞并经SDS-PAGE和Western Blot检测目的蛋白的表达。结果 经鉴定,弓形虫pcDNA3.1(+)-NTPase-II核酸疫苗质粒构建成功。以脂质体法转染COS-7细胞后,转染细胞可成功地表达弓形虫NTPase-II蛋白。结论 证实了弓形虫NTPase-II蛋白能在真核细胞中表达,为该基因的核酸疫苗研究提供了实验依据。
刚地弓形虫; 核苷三磷酸水解酶;真核表达
刚地弓形虫是一种广泛寄生于人和温血动物的机会致病性原虫,由于其复杂的生活史、感染方式和致病机制,它对人类的危害也日益受到重视。然而,迄今为止尚未获得理想的治疗药物[1]。近年来,弓形虫疫苗和免疫保护性研究已逐渐引起了重视,并认为疫苗接种将是预防弓形虫病的最佳策略[2]。
刚地弓形虫属于嘌呤营养缺陷型,因此必须从宿主细胞直接获取嘌呤,这是弓形虫细胞内寄生的原因。体外研究发现[3], 弓形虫产生的核苷三磷酸水解酶(nucleoside triphosphate hydrolase,NTPase)在二巯基化合物的激活作用下, 能连续水解所有的三磷酸核苷和三磷酸脱氧核苷至单磷酸形式。在宿主细胞内,弓形虫正是以此形式水解宿主细胞内三磷酸腺苷(ATP),以合成自身生存所必需的嘌呤核苷酸[4]。因此,弓形虫NTPase有望成为潜在的疫苗靶点。
本实验拟构建pcDNA3.1(+)-NTPase-II重组质粒,并采用脂质体转染COS-7细胞,观察弓形虫NTPase-II蛋白表达情况,为下一步研究重组质粒在动物体内的免疫效果奠定基础。
1 材料与方法
1.1 菌株、质粒、细胞 本实验所用菌株、质粒与细胞若无特别说明,均由温州医科大学寄生虫学教研室保存,包括:大肠埃希菌(E.coli)DH5α,原核表达质粒pBAD-HisB-NTPase-II,以及COS-7细胞。pcDNA3.1(+)载体购自上海英潍捷基公司。
1.2 主要试剂 限制性内切酶XmaI、SpeI购自大连宝生物有限公司;T4 DNA连接酶、2×PCR 聚合酶链反应试剂盒购自上海晶美生物技术有限公司;小量质粒抽提试剂盒购自宁波中鼎生物技术有限公司, DNA 凝胶回收试剂盒购自上海生工生物工程技术有限公司;高糖型DMEM培养基、胎牛血清等购自Gibco公司;Lipofecter脂质体转染试剂、细胞裂解液NP-40购自碧云天生物技术研究所;重组弓形虫NTPase-II蛋白、鼠源抗弓形虫NTPase-II单抗由温州医科大学寄生虫学教研室制备保存;HRP标记的兔抗鼠IgG购自Sigma公司。
1.3 PCR扩增TgNTPase-II编码基因 根据TgNTPase-II基因序列(GenBank: L39079.1)设计引物。上游引物:5′-TCC CCC CGG GAC AGA CTC ATC GTC ACT CCG G-3′;下游引物:5′-GGA CTA GTT CAC AGA TTG TGA GAA TAT CCC G-3′。划线处分别为XmaI与SpeI酶切位点。引物由上海英潍捷基公司合成。以原核表达质粒pBAD-HisB-NTPase-II为模板,PCR扩增NTPase-II编码基因。PCR条件为:95 ℃预变性5 min;95 ℃45 s,55 ℃45 s,72 ℃90 s,循环35次;72 ℃延伸10 min。扩增产物进行1%琼脂糖凝胶电泳鉴定。
1.4 真核表达质粒构建 将上述PCR产物与载体pcDNA3.1(+)以XmaI、SpeI分别进行双酶切、T4连接酶连接,构建真核表达质粒pcDNA3.1(+)-NTPase-II。质粒转化大肠杆菌DH5α后挑取克隆进行双酶切验证,随后将鉴定的阳性克隆送上海英潍捷基公司进行测序验证。对于测序正确的克隆提取质粒保存于-20 ℃中备用。
1.5 细胞培养及转染 以5% CO2、37 ℃常规培养COS-7细胞于DMEM细胞培养液(含10%胎牛血清、100 μg/mL青链霉素及谷氨酸)中,待细胞密度达80%时,按5×105个细胞/孔接种6孔板。继续培养24 h,弃去原培养基,PBS清洗一次后按2 mL/孔换入不含抗生素与谷氨酸的DMEM培养基。将保存的pcDNA3.1(+)-NTPase-II质粒调整浓度后按3 μg/孔加入,根据脂质体转染试剂盒操作步骤转染细胞。以pcDNA3.1空载体作为阴性对照。各组于细胞培养箱内培养5~6 h,弃去含有Lipofecter脂质体的培养液。加入正常细胞培养基2 mL/孔继续培养48 h。
1.6 Western Blot分析表达产物 培养48 h后,收集转染后细胞提取总蛋白。将pcDNA3.1-NTPase质粒转染组、pcDNA3.1空载体转染组以及阳性对照组(重组NTPase-II蛋白)进行12% SDS-PAGE电泳后,以抗弓形虫NTPase-II单抗作为一抗,HRP标记的抗小鼠IgG为二抗进行Western blot分析。
2 结 果
2.1 PCR产物扩增目的片段 对PCR扩增出的产物进行1%琼脂糖凝胶电泳,证实所扩增片段约为1 800 bp,其大小与目的片段相符(图1)。

Lane M: DNA marker; Lane 1: PCR products of NTPase-II.
2.2 pcDNA3.1(+)-NTPase-II重组质粒的构建与鉴定 以XmaI与SpeI分别双酶切PCR产物和载体后进行T4连接酶连接,筛选出阳性克隆质粒经双酶切后获得约5.6 kb和 1.8 kb两条电泳条带,其大小与载体片段和目的片段长度相符(图2)。同时,测序结果进一步证实重组质粒构建成功。
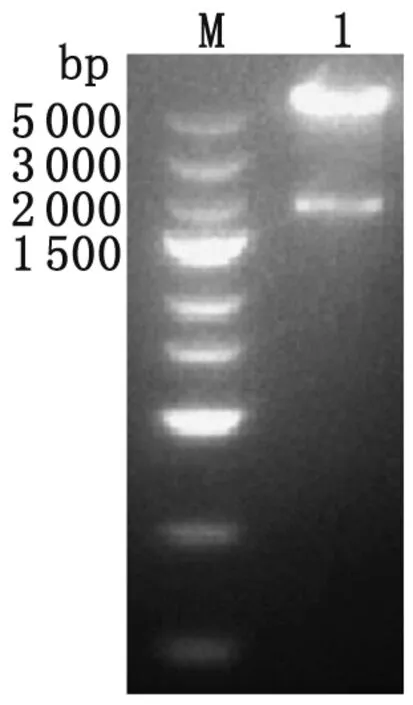
Lane M: DNA marker; Lane 1: NTPase-II digested byXmaI andSpeI.
图2 重组质粒双酶切鉴定
Fig.2 Identification of recombinant plasmids digested byXmaI andSpeI
2.3 Western blot分析重组质粒体外表达 pcDNA3.1(+)-NTPase-II重组质粒体外转染COS-7细胞,48 h后收集裂解细胞,以本实验室前期制备的特异性单克隆抗体进行Western blot检测。结果表明,与阳性对照相同,实验组在约70 kDa处有一条特异条带,而阴性对照组未显示有目的条带(图3),从而证实本实验中所构建的pcDNA3.1(+)-NTPase-II重组质粒可在真核表达体系中进行瞬时表达。
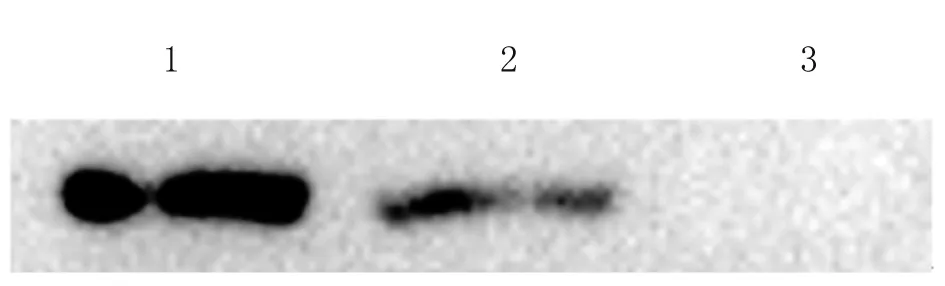
Lane 1: Positive control; Lane 2: Transfected with pcDNA3.1-NTPase-II; Lane 3: Negative control (pcDNA3.1 empty plasmid).
图3 Western blot 鉴定
Fig.3 Western blot analysis of the recombinant protein
3 讨 论
本研究针对弓形虫NTPase-II成功构建了真核重组表达质粒pcDNA3.1(+)-NTPase-II。该质粒在转染COS-7宿主细胞后,经Western blot实验证实可在细胞中成功表达。弓形虫的发育属嘌呤营养缺陷型——无法通过从头途径合成嘌呤。而通过补救合成途径从宿主细胞直接获取嘌呤这一途径常常由于纳虫泡膜的分隔作用而无法实现。弓形虫NTPase存在于速殖子期的膜表面[5],占速殖子期整个虫体蛋白的2%~8%[6]。当侵入宿主细胞后,该酶会被分泌入纳虫泡的网状管腔系统中,经二巯基化合物(如DTT)的激活进而连续水解所有的三磷酸核苷、三磷酸脱氧核苷至单磷酸,并同时合成维持自身生存所必需的嘌呤核苷酸。本实验室前期研究发现,特异性抗弓形虫NTPase-II蛋白单克隆抗体可显著抑制酶活性、降低虫株在宿主细胞内的增殖速度[7]。由此可见,NTPase是细胞内寄生的虫体获取嘌呤的一种重要酶类,在弓形虫的寄生、繁殖方面具有重要意义,并是一种潜在的、可用于开发弓形虫病防治药物或疫苗的新靶点。
弓形虫基因组编码两种NTPase蛋白:NTPase-I和NTPase-II[3,8-9]。研究表明,NTPase-I仅存在于弓形虫强毒株,而NTPase-II则存在于几乎所有的弓形虫虫株。同时,除在刚地弓形虫和犬新孢子虫体内[5,10]发现这种依赖DTT激活的NTPase外,尚未在其他物种中发现该酶,并且Asai等[10]发现,犬新孢子虫速殖子体内只表达NTPase-I。因此,以NTPase-II蛋白作为防治弓形虫病的药物或疫苗靶点具有更广泛地应用前景。
通过体内、外实验,本实验室已经证实弓形虫NTPase-II蛋白在免疫动物后可为其提供一定的免疫保护作用[11]。然而,由于核酸疫苗相比蛋白质疫苗具有生产简便安全、成本低廉、稳定性好且具有良好的诱导细胞免疫和体液免疫的优点,因此,研究核酸疫苗在一定意义上比基因工程亚单位疫苗更有发展前景。基于本实验所获得的pcDNA3.1(+)-NTPase-II真核重组表达质粒,为NTPase-II核酸疫苗的进一步应用提供了实验基础。
[1]el Kouni MH. Adenosine metabolism inToxoplasmagondii: potential targets for chemotherapy [J]. Curr Pharm Des, 2007, 13(6): 581-597. DOI: 10.2174/138161207780162836
[2]Kur J, Holec-Gasior L, Hiszczynska-Sawicka E. Current status of toxoplasmosis vaccine development[J]. Expert Rev Vaccines, 2009, 8(6): 791-808. DOI: 10.1586/erv.09.27
[3]Bermudes D, Peck KR, Afifi MA, et al. Tandemly repeated genes encode nucleoside triphosphate hydrolase isoforms secreted into the parasitophorous vacuole ofToxoplasmagondii[J]. J Biol Chem, 1994, 269(46):29252-29260.
[4]Silverman JA, Qi H, Riehl A, et al. Induced activation of theToxoplasmagondiinucleoside triphosphate hydrolase leads to depletion of host cell ATP levels and rapid exit of intracellular parasites from infected cells[J]. J Biol Chem, 1998, 273(20): 12352-12359. DOI: 10.1074/jbc.273.20.12352
[5]Kikuchi T, Furuta T, Kojima S, et al. Membrane localization and demonstration of isoforms of nucleoside triphosphate hydrolase fromToxoplasmagondii[J]. Parasitology, 2001, 122(1): 15-27. DOI: 10.1017/S0031182000007101[6]Asai T, Kanazawa T, Kobayashi S, et al. Do protozoa conceal a high potency of nucleoside triphosphate hydrolysis present inToxoplasmagondii[J]. Comp Biochem Physiol, 1986, 85(2): 365-367. DOI:10.1016/0305-0491(86)90013-1
[7]Tan F, Hu X, Pan CW, et al. Monoclonal antibodies against nucleoside triphosphate hydrolase-II can reduce the replication ofToxoplasmagondii[J]. Parasitol Int, 2010, 59(2):141-146. DOI:10.1016/j.parint.2009.12.007
[8]Berninsone P, Miret JJ, Hirschberg CB. The Golgi guanosine diphosphatase is required for transport of GDP-mannose into the lumen of Saccharomyces cerevisiae Golgi vesicles [J]. J Biol Chem, 1994, 269 (1): 207-211.
[9]Johnson MS, Broady KW, Johnson AM. Differential recognition ofToxoplasmagondiirecombinant nucleoside triphosphate hydrolase isoforms by naturally infected human sera [J]. Int J Parasitol, 1999, 29 (12): 1893-1905. DOI:10.1016/S0020-7519(99)00139-3
[10]Asai T, Howe DK, Nakajima K, et al.Neosporacaninum: tachyzoites express a potent type-I nucleoside triphosphate hydrolase, but lack nucleoside diphosphate hydrolase activity [J]. Exp Parasitol, 1998, 90(3): 277-285. DOI:10.1006/expr.1998.4346
[11]Tan F, Hu X, Luo FJ, et al. Induction of protective Th1 immune responses in mice by vaccination with recombinantToxoplasmagondiinucleoside triphosphate hydrolase-II [J]. Vaccine, 2011, 29(15):2742-2748. DOI: 10.1016/j.vaccine.2011.01.089.
Tan Feng, Email: tanfengsong@163.com
Construction and identification of eukaryotic expression plasmid ofToxoplasmagondiiNTPase-II gene
CHEN Lei1,LI Cheng-peng1,CHEN Di1,ZHAO Xuhanhui1, JIANG Kai1,LIN Jia-xin2,LIU Yang-yang2,HU Xin2,TAN Feng3
(1.TheFirstClinicalMedicalCollege,WenzhouMedicalUniversity,Wenzhou325035,China; 2.SchoolofMedicalLaboratoryScienceandSchoolofLifeScience,WenzhouMedicalUniversity,Wenzhou325035,China; 3.TheSchoolofBasicMedicalSciences,WenzhouMedicalUniversity,Wenzhou325035,China)
We constructed the eukaryotic expression plasmid pcDNA3.1(+)-NTPase-II ofToxoplasmagondiiand assess the expression of recombinant protein in COS-7 cells. The prokaryotic expression plasmid pBAD-HisB-NTPase-II constructed previously in our laboratory was used as templates to amplify the target gene by PCR. The resulting PCR products were cloned into the vector pcDNA3.1(+) for construction of eukaryotic expression plasmid pcDNA3.1(+)-NTPase-II. Then, the plasmids were transfected into COS-7 cells after identification with double enzyme digestion and sequencing. Finally, Western blot was performed to detect the expression of NTPase-II in COS-7. The result revealed thatToxoplasmaNTPase-II could be expressed in COS-7 cells when compared with empty pcDNA3.1(+) control group. Taken together, the plasmid pcDNA3.1(+)-NTPase-II constructed successfully will play an important role in development of a potential gene vaccine.
Toxoplasmagondii; nucleoside triphosphate hydrolase (NTPase); eukaryotic expression
谭峰:Email: tanfengsong@163.com
1.温州医科大学第一临床医学院,温州 325035; 2.温州医科大学生命科学学院检验医学院,温州 325035; 3.温州医科大学基础医学院,温州 325035
Supported by the Fund of Science and Technology of Zhejiang Province (No. 2014C33161) and the Student Scientific Research Project of Wenzhou Medical College (No. wyx201301011)
10.3969/cjz.j.issn.1002-2694.2015.06.005
R382.5
A
1002-2694(2015)06-0519-03
2014-10-11;
2014-11-26
浙江省科技厅公益性项目(No.2014C33161)和温州医科大学学生科研项目(No.wyx201301011)联合资助

