用于多模态图像配准的小动物床设计与实现
杨晶

摘要摘要:随着医学研究的深入与计算机技术的发展,单模态医学影像技术已经无法满足相关科研需求。当前,针对小动物领域的多模态医学影像配准技术研究日趋深入。设计了一种用于实现多模态图像配准的小动物床,该小动物床能够兼容多种医学影像设备,并配有保温装置以及呼吸门控装置,床上固定有图像配准标记装置,通过图像配准软件技术实现多模态图像配准及融合。实验结果表明,该小动物床满足基本功能要求,可以实现多模态图像配准及融合。
关键词关键词:多模态成像;小动物床;图像配准
DOIDOI:10.11907/rjdk.151155
中图分类号:TP319
文献标识码:A文章编号文章编号:16727800(2015)004008103
0引言
医学成像技术在临床和科研领域具有极为重要的作用。按照成像内容不同,临床和实验室常用的医疗成像设备可以分为解剖结构成像和功能成像两大类[1]。解剖结构成像设备,如X射线计算机断层成像(CT,computed tomography)和核磁共振成像 (MRI,magnetic resonance imaging)等,能提供精确的解剖结构信息;功能成像设备,如正电子发射型电子计算机断层显像(PET,positron emission tomography)和单光子发射计算机断层成像(SPECT,single photon emission computed tomography)等,在功能成像、代谢以及受体分布等方面具有明显优势[2]。然而,随着生命科学研究的发展,单模态医学影像已经无法满足临床及科研需求。将两种及两种以上模态图像融合起来可以优势互补,同时获得病变部位的功能代谢信息和组织结构信息[3]。但由于专用小动物一体机价格高,维护、操作复杂,因此制约了其广泛使用[4]。由于小动物体重较轻,本文设计一种可以在多系统间自由移动的小动物床,床上固定有用于确定空间刚体转换矩阵的标记物,以实现多模态医学图像融合。为避免小动物体温变化、呼吸运动等因素对图像造成影响,小动物床的设计还需增加保温装置、呼吸门控装置以及麻醉装置。
1设备与方法
1.1小动物床设计
1.1.1小动物床及标记装置
本文设计一种多系统兼容的小动物床,如图1所示。小动物床外观呈圆柱体,一端封闭,另一端为固定有插板(图中阴影部分,用于放置小动物)的可活动挡板。床体采用亚克力材料,不影响图像采集重建质量。针对小动物体积大小不同,本文设计3种型号的小动物床,圆柱底面半径分别为50mm、60mm、70mm。扫描过程中,小动物床放置在系统扫描平台上,并用自制的固定套夹予以固定。
目前,图像配准方法主要有:基于图像内部信息和基于标记物的匹配[5]。基于标记物的匹配又可分为体内标记和体外标记。由于功能成像(如PET、SPECT)图像分辨率较低,采用基于图像内部信息的配准方法无法保证配准的准确度以及精度;而基于体内标记的方法容易受到小动物呼吸的影响,体内标记会对小动物疾病模型的研究产生干扰。因此,本文采用基于体外标记的方法进行图像配准。小动物床四周固定4根导管(外径:2.0mm,内径:1.4mm)作为标记装置,其中3根导管相互平行,另外1根导管弯曲缠绕在小动物床上侧。考虑小动物成像区域的空间信息,标记装置需覆盖整个成像视野范围。4根导管内注射多模态成像设备混合示踪剂,即可在多种成像设备上分别显像,以此作为标记装置计算两种设备间的空间转换关系。
1.1.2麻醉及保温装置
为保证图像融合的准确度,小动物在扫描过程中必须保持静止,故小动物床配有气体麻醉装置。混合后的异氟烷气体与氧气通过气体麻醉接口导入小动物呼吸道,以保证小动物在扫描过程中处于麻醉状态。在麻醉期间小动物的体温调节机能受到抑制,会出现体温下降,影响实验结果。为此,小动物床还配有气体保温装置。该装置可以自由设定温度,通过温度传感器控制加热。暖空气通过保温装置接口持续通入,在小动物床腔体内循环后,经通风口排出。
1.1.3呼吸门控装置
针对解剖结构成像设备,小动物床还配备有呼吸门控装置,以减弱小动物呼吸对图像造成的影响。本文采用内在回顾性呼吸门控方式与外在回顾性呼吸门控方式相结合的方法减弱呼吸对图像造成的影响。
内在门控方式指从投影数据中获得门控信息[6,7]。将每帧投影图的中间一行像素取出组成一张正弦图,图2(a)和(b)分别为未经过内在呼吸门控校正和经过校正的小鼠CT投影图中平面正弦图。可以看出,经过校正后,呼吸运动造成的条状伪影明显减弱(白色箭头所指区域),图像变得更加光滑。
外在门控方式采用传感器探测小动物呼吸过程中腹部周期性收缩舒张信号[8],本文通过Graseby 呼吸传感器及压差传感器来获取小动物的呼吸信号。图3为Graseby 呼吸传感器,将其软泡沫填充部分用医用胶带固定在小动物的胸腹部,并将相应管道连接到压差传感器的正输入端(见图4)。当小动物呼吸时,其胸腹部会有较大的起伏运动,从而对传感器造成一定的挤压,造成管道中的气流变化,管道中气流变化引起压差传感器输入端的电压变化,最终通过压差传感器将压差信号转化为电流信号。
图5(a)和(b)分别为未经呼吸门控校正与经过校正的小鼠CT断层图像。箭头所指为小鼠的肋骨结构,圆形头所指为肺部组织与软组织的边界,菱形头所指为气管。可以看出,经过呼吸门控校正过的图像更加清晰,图像质量有较大提高。
1.2图像配准技术实现
在将小动物连同小动物床从一种成像设备转移到另一种设备的过程中,小动物处于麻醉状态无法移动,两种设备采集图像序列间只发生了旋转、平移变换,不存在形变。故本文采用基于体外标记点匹配的刚体变换模型进行图像匹配。
体外标记点在两组图像序列断层平面上显示为4个不共线的点,由于三角形稳定性高于四边形,将四边形对角线相连接即可确定4个小三角形,通过三角形全等匹配即可确定相匹配的断层,从而确定相匹配的标记点。
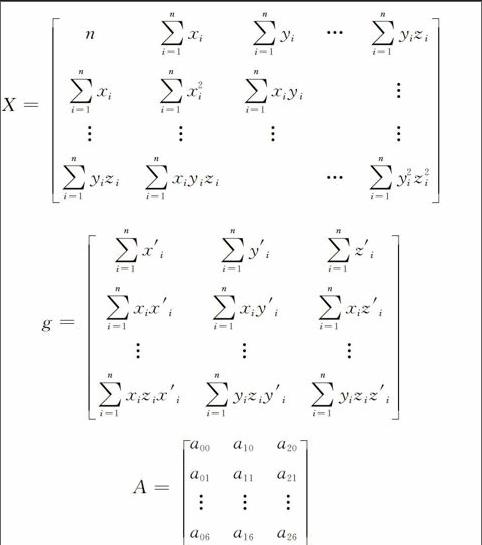
在数据网格空间建立三维空间直角坐标系,以图像断层平面为XY平面,轴方向为Z方向。记设备1上的某个标记点为P=(x,y,z)t,设备2上的某个标记点为P′=(x′,y′,z′)t。计算刚体转换矩阵也即确定P与P' 之间的关系。该关系可以用如下多项式方程来估计[9]:
通过高斯-乔丹消去法即可求出A,也即两种设备间的转换矩阵。所谓图像融合及配准,就是选择一个图像序列作为参考序列,将另一个图像序列映射到参考序列空间。为减少图像映射过程中信息的损失,通常以分辨率较高的图像作为参考图像序列,通过刚体转换矩阵将低分辨率图像映射至参考图像坐标系,实现图像配准。
2动物实验结果
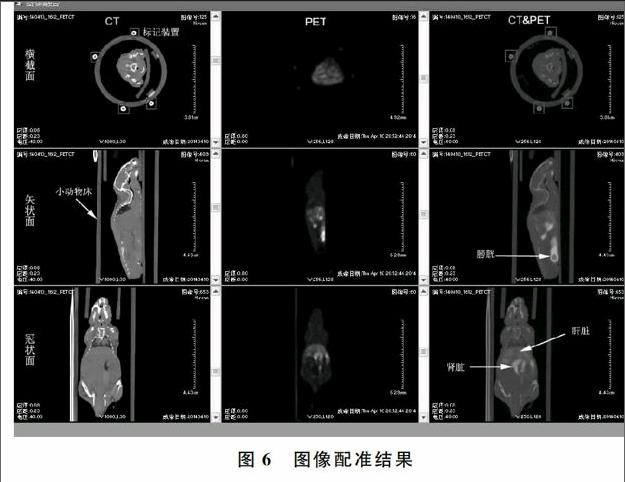
为验证多模态小动物床及配准技术的可行性,本文以小动物PET和小动物CT两种医学影像设备为例,进行图像配准实验。以一只体重20g健康小鼠作为实验对象,扫描前,向小鼠体内注射18F-FDG(18F-fluorodeoxyglucose,18F-氟代脱氧葡萄糖)和生理盐水混合溶液(15μCi/ml),而后进行5分钟的气体预麻醉。同时,向小动物床外侧四根导管内注射18F-FDG和生理盐水混合溶液(10 μCi/ml )。为不影响PET图像质量,标记物内放射性含量应低于小鼠体内注射的示踪剂含量。经过预处理的小鼠被固定在小动物床上,在PET仪器上进行10分钟扫描;然后将小鼠连同小动物床一同平移至CT设备上,固定好并进行第二次扫描(24min)。将扫描后所得的两组图像序列导入图像配准融合系统,即可自动实现小动物PET/CT图像融合。图6从左至右分别为独立设备采集到的小动物CT图像、小动物PET图像和配准后经过伪彩色处理的PET与CT融合图像;从上至下分别为图像横断面、矢状面、冠状面。可以看出,两种设备采集到的标记物能够很好匹配。通过将二者图像相结合,CT图像能够为PET图像提供更丰富的空间分辨信息,从图中可以精确地判断感兴趣器官或病灶的位置(肝脏、肾脏、膀胱等)。该系统还可以实现窗宽、窗位调节,以突出感兴趣组织结构;系统还具有保存图像序列、调节伪彩色编码显示等功能。
3结语
本文设计了一种多模态医学影像设备兼容的小动物床,小动物床配备有图像配准融合匹配标记装置、气体麻醉接口、保温装置、呼吸门控装置。小动物床材料普通易得,可重复使用;载有小动物的床体可以在多种医学影像设备间轻松移动,操作简单方便;小动物床具有通用性,可以通过替换标记装置内的混合造影剂实现两种及两种以上医学影像设备的图像配准及融合。
本文还实现了软件自动图像融合,从横断面、矢状面、冠状面3个角度显示原始图像以及融合后图像。实验结果表明:多模态小动物床可以实现独立的小动物PET和小动物CT图像融合,且具有较高的配准精度。如何利用该方法实现两种以上医学图像的配准及融合,是下一步主要研究方向。
参考文献参考文献:
[1]ZANZONICO P B, NEHMEH S A.Introduction to clinical and laboratory (smallanimal) image registration and fusion[J].Engineering in Medicine and Biology Society, 2006, EMBS'06.28th Annual International Conference of the IEEE.IEEE, 2006: 15801583.
[2]周伟, 尹端沚, 汪勇先.小动物 PET[J].核技术, 2006, 29(3):207213.
[3]TOWNSEND D W, CHERRY S R.Combining anatomy and function: the path to true image fusion[J].European Radiology, 2001, 11(10): 19681974.
[4]陈雪祺, 王荣福.PET/CT 在动物领域的研究进展[J].中国医学装备, 2013, 10(1): 5559.
[5]郭变芳.三维医学图像刚体配准[D].武汉:华中科技大学,2009.
[6]CHAVARR,AS C, VAQUERO J J, SISNIEGA A, et al.Extraction of the respiratory signal from smallanimal CT projections for a retrospective gating method[J].Physics in Medicine and Biology, 2008, 53(17): 46834695.
[7]WALTERS E B, PANDA K, BANKSON J A, et al.Improved method of in vivo respiratorygated microCT imaging[J].Physics in Medicine and Biology, 2004, 49(17): 41634172.
[8]FORD N L, NIKOLOV H N, NORLEY C J D, et al.Prospective respiratorygated microCT of free breathing rodents[J].Medical Physics, 2005, 32(9): 28882898.
[9]JAN M L, CHUANG K S, CHEN G W, et al.A threedimensional registration method for automated fusion of micro PETCTSPECT wholebody images[J].IEEE Transactions on Medical Imaging, 2005, 24(7): 886893.
责任编辑(责任编辑:陈福时)

