浅述棉花的抗逆性与抗逆育种研究进展
黄云 蓝家样 陈全求 韩光明 詹先进
摘要:通过对国内已发表棉花抗逆性研究论文的查阅,综述了棉花在逆境条件对其生长发育的影响、棉花抗逆育种的研究进展,指出了棉花在抗逆育种方面存在的一些问题,并对棉花抗逆育种的研究发展方向进行了探讨。
关键词:棉花;抗逆性;研究进展;种质资源;分子标记辅助育种
中图分类号:S562.035. 文献标志码: A 文章编号:2095-3143(2015)01-0003-06
DOI:10.3969/j.issn.2095-3143.2015.01.001
0引言
棉花作为重要的经济作物和油料作物,在国民经济和国家安全中占有重要地位。棉花的耐旱性、耐盐性均较粮食作物强,随着粮棉争地矛盾的日益突出,不适宜粮食作物种植的旱地、盐碱地、沿海滩涂成了棉花种植的另一个选择。据统计,目前中国盐碱土地面积将近99130000 hm2,其中有近80%的盐碱地没能得到有效开发利用[1-2]。传统棉花育种多关注产量、品质特性和抗病虫性,对于旱、盐、湿等非生物逆境影响的研究较少。因此,发掘具有优异抗逆性的棉花种质材料,培育具有高产潜力、功能齐全、抗多种非生物因素逆境条件的棉花新品种,充分有效利用大面积的滩涂盐碱地,是当前棉花育种的重要内容。借助于现代分子技术的发展,从分子水平上解析棉花抗逆反应的机理,揭示棉花对非生物逆境条件胁迫的基因表达调控机制,以及利用转基因技术导入外源优质抗性基因而创制棉花新材料,将大大加快棉花抗逆新品种的培育与开发进程。
1非生物逆境条件对棉花生长发育的影响
非生物逆境主要包括干旱、异常温度、土壤盐碱性和贫瘠度等不良环境条件。非生物逆境胁迫是影响棉花生长的主要因素之一,严重时会使棉花生长受到严重抑制,导致棉株死亡。在所有非生物胁迫中,干旱和土壤盐碱性是导致作物损失的主要胁迫[3]。
1.1干旱对棉花生长发育的影响
干旱可导致植物细胞失水,正常细胞结构组织遭到破坏,叶片气孔关闭,影响植物的水分蒸发和CO2的吸收,进而影响光合作用和物质运输。干旱主要影响棉株的株高和叶面积,棉花苗期、蕾期、花铃期和吐絮成熟期的不同时期干旱对其生长的影响有所不同,蕾期干旱棉株影响较小,而花铃期干旱会严重影响株高和叶面积,而且复水后很难恢复[4-5]。刘瑞显,等[6]研究了干旱胁迫下氮素水平对棉花花铃期光合作用和叶绿素荧光参数的影响,结果表明,相对于正常灌水的对照,干旱显著降低了植株的净光合作用速率,随氮素水平的提高,叶绿素荧光明显升高。程林梅,等[7]进行了干旱处理下棉花叶片水势和水分测定,表明开花期植株对水分胁迫最为敏感,干旱时棉株授粉成功率低,严重影响成铃数。
植物长期在干旱环境中生长,形成了各种有效的机制来应对它,这些机制通常分为干旱逃脱、干旱回避和抗旱能力[8]。适当干旱能帮助植株维持较高水势,以增强细胞吸水能力和减少水分散失,通过调节原生质的浓度来维持新陈代谢的最低水势[9]。干旱条件下,具有较好抗旱性能的材料根部发育和生长较快,体内抗逆性物质积累较多,如脯氨酸会显著积累。目前提高棉花抗旱性主要有两个技术途径,一个是通过改进农业技术[10-11],另一个是利用传统育种技术和基因工程导入优良抗旱基因[12]。
1.2盐碱对棉花生长发育的影响
盐碱危害是农业生产面临的主要问题之一。盐碱胁迫主要导致植物渗透失水、离子毒害等。盐离子提高根部土壤渗透势,引起细胞脱水,致使细胞失去膨压,影响细胞生理功能代谢。同时单一盐离子浓度过多会抑制根部对其他无机离子的吸收,导致单盐毒害[13]。
刘剑光[14]、叶武威[15]等通过含有NaCl的砂质苗床对苏研128和泗抗1号的发芽率进行比较,表明盐分浓度越高,棉籽的发芽势和发芽率都越低,当土壤盐分浓度在0.2%~0.3%时出苗困难,在0.4%~0.5%时不能出土,超过0.65%时基本无法发芽,且不同浓度均无促进作用。谢德意,等[16]研究棉花幼苗在不同浓度NaCl溶液中生长时,发现盐浓度在0.1%~0.4%时棉苗生长不受影响,当浓度超过0.5%时,各性状均较对照出现显著差异,当浓度达到0.7%以上时达到极显著差异。吕友军[17]研究了盐胁迫下陆地棉单株幼蕾形成量和叶绿素的变化,发现幼蕾形成量仅为正常生长条件的40%~60%,单株蕾脱落较对照有显著增加,而陆地棉在盐胁迫下第二日叶绿素明显下降,光合作用大为降低。此外盐胁迫还会提高棉株组织中的Na+含量、降低K+的含量,这样一方面使得K+/Na+比降低,造成叶片细胞中叶绿体结构破坏;另一方面提高组织中的ABA的含量,降低细胞分裂素含量,诱导衰老基因NAC基因的表达,促进棉株早衰[18]。
植物在长期的自然环境中进化出了一套适应盐胁迫的机制,主要通过渗透作用调节和无机盐离子调节。一方面通过调控细胞内物质的含量和比例,来控制细胞渗透势;另一方面调控无机离子的运输,储存在体内的特殊部位或者开出体外。研究结果表明耐盐性品种通常具有以下3个方面的抗盐机制:1)植物根部不将Na+吸收进入细胞,即使吸收也能通过膜载体蛋白泵出;2)植物根部存在Na+的储存部位,能将其存储在根部而不向地上部位运输或者运输具有选择性;3)高等植物存在盐腺,可将体内盐分通过叶片表面泌盐结构排除体外[19-21]。此外植物体内合成的甜菜碱,也是重要的渗透调节物质,甜菜碱具有稳定细胞内生物大分子的结构和功能,影响细胞内Na+的流动和分布[22-23]。
2 棉花抗逆育种研究进展
随着中国近年来农业可利用水资源的减少、土地盐碱化的扩大,以及耕作技术的提高,对棉花抗旱耐盐的能力要求越来越高。育种目标不再仅关注改善产量、品质和抗虫抗病等性状,而是对优质抗逆棉花品种资源进行发掘,分离鉴定抗/耐不同非生物因素的数量性状基因座(QTL),克隆并转导利用不同物种的优质抗性基因,开展棉花在多种不同非生物因素逆境下作用机制的研究。目前中国已培育和创制了大量抗逆棉花新材料,为棉花的抗性育种开展提供了基础[24]。
中国早在“七五”期间就对棉花种质资源进行了统一的抗旱耐盐性鉴定筛选,“八五”期间进一步完善了其方法与标准,并进一步对棉花抗逆种质资源进行了筛选[25]。最初从国外引入的新棉花材料中经系统选育,获得了中棉所7号等较抗旱材料,具有一定的生产推广面积。“八五”后育种方法逐步进入利用已有品种和中高代材料,获得了一批抗旱、抗盐碱较好,且具有优良性状的新品种,如晋棉11号、中棉所25等抗旱性新品种和中棉23等抗盐性较好的新品种。
植物的抗逆性状通常不是由单一基因控制,而是由一系列相关基因直接或间接控制的性状,形成的一个复杂调控网。棉花的抗逆性响应机制大致分为四个阶段:一是感知阶段,接受逆境胁迫信号;二是传递阶段,将逆境信号传导到下游引发分子反应;三是反应阶段,接受信号后启动抗性调控机制;四是表达阶段,相关逆境抗性基因表达。目前对棉花抗逆性基因的研究主要集中在参与渗透调节的基因、功能蛋白类和转录调控因子等方面的研究[26]。目前已研究并克隆的棉花非生物逆境抗性基因主要有两类:一类属在抗逆反应中起保护作用的功能性抗性基因,多为受到逆境胁迫后表达增强植物在逆境环境中的适应能力的基因,如GhNHX1[27]、GhHb1[28]、BADH[29]、P5CR[30]、LEA[31]等;另一类通常为调控相关逆境基因的转录调控因子和信号感应转导胁迫的蛋白酶类,如GhNAC1[32]、Trihelix[33-34]、GhDBP1[35]、GhDBP2[36]、MYC/MYB[37]等。
Dannuta,等[38]报道K+在水分亏时可以促进脯氨酸的合成,同时还可调节甜菜碱(BADH)的活性。棉花在干旱条件下细胞液泡膜上Na+/H+逆转运蛋白NHX1过量表达,让Na+转运入液泡中降低胞质中的Na+浓度,并且还能将K+隔化到液泡中提高K+的浓度,共同降低细胞受到的渗透胁迫[39-40]。晚期胚胎发生蛋白(Late Embryogenesis Abundant Protein,LEA)也具有干旱胁迫调节作用,当植物受到干旱胁迫时LEA大量表达,由于多数LEA蛋白都具有高亲水性,能在干旱时将水分很好的保存在细胞中,并且LEA蛋白还可以作为一种渗透调节蛋白,维持细胞渗透势[31.41-42]。
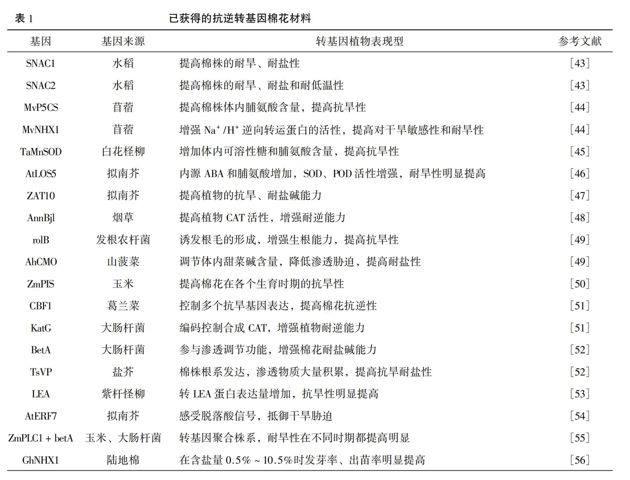
基于已获得外源或内源的高效抗逆相关基因,利用转基因技术可获得具有抗旱、耐盐碱的棉花新材料(表1)。刘冠泽[43]将水稻的NAC转录因子SNAC1、SNAC2经根癌农杆菌介导转入陆地棉品系YZ-1中,分别获得两个棉花抗逆转基因S1、S2家系,S1家系在高盐胁迫(250 mmol/L NaCl)处理下,生长状况明显好于野生型,而S2家系在低温处理后的恢复能力明显强于野生型。杨云尧[44]通过花粉管通道将新牧一号苜蓿中的Na+/H+逆转运蛋白基因MvNHX1和参与脯氨酸合成的相关基因MvP5CS转导入棉花中得到T4代株系,表明两种材料的抗旱性都较对照明显提高,但Na+/H+逆转运蛋白能更快的响应干旱胁迫,而转MvP5CS的株系只有在发生渗透胁迫后才发挥保护作用。在转基因棉花中过量表达的TaMnSOD基因,能够显著提高脯氨酸和可溶性糖的含量,生物量比对照高出33%,而且转基因棉株的根长、侧根数和根冠比更显著高于对照组[45]。LOS5是ABA合成关键基因之一,将其转导入棉花后发现,相比对照中棉35,转基因棉株的ABA含量提高了25%,脯氨酸含量提高了20%,与抗旱相关的其他基因(如P5CS、RD22)的表达量也显著提高,干旱条件下转基因棉株的鲜重比非转基因材料高出近13%[46]。
虽然目前已有上百个与抗旱、耐盐碱的基因被鉴定、克隆和被用于基因工程,但相对于抗虫基因棉花的广泛种植,棉花抗逆基因工程仍处于试验性阶段,距离实际生产应用尚有相当距离。
3 问题与展望
3.1 存在的问题
棉花传统育种技术着重于高产、优质、抗虫抗病等,随着自然环境的恶化、耕地资源的减少、水资源的匮乏等因素的影响越来越大,近年来棉花抗逆性育种越来越受到重视[57]。但相对于抗虫抗病育种的研究,抗逆性育种仍然有以下不足。
一是对植物抗逆性机制的研究较浅,缺乏系统性。多数研究仅围绕单一性因子对非生物因素的抗性,没有系统研究基因间的相互作用机制和基因在生物体内的代谢调控机制。而培育抗多种非生物因素的广谱抗逆性棉花品种是目前传统育种技术的一大难题[58]。
二是对已有棉花抗逆性品种缺乏系统性鉴定筛选,对棉花抗逆性状标准的系统性研究较少,导致长期以来部分具有优异抗逆基因的种质材料在传统育种过程中丢失。
三是缺乏与抗逆性基因相关的有效分子标记,限制了对棉花抗逆基因的研究和克隆应用。基因组学在植物抗逆性研究中还处于起步阶段,植物的抗逆性往往由一系列相关基因直接或间接作用。利用基因组学、分子生物学以及生物信息学等开发大量高效的分子标记,构建高密度棉花遗传图谱,通过精细定位并克隆优质抗逆性主效QTL,能加快分子标记辅助育种在棉花抗逆育种中的应用[59]。
四是外源抗逆性基因能否在受体棉花材料中稳定表达,以及能否在后代中稳定遗传的研究较少。目前虽然已获得了一批转导入外源优质抗逆性基因的棉花材料,但外源基因在后代中出现基因丢失、沉默等现象,使得抗逆性转基因棉花在实际育种工作中困难重重[60]。
3.2 抗逆育种展望
农业生产中非生物逆境胁迫是影响作物生长发育和产量的最主要因素之一,随着中国棉花种植区域向干旱地、盐碱地、沿海滩涂地的转移,面临的非生物因素影响将会越来越严峻。因此加快棉花抗逆种植资源的筛选鉴定、开发可高效利用的分子标记、利用现代生物技术等基因工程,培育高产、优质、多抗和广适性的棉花新材料,对于棉花育种和农业发展具有重要意义。
参考文献
[1] 王遵亲.中国盐泽土[M].北京; 科学出版社,1993.
[2] 张士功, 邱建军, 张华. 我国盐渍土资源及其综合治理[J].中国农业资源与区划,2000,01:54-58.
[3] Allen V G, Baker M T, Segarra E, et al. Integrated irrigated crop–livestock systems in dry climates[J]. Agronomy Journal, 2007, 99(2): 346-360.
[4] 肖俊夫, 刘祖贵. 不同生育期干旱对棉花生长发育及产量的影响[J]. 灌溉排水, 1999,(1):23-27.
[5] .李少昆, 肖璐, 黄文华, 等. 不同时期干旱胁迫对棉花生长和产量的影响 Ⅱ棉花生长发育及生理特性的变化[J]. 石河子大学学报(自然科学版),1999,04:259-264.
[6] 刘瑞显, 王友华, 陈兵林,等. 花铃期干旱胁迫下氮素水平对棉花光合作用与叶绿素荧光特性的影响[J]. 作物学报, 2008 (4):675-683.
[7] 程林梅, 张原根, 阎继耀. 土壤干旱对棉花生理特性与产量的影响[J]. 棉花学报, 1995 (4):233-237.
[8] Turner N C, Wright G C, Siddique K H M. Adaptation of grain legumes (pulses) to water-limited environments[J]. Advances in Agronomy, 2001,(71): 194-233.
[9] Chen Yun,Liu Zhi-Hao,Feng Li,Zheng, et al. Genome-wide functional analysis of cotton (Gossypium hirsutum) in response to drought.[J]. PloS one,2013,811:.
[10] Truman C C, Strickland T C, Potter T L, et al. Variable rainfall intensity and tillage effects on runoff, sediment, and carbon losses from a loamy sand under simulated rainfall[J]. Journal of environmental quality, 2007, 36(5): 1495-1502.
[11] Bauer PJ, Fortnum BA, Frederick JR . Cotton responses to tillage and rotation during the turn of the century drought[J]. Agron J 102: 1145-1148. DOI:10.2134/agronj2010.0037.
[12] Chaves MM, Oliveira MM (2004). Mechanisms underlying plant resilience to water deficits: prospects for water-saving agriculture[J]. Exp Bot 55: 2365-2384. DOI:10.1093/jxb/erh269. PubMed: 15475377.
[13] 陈亚华, 沈振国, 刘友良, 等. NaCl胁迫下棉花幼苗的离子平衡[J]. 棉花学报, 2001,04:225-229
[14] 刘剑光, 肖松华, 关巧娟, 等. 盐胁迫对棉种萌发及幼苗生长的影响[J]. 江苏农业科学, 2010, (5):124-125.
[15] 叶武威, 刘金定, 樊宝相, 等. 盐分(NaCl)对陆地棉纤维性状的影响[J]. 中国棉花, 1997, 1997,03:17-18+20.
[16] 谢德意, 王惠萍. 盐胁迫对棉花种子萌发及幼苗生长的影响[J]. 种子, 2000,(3):10-11.
[17] 吕有军. 盐胁迫下棉花生长发育特性与耐盐机理研究[D]. 杭州:浙江大学, 2005.
[18] 王涛, 孔祥强, 董合忠. 盐胁迫诱导棉花叶片早衰的机理研究[C]. 长沙:中国棉花学会2013年年会论文集. 2013.
[19] Thmosno WW, Farady. Solute transport in Plant cells and tissues Longman Seinetific and Technical 1[D]. Essex,1998:498-537.
[20] 陆静梅, 刘友良, 胡波, 等. 中国野生大豆盐腺的发现[J]. 科学通报, 1998, 19:2074-2078.
[21] 余叔文,汤章城. 植物生理与分子生物学(第二版)[M].北京:科学出版社,1998:752-769.
[22] 侯彩霞,汤章城. 细胞相容性物质的生理功能及其作用机制[J]. 植物生理学通讯, 1999(1):1-7.
[23] Papageorgiou G C, Murata N. The unusually strong stabilizing effects of glycine betaine on the structure and function of the oxygen-evolving photosystem II complex[J]. Photosynthesis Research, 1995, 44(3): 243-252.
[24] 孟超敏, 蔡彩平, 郭旺珍. 棉花抗逆育种研究进展[J]. 南京农业大学学报,2012(5):25-34.
[25] 刘金定, 叶武威, 樊宝相. 我国棉花抗逆研究及其利用[J]. 中国棉花,1998(3): 5-6.
[26] 雷志,周美亮, 吴燕民. 非生物逆境相关基因在棉花抗逆研究中的进展[J]. 中国农业科技导报,2014(2):35-43.
[27] Wu C A, Yang G D, Meng Q W, et al. The cotton GhNHX1 gene encoding a novel putative tonoplast Na+/H+ antiporter plays an important role in salt stress[J]. Plant and cell physiology, 2004, 45(5): 600-607.
[28] Li D D, Tai F J, Zhang Z T, et al. A cotton gene encodes a tonoplast aquaporin that is involved in cell tolerance to cold stress[J]. Gene, 2009, 438(1): 26-32.
[29] 罗晓丽, 肖娟丽, 王志安,等. 菠菜甜菜碱醛脱氢酶基因在棉花中的过量表达和抗冻耐逆性分析[J]. 生物工程学报, 2008,(8):1464-1469.
[30] 陈亚娟. 亚洲棉GaP5CS与GaTPS基因的克隆与功能鉴定[D]. 北京: 中国农业科学院, 2009.
[31] Baker J, dennSteele C V, III L D. Sequence and characterization of 6 Lea proteins and their genes from cotton[J]. Plant Molecular Biology, 1988, 11(3):277-291.
[32] Meng C M, Cai C P, Zhang T Z, et al. Characterization of six novel NAC genes and their responses to abiotic stresses in Gossypium hirsutum L[J].Plant Sci, 2009(176): 352-359.
[33] Osorio M B, Bücker-Neto L, Castilhos G, et al. Identification and in silico characterization of soybean trihelix-GT and bHLH transcription factors involved in stress responses[J]. Genet Mol Biol., 2012,(Suppl):233-246.
[34] 李月, 孙杰, 谢宗铭, 等. 陆地棉trihelix转录因子基因响应非生物胁迫表达谱分析[J]. 中国农业科学, 2013,09:1946-1955.
[35] Dong C J, Huang B, Liu J Y. The cotton dehydration-responsive element binding protein GhDBP1 contains an EAR-motif and is involved in the defense response of Arabidopsis to salinity stress[J]. Functional Plant Biology, 2010, 37(1): 64-73.
[36] Huang B, Jin L, Liu J Y. Identification and characterization of the novel gene GhDBP2 encoding a DRE-binding protein from cotton (Gossypium hirsutum )[J]. Journal of plant physiology, 2008, 165(2): 214-223.
[37] Paz-Ares J,Ghosal D,Wienand U,Peterson P A,Saedler H. The regulatory c1 locus of Zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators.[J]. The EMBO Journal,1987,612.
[38] Cho?uj D, Karwowska R, Ciszewska A, et al. Influence of long-term drought stress on osmolyte accumulation in sugar beet (Beta vulgaris L.) plants[J]. Acta Physiologiae Plantarum, 2008, 30(5): 679-687.
[39] Zhang H X, Blumwald E. Transgenic salt-tolerant tomato plants accumulate salt in foliage but not in fruit[J]. Nature biotechnology, 2001, 19(8): 765-768.
[40] Wu C, Yang G, Meng Q, et al. The Cotton GhNHX1 Gene Encoding a Novel Putative Tonoplast Na+/H+ Antiporter Plays an Important Role in Salt Stress[J]. Plant and Cell Physiology, 2004 (5):600-607.
[41] Li N, Zhao Y.J, Zhao Q, et al. Research on barley hva1 gene and leaprotein with plant drought tolerance, Shengwu Jishu Tongbao (Biotechnology Bulletin), (4): 25-34
[42] Zhezhi L C W. Cloning and Expression Analysis of SmLEA from Salvia miltiorrhiza Bunge [J]. Biotechnology Bulletin, 2009,(5): 22.
[43] Guanze Liu, Xuelin Li, Shuangxia Jin, et al. Overexpression of Rice NAC Gene SNAC1 Improves Drought and Salt Tolerance by Enhancing Root Development and Reducing Transpiration Rate in Transgenic Cotton.[J]. PLoS One, 2014,(1): e86895.
[44] 杨云尧. 转MvP5CS和MvNHX1基因提高棉花抗旱性的研究[D]. 新疆: 新疆农业大学, 2012.
[45] Zhang D Y, Yang H L, Li X S, et al. Overexpression of Tamarix albiflonum TaMnSOD increases drought tolerance in transgenic cotton[J]. Molecular Breeding, 2014, 34(1): 1-11.
[46] Yue Y, Zhang M, Zhang J, et al. Overexpression of the AtLOS5 gene increased abscisic acid level and drought tolerance in transgenic cotton[J]. Journal of experimental botany, 2012, 63(10): 3741-3748.
[47] Sakamoto H, Maruyama K, Sakuma Y, et al. Arabidopsis Cys2/His2-type zinc-finger proteins function as transcription repressors under drought, cold, and high-salinity stress conditions[J]. Plant Physiology, 2004, 136(1): 2734-2746.
[48] Divya K, Jami S K, Kirti P B. Constitutive expression of mustard annexin, AnnBj1 enhances abiotic stress tolerance and fiber quality in cotton under stress[J]. Plant molecular biology, 2010, 73(3): 293-308.
[49] Zhang H, Dong H, Li W, et al. Increased glycine betaine synthesis and salinity tolerance in AhCMO transgenic cotton lines[J]. Molecular breeding, 2009, 23(2): 289-298.
[50] Yan J, He C, Wang J, et al. Overexpression of the Arabidopsis 14-3-3 protein GF14λ in cotton leads to a “stay-green” phenotype and improves stress tolerance under moderate drought conditions[J]. Plant and cell physiology, 2004, 45(8): 1007-1014.
[51] 蔡永智. 转CBF1和KatG基因棉花抗旱性分析[D].新疆: 石河子大学, 2013.
[52] 吕素莲. 转betA和TsVP基因提高棉花耐盐、抗旱性的研究[D].济南: 山东大学,2007.
[53] 裴金玲, 杨红兰, 李春平, 等. 转晚期胚胎发生丰富蛋白(LEA)基因棉花及抗旱性分析[J]. 分子植物育种, 2012 (3):331-337.
[54] Song C P, Agarwal M, Ohta M, et al. Role of an Arabidopsis AP2/EREBP-type transcriptional repressor in abscisic acid and drought stress responses[J]. The Plant Cell Online, 2005, 17(8): 2384-2396.
[55] 吴伟. 转ZmPLC1-betA基因棉花的耐旱性研究[D]. 山东: 山东大学, 2012.
[56] 吴霞, 吴长艾, 上官小霞, 等. 转耐盐基因GhNHX1棉花株系耐盐性初步鉴定[J]. 山西农业科学,2012,01:16-17+40.
[57] Ashraf M. Salt tolerance of cotton: some new advances[J]. Critical Reviews in Plant Sciences, 2002, 21(1): 1-30.
[58] Wally O, Jayaraj J, Punja Z K. Broad-spectrum disease resistance to necrotrophic and biotrophic pathogens in transgenic carrots (Daucus carota L.) expressing an Arabidopsis NPR1 gene[J]. Planta, 2009, 231 (1): 131-141.
[59] Bohnert H J, Ayoubi P, Borchert C, et al. A genomics approach towards salt stress tolerance[J]. Plant Physiology and Biochemistry, 2001, 39(3): 295-311.
[60] Melchers L S, Stuiver M H. Novel genes for disease-resistance breeding[J]. Current opinion in plant biology, 2000, 3(2): 147-152.
收稿日期:2014-11-03
基金项目:转基因生物新品种培育科技重大专项(2011ZX08005-001-006);现代农业技术领域863计划(2011AA10102)。
作者简介:黄云(1981-),女,湖北鄂州人,从事棉花育种研究工作。E-mail:huangyun0520@126.com.
通讯作者:詹先进,E-mail: zhanxianj@126.com

