7株拮抗菌的鉴定及其对香蕉炭疽病的防治作用
付岗 叶云峰 吴永官 杜婵娟 晏卫红 潘连富
摘 要 为了收集利用香蕉炭疽病的生防菌资源和评价拮抗菌的防病能力,通过培养性状与形态特征观察、生理生化反应和16S rRNA序列特征分析等方法对筛选到的7株拮抗菌进行鉴定,并对其防病作用进行了初步测试。结果表明:菌株Bb7802、Bb7304、Bb7202、Bb7108、Bb7004和Bb5911为短短芽孢杆菌,菌株Bc6301为蜡状芽孢杆菌。人工接种结果表明,菌株Bc6301对香蕉炭疽病的防效最高,为45.94%,其余6株拮抗菌的防效在22.35%~43.29%。
关键词 芭蕉炭疽菌;短短芽孢杆菌;蜡状芽孢杆菌
中图分类号 S436.67 文献标识码 A
香蕉炭疽病由芭蕉炭疽菌[Colletotrichum musae(Berk. & Curt.)Arx]引起,是香蕉储运过程中发生最为严重的病害之一[1]。由于重视程度不同和防治手段差异,由香蕉炭疽病导致的损失在20%~40%,严重时可达80%以上[2-3]。目前香蕉炭疽病的防治主要还是依靠化学药剂,异菌脲、咪鲜胺、噻菌灵等生产上最常用的化学杀菌剂,由此带来的农药残留问题已经成为中国香蕉产业发展的重要限制因素之一[4-5]。另外,由于长期大量使用化学农药促使病原菌产生抗药性。因此,人们越来越重视寻求针对香蕉炭疽病的非化学防治途径。
由于香蕉在采后储运期间所处的环境条件相对较为稳定,这给拮抗微生物的利用提供了有利条件。许多不同种类的拮抗菌被筛选用于防治香蕉炭疽病,其中以芽孢杆菌类(Bacillus sp.)细菌较为常见[6]。枯草芽孢杆菌(B. subtillis)是最常见的香蕉炭疽病拮抗菌[7-9]。此外,也有利用解淀粉芽孢杆菌(B. amyloliquefaciens)等防治该病的报道[10]。虽然研究者们已筛选到相当数量的拮抗微生物,但目前这些菌株尚未能应用于生产。作者在前期研究中从广西南宁不同作物根围获得的997株分离物中筛选到7株对香蕉炭疽病菌有较强抑菌作用的拮抗菌株,本文通过形态特征观察、生理生化测试结合16S rRNA序列特征分析对这7株拮抗菌进行鉴定,并评价其对香蕉炭疽病的防治作用,旨在为香蕉炭疽病的生物防治提供新的菌种资源和应用基础。
1 材料与方法
1.1 材料
供试菌株:香蕉炭疽病菌(Colletotrichum musae)Cm1和7株拮抗菌Bb7802、Bb7304、Bb7202、Bb7108、Bb7004、Bb5911和Bc6301菌株均由广西农业科学院微生物研究所生物防治研究室提供。
供试香蕉:品种威廉斯(Musa AAA Cavendish var.Williams),采自广西隆安县丁当镇香蕉园,采收前2个月内未喷施杀菌剂。
培养基:PDA培养基[5]和NA培养基[7],分别用于培养香蕉炭疽病菌和拮抗菌。
分子生物学试剂:细菌基因组DNA提取试剂盒购自杭州博日科技有限公司;Taq酶和dNTP购自北京百川开泰生物科技有限公司生产;引物F27和R1492由上海生工生物公司合成。
1.2 方法
1.2.1 菌株的形态和生理生化特征 参照《常见细菌系统鉴定手册》、《一般细菌常用鉴定方法》和《伯杰细菌鉴定手册》观察各菌株的培养形态、性状、鞭毛和芽孢、革兰氏染色,测定菌株的生理生化特征,观察不同pH值、温度条件下菌株的生长状况及耐盐性[11-13]。
1.2.2 拮抗菌的16S rRNA序列分析 参照说明书用细菌基因组DNA提取试剂盒提取各拮抗菌株的DNA。采用细菌16S rRNA通用扩增引物Primer F27(5′-AGAGTTTGATCATGGCTCAG-3′)和Primer R1492(5′-TACGGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR反应体系和PCR反应程序参照Fu等[7]的研究方法。
扩增产物电泳检测后送上海生工生物公司,用引物Primer F27和R1492进行测序。测得的序列与GenBank数据库中已有序列进行BLAST同源性比对,并利用Mega 6.06软件采用邻接法(N-J)构建系统发育树。
1.2.3 拮抗菌对香蕉炭疽病的防治效果 7株拮抗菌分别接种于NA液体培养基中,28 ℃下 150 r/min摇床培养3 d,得到OD625=0.8的菌体发酵液。制备香蕉炭疽病菌孢子液浓度为104个/mL,备用。
田间采收八成熟的蕉果,去除伤病蕉果,将自然梳分成单个蕉指,抹去花器,洗净晾干。蕉果在拮抗菌发酵液的10倍稀释液中浸泡10 min后取出,室温下晾干,以清水为对照。24 h后用Cm1孢子悬浮液对蕉果进行喷雾接种。再次晾干后,用厚度0.04 mm的聚乙烯袋密封包装,然后放入纸箱,于27 ℃下,RH 78%放置贮藏。每个拮抗菌株3个重复,每重复8个蕉果。
共进行2次病情调查,实验香蕉始发病时进行第1次调查,香蕉完全成熟后进行第2次调查;参照Fu等的标准进行病情分级[7]。拮抗菌对香蕉炭疽病的防治效果的计算公式为:病情指数=[100×∑(各级病果数×相对级数值)]/(调查总果数×9);防治效果/%=100×(对照区病情指数-处理区病情指数)/对照区病情指数。
1.2.4 拮抗菌株Bc6301对香蕉炭疽病菌的抑制作用
按1.2.3方法制备Bc6301的菌体发酵液和香蕉炭疽病菌Cm1菌株的孢子液。将拮抗菌发酵液通过0.22 μm细菌过滤器获得无菌滤液,与Cm1菌株孢子液等量混合后,置凹玻片28 ℃共培养。以等量无菌水与Cm1孢子液混合为对照,24 h后镜检病菌孢子生长萌发情况。每次随机选取3个视野,计数视野内可见的所有孢子,芽管长度大于孢子长度1/2的计为孢子萌发。每处理均设3次重复。
1.3 数据分析
所有实验数据均采用SAS9.0软件进行分析,采用Duncan's新复极差法比较各处理间的差异显著性。
2 结果与分析
2.1 菌株的形态特征
拮抗菌在NA平板上培养16 h后,陆续出现单菌落。菌株Bb7802、Bb7304、Bb7202、Bb7108、Bb7004和Bb5911的形态特征较为一致,单菌落为圆形、有光泽、不透明,中间隆起,边缘整齐(图1-A)。电子显微镜下可见菌体呈短杆状,产芽孢,具周生鞭毛(图1-B)。
菌株Bc6301的单菌落乳白色、粘稠厚重、半透明、湿润光亮,表面似毛玻璃或蜡状(图1-C)。菌体呈杆状,鞭毛周生较稀疏(图1-D)。
2.2 菌株的生理生化特征
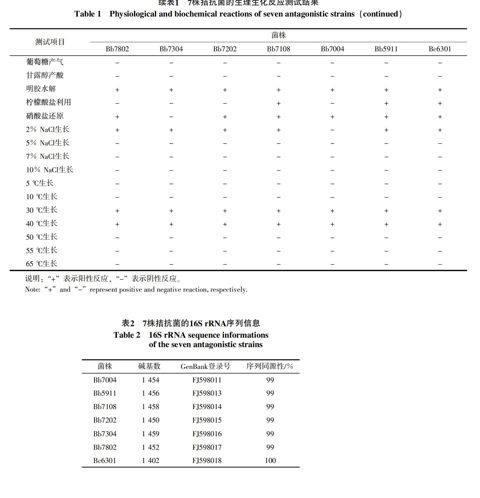
7株拮抗菌的生理生化反应测试结果见表1。Bb7802、Bb7304、Bb7202、Bb7108、Bb7004和Bb5911等6菌株的测试反应结果类似,其中12项生理生化测试及其生长温度和pH值测试结果完全一致,并与细菌分类学专著[11-13]中对短短芽孢杆菌(Brevibacillus brevis)的描述相符。B. brevis的硝酸盐还原、柠檬酸盐利用和2% NaCl生长这3项测试反应在《常见细菌系统鉴定手册》中的描述为结果可变。表1的结果显示,以上6株拮抗菌之间在这3项反应上确有细微差异。
与前述6株拮抗菌相比,菌株Bc6301的生理生化反应结果差异较大。如,在V-P反应、硫化氢产生、淀粉水解、卵磷脂酶、厌氧生长等方面都呈现不同反应。根据各菌株的生理生化反应结合其形态特征,参照细菌分类学专著[11-13],可初步确定菌株Bc6301为蜡状芽孢杆菌(Bacillus cereus)。
2.3 菌株的16S rRNA序列特征
经基因组DNA提取,对7株拮抗菌的16S rRNA区段进行PCR扩增,均得到大小约1.5 kb的扩增产物。7份PCR产物经测序分别得到1 402~1 459 bp的碱基序列,所有序列均上传至GenBank数据库,并获得了各自的登录号,结果如表2所示。各序列与GenBank中已有序列的Blast比对结果显示,菌株Bc6301与蜡状芽孢杆菌(Bacillus cereus)的16S rRNA序列的同源性最高,达100%;其余6菌株的相应序列均与短短芽孢杆菌(Brevibacillus brevis)的同源性最高,为99%。
以Agrobacterium rhizogenes(FJ527681)为外群,构建了菌株Bb7802、Bb7304、Bb7202、Bb7108、Bb7004、Bb5911与相关24个细菌菌株的系统发育树,这6株拮抗菌与其它4株短短芽孢杆菌(EU771078、GQ375794、EF488102、AY591911)共同聚集在同一个小的分支内,包括这个分支在内的所有短芽孢杆菌属的菌株均处于同一个大的分支中。而芽孢杆菌属(Bacillus sp.)的菌株(EU257435)处于距离较远的分支。说明这6株拮抗菌与短芽孢杆菌属的短短芽孢杆菌的亲缘关系最近(图2)。
以Xanthomonas cynarae(AF208315)为外群,构建的菌株Bc6301与GenBank数据库中21个相关菌株的系统发育树如图3。从图中可以看出,菌株Bc6301与所有芽孢杆菌属的细菌处于同一个大的分支,并与3株蜡状芽孢杆菌(HM026606、FJ908707、GU812900)处于同一个较小分支内,显示菌株Bc6301与蜡状芽孢杆菌的亲缘关系最近。
2.4 拮抗菌对香蕉炭疽病的防治效果
7株拮抗菌对香蕉炭疽病的防治效果见表3。香蕉贮藏16 d开始发病,各处理病情指数在15.42~26.78;从防效看,蜡状芽孢杆菌Bc6301的防效最高,为71.24%,6株短短芽孢杆菌的防效在50.06%~65.74%。贮藏至19 d香蕉完全成熟,各处理区的病情指数均有增长,防效均有所降低,但Bc6301菌株的防效(68.24%)仍明显高与其它菌株。6株短短芽孢杆菌防效最高者为菌株Bb7802和Bb7304,分别为63.72%和61.59%。
2.5 拮抗菌Bc6301对香蕉炭疽病菌孢子萌发的抑制作用
镜检可见菌株Bc6301对香蕉炭疽病菌的孢子萌发有明显的抑制作用。清水对照的病菌孢子萌发率可达84.4%,而经拮抗菌发酵液处理的病菌孢子萌发率仅为36.8%,并且孢子芽管较短。但未观察到孢子畸形或原生质泄露现象(图4)。
3 讨论与结论
通过对各菌株的形态观察和生理生化指标的测定,参照分类学专著并结合菌株16S rRNA序列特征的分析,将6株拮抗菌Bb7802、Bb7304、Bb7202、Bb7108、Bb7004和Bb5911鉴定为短短芽孢杆菌(Brevibacillus brevis),将菌株Bc6301鉴定为蜡状芽孢杆菌(Bacillus cereus)。
短短芽孢杆菌作为其它植物病害生防菌的研究国内外已有相关报道,其防治对象有烟草青枯病[14]、柑橘炭疽病[15]、莴苣菌核病[16]、草莓灰霉病[17]、番茄枯萎病[18]、黄瓜枯萎病[19]、瓜类枯萎病[20]、蔬菜猝倒病[21]和棉花枯黄萎病[22]等,但至今尚未见利用短短芽孢杆菌防治香蕉炭疽病的报道。
蜡状芽孢杆菌作为植物病害生防菌已报道的防治对象有棉花黄萎病[23]、黄瓜枯萎病[24]、草莓白粉病[25]、小麦全蚀病[26]、植物青枯病[27]等。但未见蜡状芽孢杆菌用于防治香蕉炭疽病。本研究进一步扩展了短短芽孢杆菌和蜡状芽孢杆菌作为生防菌的抗病谱,也进一步扩充了香蕉炭疽病生防菌的资源库,为下一步香蕉炭疽病的生物防治提供了菌种材料。
对香蕉炭疽病的防效测试结果表明,香蕉贮藏16 d,7株拮抗菌的最高防效为71.24%,至蕉果完全成熟时,仍有3株拮抗菌的防效在61.59%以上。本研究中拮抗菌的培养是按照普通细菌的培养方式进行,而实际上,若针对某一特定的拮抗菌株采用与之相适应的最佳培养条件,并辅以合适的助剂,其防病效果还将有所提升。也就是说这些拮抗菌仍存在较大的生防潜能有待开发,这也是今后需要进一步研究的内容。
参考文献
[1] Natáliaa R P, Eiko E K, Mário S C D, et al. Identification and characterization of Colletotrichum spp. affecting fruit after harvest in Brazil[J]. Journal of Phytopathology, 2002, 150(3):128-134.
[2] Alvindia D G, Kobayashi T, Yaguchi Y, et al. Symptoms and the associated fungi of postharvest diseases on nonchemical bananas imported from the Philippines[J]. Japanese Journal of Tropical Agriculture, 2000(4): 87-93.
[3] Chillet M, Hubert O, Rives M J, et al. Effects of the physiological age of bananas on their susceptibility to wound anthracnose due to Colletotrichum musae[J]. Plant Disease, 2006, 90(9): 1 181-1 185.
[4] Krauss U, Johanson A. Recent advances in the control of crown rot of banana in the Windward Islands[J]. Crop Protection, 2000, 19(3): 151-160.
[5] 付 岗, 黄思良, 谢 玲, 等. 45%咪鲜胺水乳剂对香蕉采后炭疽病的控制效果[J]. 安徽农业科学, 2009, 37(23): 11 056-11 057.
[6] 刘晓妹, 蒲金基, 唐秋榕. B05菌株抗菌谱及对几种香蕉病害防效的测定[J]. 中国南方果树, 2006, 35(6): 41-46.
[7] Fu G, Huang S L, Ye Y F, et al. Characterization of a bacterial biocontrol strain B106 and its efficacy in controlling banana leaf spot and post-harvest anthracnose diseases[J]. Biological Control, 2010, 55(1): 1-10.
[8] 何 红, 蔡学清, 陈玉森, 等. 辣椒内生枯草芽孢杆菌BS-2和BS-1防治香蕉炭疽病[J]. 福建农林大学学报, 2002, 31(4): 442-444.
[9] 谭志琼, 淦国英, 张荣意. 枯草芽孢杆菌B68对香蕉果实潜伏炭疽菌的抑制作用[J]. 广西热带农业, 2006, 5(10): 1-3.
[10] Alvindia D G, Natsuaki K T. Biocontrol activities of Bacillus amyloliquefaciens DGA14 isolated from banana fruit surface against banana crown rot-causing pathogens[J]. Crop Protection, 2009, 28(3): 236-242.
[11] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[12] 中国科学院微生物研究所细菌分类组. 一般细菌常用鉴定方法[M]. 北京: 科学出版社, 1978.
[13] 布坎南, 吉本斯. 伯杰细菌鉴定手册(第八版)[M]. 北京: 科学出版社, 1984.
[14] 易有金, 尹华群, 罗 宽, 等. 烟草内生短短芽孢杆菌的分离鉴定及对烟草青枯病的防效[J]. 植物病理学报, 2007, 37(3): 301-306.
[15] 汪 茜, 胡春锦, 柯仿钢, 等. 生防菌株1404的鉴定及其对采后柑橘炭疽病的防治效果[J]. 微生物学报, 2010, 50(9): 1 208-1 217.
[16] Hwang J Y, Shim C K, Ryu K Y, et al. Selection of Brevibacillus brevis B23 and Bacillus stearothermophilus B42 as biological control agents against sclerotinia rot of lettuce[J]. Research in Plant Disease, 2006, 12(3): 254-259.
[17] Haggag W M. Isolation of bioactive antibiotic peptides from Bacillus brevis and Bacillus polymyxa against Botrytis grey mould in strawberry[J]. Archives of Phytopathology and Plant Protection, 2008, 41(7): 477-491.
[18] Sunita C, Eunice J A, Steve W. Biological control of Fusarium oxysporum f.sp. lycopersici on tomato by Brevibacillus brevis[J]. Journal of Phytopathology, 2010, 158(7-8): 470-478.
[19] 张 璐, 丁延芹, 杜秉海, 等. 黄瓜枯萎病病原拮抗细菌DS-1菌株鉴定及其生防效果研究[J]. 园艺学报, 2010, 37(4): 575-580.
[20] 车建美, 刘 波, 蓝江林. 短短芽孢杆菌JK-2的GFP标记及其抑菌作用[J]. 中国生物防治, 2010, 26(2): 230-234.
[21] Walker R, Powell A A, Seddon B. Brevibaeillus isolates from the spermosphere of peas and dwarf French beans with antifungal activity against Botrytis cinerea and Pythium species[J]. Journal of Applied Microbiolog, 1998(84): 791-801.
[22] 陈 莉, 缪卫国, 刘海洋, 等. 短短芽孢杆菌A57菌株对棉花主要病原真菌的拮抗作用及其最佳液体发酵条件[J]. 中国生物防治, 2007, 23(增刊): 22-27.
[23] 张洪涛, 于频频, 艾山江· 阿布都拉, 等. 棉花黄萎病高效拮抗菌XJUL-6的筛选鉴定及其特性研究[J]. 微生物学报, 2007, 47(6): 1 084-1 087.
[24] 郝变青, 马利平, 乔雄梧, 等. 芽孢杆菌BC98-Ι拮抗蛋白性质及其对黄瓜枯萎病菌的抑菌作用[J]. 石河子大学学报(自然科学版), 2004, 22(增刊): 91-94.
[25] 陈 冲, 王程亮, 张潞生. 蜡状芽孢杆菌TS-02防治草莓白粉病研究[J]. 安徽农业科学, 2007, 35(11): 3 298-3 299.
[26] Han Y X, Hu B J, Wang G N. Control efficacy and antifungal mechanism of Bacillus cereus strain JK14 against wheat take-all disease[J]. Agricultural Science & Technology, 2008(9): 70-74.
[27] 车建美, 刘 波, 张 彦, 等. 青枯病生防菌蜡状芽孢杆菌(ANTI-8098A)的绿色荧光蛋白基因(gfp)转导及其生物学特性的变化[J]. 农业生物技术学报, 2010, 18(2): 337-345.