益生素添加水平对断奶獭兔肠道免疫力的影响
蒋立等

摘要[目的]研究不同益生素添加水平对断奶獭兔肠道免疫能力的影响。[方法]选择80只体重相近的35日龄的健康断奶獭兔,按公母各半随机分为4个组(I、Ⅱ、Ⅲ、Ⅳ组),分别饲喂添加0、0.1、0.2和0.4 g/kg水平益生素的饲粮,预试期7 d,试验期60 d。试验结束后测定腹泻率及十二指肠、回肠与直肠的pH和SIgA含量。[结果]在饲料中添加益生素对断奶獭兔的腹泻率、平均日增重与料重比均有影响显著(P<0.05);其中Ⅲ组的日增重最高、料重比及腹泻率最低,Ⅲ组的日增重比I组升高10.96%,Ⅲ组料重比和腹泻率分别比I组降低7.37%及59.44%;肠道环境pH随益生素添加水平的升高先降低后回升,但只有Ⅱ与Ⅲ组的盲肠环境pH发生了显著变化(P<0.05),与I组相比分别低了3.03%与4.43%;回肠与十二指肠的SIgA含量不受益生素添加水平的影响(P>0.05),Ⅳ组的空场SIgA含量较I组高8.84%(P<0.05)。[结论]断奶獭兔基础日粮中添加适宜的益生素可以降低腹泻率,影响其肠道环境与提高肠道免疫屏障,最佳添加水平为0.2 g/kg。
关键词断奶獭兔;腹泻;肠道环境pH;肠道SIgA;益生素
中图分类号S816.71文献标识码A文章编号0517-6611(2015)29-066-02
断奶獭兔往往因断奶应激造成机体免疫力与肠道免疫功能受损而发生腹泻,而兔属于单胃草食性动物,其消化道特别发达,因此增强肠道免疫功能对于抵抗腹泻的发生十分重要。断奶后,幼兔开始采食固体饲料,胃肠道发生从吸食乳汁到采食饲料的转变,这种日粮形式上的改变会引起肠道菌群与肠道环境pH的变化,而肠道环境pH影响着肠道菌群数量、种类、组成比例及分布,從而影响对腹泻抵抗的能力。常万波研究发现适当提高断奶獭兔日粮NDF含量不仅降低了其腹泻率、盲肠内大肠杆菌数量及pH,还增加了肠道 IgA的数量。Vaerman研究发现肠黏膜IgA浆细胞分泌的SIgA是动物机体分泌量最大的免疫球蛋白,对于实现肠道的免疫功能起着关键作用。大量研究表明,添加益生素可以调节动物肠道菌群平衡、增强免疫力与降低腹泻。但是,目前关于日粮添加益生素的水平对獭兔肠道免疫力影响的报道较少。为此,笔者研究了不同的益生素添加水平对断奶仔獭兔的腹泻率、肠道pH和肠道SIgA含量的影响,旨在为科学添加益生素来预防断奶腹泻提供参考与理论依据。
1材料与方法
1.1试验设计与动物饲粮
将80只断奶商品仔獭兔(35日龄、健康、公母各半、体重约695.72 g,购自四川金富农业有限公司)按单因素随机试验设计,随机分为I、Ⅱ、Ⅲ、Ⅳ组4组,各组饲粮的益生素添加水平分别为0 、0.1、0.2、0.4/kg,其基础日粮的营养水平为:消化能11.48 MJ/kg、粗蛋白1850%、 粗纤维11.46%、钙0.93%、磷0.55%;益生素由50%的地衣芽胞杆菌与50%的枯草芽孢杆菌组成,活性为200×108 个/g。
1.2饲养管理
自由采食与饮水,每天饲喂3次;预试期7 d,试验期为60 d,于西南科技大学校内实验场进行单笼饲养,每笼1只。采用自然采光与通风,常规免疫、饲养管理及生长情况的测定与记录。
1.3测定指标与方法
1.3.1腹泻率。按照以下公式计算腹泻率:腹泻率(%)=每组腹泻兔数量×腹泻天数/(每组兔总数×试验天数)。
1.3.2肠道环境的pH。试验结束时空腹称重;心脏空气注射致死;打开腹腔剥离肠道,结扎十二指肠、空肠、回肠和盲肠后,使用pHS3C型酸度计迅速在各肠段上3个不同位点插入1 cm深,测定pH。
1.3.3肠道粘膜SIgA浓度。
测定肠道pH后,立刻剪取十二指肠、空肠和回肠中上段约5 cm,用PBS洗净肠道内容物后刮取粘膜存于-70 ℃冰箱中,供测定SIgA浓度。参考付超辉的方法,使用南京建成科技有限公司的兔SIgA酶联免疫检测Kit进行测定。
1.4数据处理
使用SPSS17.0统计软件对试验数据进行统计分析。对试验数据进行单因素方差分析与多重比较分析,结果以平均值±标准差表示。
2结果与分析
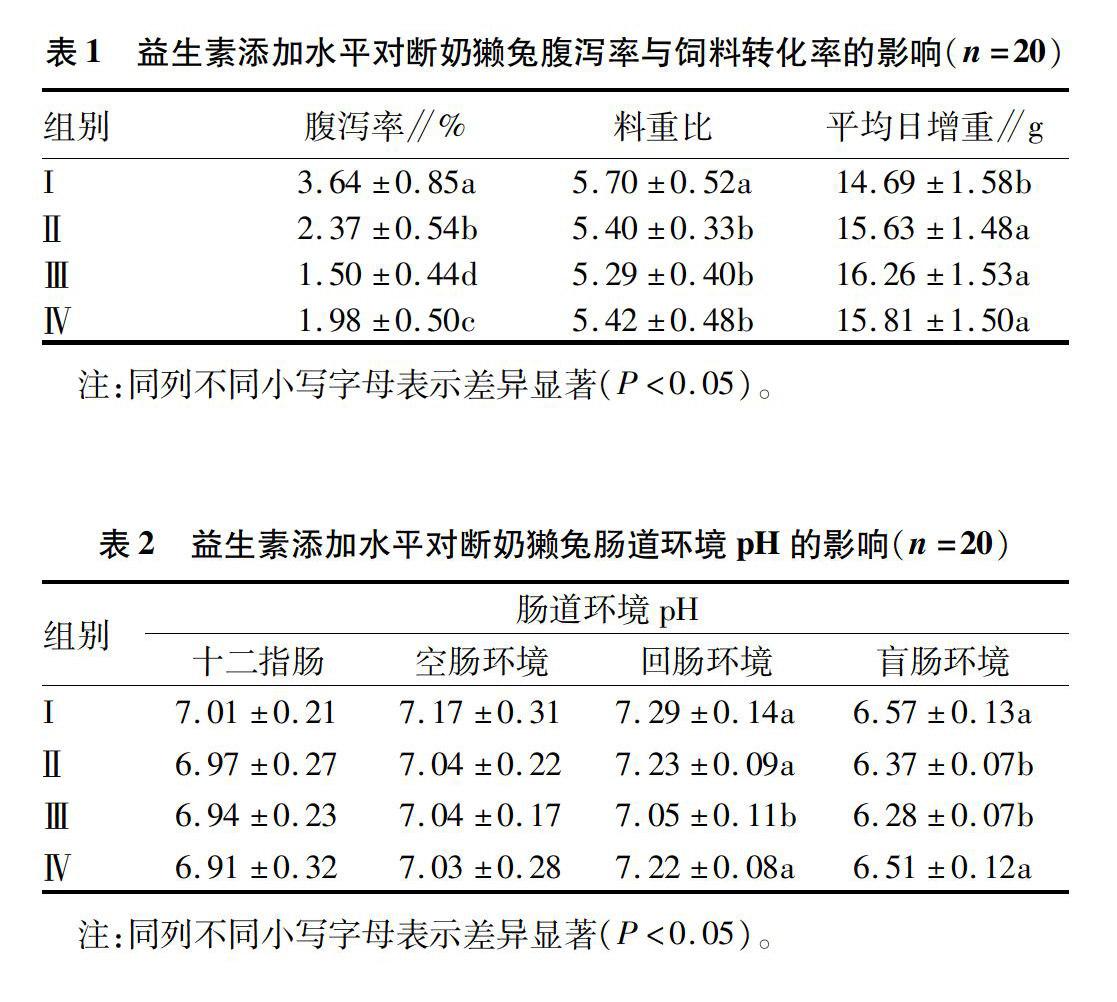
2.1益生素添加水平对断奶獭兔腹泻率与饲料转化率的影响
从表1可以看出,饲粮益生素添加水平对腹泻率、料重比与平均日增重均有显著的影响(P<0.05)。Ⅲ组断奶獭兔的日增重最高,腹泻率及料重比最低,Ⅲ组日增重比I组升高10.96%,Ⅲ组腹泻率和料重比较I组分别降低59.44%及737%。根据腹泻率与饲料转化率可知,0.2 g/kg的益生素添加水平最适断奶獭兔的生长。
2.2益生素添加水平对断奶獭兔肠道环境pH的影响从表2可以看出,随着日粮益生素添加水平的升高,肠道环境pH均呈现出先降低后又回升的趋势,但十二指肠与空肠环境的pH未发生显著变化(P>0.05);此时,各组十二指肠、空肠和回肠的pH均依次升高,而小肠pH均高于盲肠。I组、Ⅱ组与Ⅳ组回肠环境pH无显著差异(P>0.05),Ⅲ组回肠环境pH比I组显著降低3.31%(P<0.05)。添加01和0.2 g/kg的益生素后,盲肠环境pH分别显著降低303%和4.43%,而添加0.4 g/kg的益生素未能显著改变其pH,同时Ⅱ组与Ⅲ组盲肠环境pH差异不显著(P>0.05)。
2.3益生素添加水平对断奶獭兔肠道免疫屏障的影响从表3可以看出,日粮益生素添加水平对断奶獭兔回肠与十二指肠的SIgA含量没有明显影响,但却表现出随添加水平的上升而升高的趋势。对于空肠SIgA含量,只有IV组才表现出显著的升高趋势(P>0.05),比I组高8.84%;而Ⅱ、Ⅲ、Ⅳ组间差异不显著(P<0.05)。由此可见,益生素添加水平为0.4 g/kg时,断奶獭兔肠道免疫屏障功能较强。3讨论
3.1益生素添加水平对断奶獭兔腹泻率的影响
该试验结果表明添加益生素能降低断奶獭兔的腹泻率,并且当益生素添加水平达到一定值后,虽然仍能降低腹泻率,但降低幅度却在减小,说明对腹泻的抵抗能力在减弱,与郭肖兰等对獭兔的研究结果相似,但不同的是该试验中腹泻率在Ⅱ、Ⅲ、Ⅳ组间存在显著差异(P<0.05)。研究表明,枯草芽孢杆菌和地衣芽孢杆菌还能通过提高蛋鸡、肉鸡及断奶仔猪等动物对营养物质的消化率而减少腹泻。该试验中所用的益生素是由50%的地衣芽胞杆菌与50%的枯草芽孢杆菌组成。同时,芽孢杆菌为需氧菌,当其未超过最佳数量时,消耗大量氧气后致使胃肠内氧气浓度大大减少,这样大肠杆菌和沙门氏菌等有害需氧菌的繁殖就会受到抑制,从而使乳酸杆菌和双歧杆菌等有益菌处于优势菌群地位,因而能较强地抵抗腹泻的发生;但是,当芽孢杆菌超过最佳数量时,消耗的氧气过度,消化道环境中的氧气就不足以进行营养物质的充分消化与吸收,反而不利于抵抗腹泻,这可能是益生素添加到达一定水平后腹泻率降低幅度减少的原因之一。Qiu等对益生素作用的研究也证实益生素添加水平过高会引起动物腹泻。
3.2益生素添加水平对断奶獭兔肠道环境pH的影响
该试验结果表明断奶獭兔小肠环境pH高于盲肠,这一现象并不受益生素添加水平的改变,这与周梦蕊研究乳酸菌对断奶獭兔肠道微生态的研究结果相似。已有研究表明,断奶仔猪与肉牛的十二指肠、空肠和回肠pH值依次升高,该试验也得到相同的结果。该试验中日粮添加益生素会降低断奶獭兔肠道环境pH,与芽胞杆菌制剂可以降低断奶仔猪胃肠道pH的试验结果相同;但是,周梦蕊研究发现35日龄的断奶獭兔日粮中添加乳酸菌后,80日龄与110日龄的肠道环境pH是升高的,二者不同的原因可能是添加的益生素种类不同。盲肠内较低的pH 有利于动物的肠道健康,该试验结果也证实了中、高水平的益生素不仅显著降低了断奶獭兔盲肠的pH,而且也明显降低了獭兔的腹泻率;但是,较高水平的益生素处理盲肠的pH降低幅度与腹泻率降低幅度同时减小。同样,孙小琴等研究表明日粮添加柠檬酸对蛋鸡消化道pH的降低作用逐渐减小。在獭兔对饲粮的消化中,其盲肠起着特别重要的作用,因为盲肠特别发达,其长度与体长接近;未被胃和小肠消化吸收的营养物质会进入盲肠进行发酵产生挥发性脂肪酸(VFA),不仅影响其pH,而且还抑制盲肠内的大肠杆菌等有害菌的繁殖,而对腹泻达到一定的抵抗作用。
3.3益生素添加水平对断奶獭兔肠道免疫屏障的影响
该试验结果表明断奶獭兔十二指肠、空肠、回肠分泌的SIgA量均呈现出随日粮益生素添加水平的增加而上升的趋势。已有研究发现,添加维生素E也能提高吉戎兔小肠中SIgA的含量,从而提高其肠道的免疫功能。小肠黏膜SIgA是肠道免疫屏障最典型的指标,它能够识别并与细菌的抗原决定簇相结合,阻止抗原与致病微生物入侵到肠腔内而促进肠道健康。已有研究表明,断奶家兔日粮添加适量的谷氨酰胺、ADF、半乳甘露寡糖等均能显著促进小肠黏膜SIgA的分泌与提高其SIgA的含量而增强肠道黏膜免疫功能。研究表明,肠道粘膜SIgA主要通过对有害菌群增殖的抑制,而减少腹泻率。该试验中0.4 g/kg益生素添加组断奶獭兔空肠的SIgA含量显著增加,同时其腹泻率也显著降低,表明益生素能刺激肠黏膜分泌更多的SIgA,其机理可能是益生素能影响黏膜免疫抗原、提高其通路的活化与SIgA的表达,主要通过维持肠道菌群平衡而促使有益菌生长而实现的。益生菌灌注小鼠诱导激活肠黏膜免疫的试验结果证实小肠中IgA数量和固有层中Toll样受体2(TLR-2)基因表达水平等明显升高。
4结论
在断奶獭兔日粮中添加适宜水平的益生素能有效降低腹泻率与提高肠道的免疫力,在该试验条件下最适添加水平为0.2 g/kg。
参考文献
[1] RODRIGUEZ A,SMITH H W.The identification of the antimicrobial factors of the stomach contents of suckling rabbits [J].Biochem J,1966,100:79-82.
[2] 常万波.日粮不同能量水平对獭兔胃肠道内环境、免疫性能以及IFN-γ和RLA-A3表达量的影响[D].杨凌:西北农林科技大学,2013.
[3] VAERMAN J P,LANQENDRIES A,PABST R,et al.Contribution of serum IgA to intestinal lymph IgA,and vice versa,in minipigs[J].Veterinary immunology and immunopathology,1997,58:301-08.
[4] 付朝辉.日粮谷氨酰胺添加水平对生长獭兔生产性能、代谢性能及肠道黏膜屏障的影响[D].泰安:山东农业大学,2014.
[5] 郭肖蘭,任战军.益生素对断奶獭兔生长性能、消化率及腹泻率的影响[J].西北农业学报,2013,22(4):27-31.
[6] QIU R,CROOM J,ALI R H,et al.Direct fed microbial supplementation repartitions host energy to the immune system[J].Journal of animal science,2012,90(8):2639-2651.
[7] 周梦蕊.乳酸菌对断奶獭兔肠道微生态的影响[D].杨凌:西北农林科技大学,2013.
[8] 辛娜,张乃锋,刁其玉,等.芽孢杆菌制剂对断奶仔猪生长性能、胃肠道发育的影响[J].畜牧兽医学报,2012,43(6):901-908.
[9] 周韶,李树聪.不同精料水平对肉牛瘤胃和小肠pH值的影响[J].饲料工业,2003,24(5):27-28.
[10] 孙小琴,龚月生,段玉兰.柠檬酸对蛋鸡消化道内容物 pH和盲肠菌群的影响[J].西北农林科技大学学报(自然科学版),2007,35(4):41-44.
[11] 王振东,堵光莹,彭易柱.维生素E对健康吉戎兔小肠中slgA质量浓度的影响[J].饲料研究,2012(10):11-13.
[12] MANTIS N J,ROL N,CORTHASY B.Secretory IgAs complex roles in immunity and mucosal homeostasis in the gut[J].Mucosal immunology,2011,4(6):603-611.
[13] SIRISINHA S.The pleiotropic role of vitamin A in regulating mucosal immunity[J].Asian Pac J Allergy Immunol,2015,33(2):71-89.
[14] GALDEANO C M,PERDION G.The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity[J].Clinical and vaccine immunology,2006,13(2):219-226.

