帕金森病患者与特发性震颤患者黑质经颅超声检测指标的比较
李秋菊,马惠姿,王雪梅,冯 涛*
(首都医科大学附属北京天坛医院:1神经学科会诊中心,2神经病学中心神经变性病科;3国家神经系统疾病临床医学研究中心,北京 100050)
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统变性疾病,具有震颤、强直、运动减少和平衡障碍等特征性临床表现,主要病理学特征是中脑黑质致密部多巴胺能神经元的选择性退变[1]。Becker等[2]最先提出了应用经颅多普勒超声(transcranial duplex sonography,TCD)可以检测到PD患者黑质部位的强回声。随后Berg等[3]研究提出黑质经颅超声(transcranial sonography,TCS)诊断PD的灵敏度可达91%。
临床实践中观察到有相当一部分震颤患者临床表现有姿势性震颤和混杂静止性震颤,很难鉴别是特发性震颤(essential tremor,ET)还是PD。本试验旨在研究黑质彩超对原发性PD与ET的诊断和两者之间的鉴别诊断的意义。
1 对象与方法
1.1 研究对象
选取2013年9月至2014年3月在北京天坛医院就诊的原发性PD患者和ET患者作为研究对象。PD患者58例,其中男性35例,女性23例,年龄(59.22±11.98)岁,Hoehn-Yahr病情分级:Ⅰ~Ⅳ级。入选标准:(1)诊断均符合英国帕金森病协会脑库的临床诊断标准[4];(2)可接受并完成黑质TCS检查。排除标准:(1)继发性帕金森综合征、帕金森叠加综合征;(2)符合美国精神病学会制定的美国精神障碍诊断统计手册第4版(diagnostic and statistical manual of mental disorders,DSM-Ⅳ)的痴呆诊断标准;(3)符合阿尔茨海默病、血管性痴呆、额颞叶痴呆等其他类型痴呆的诊断标准;(4)语言障碍、构音障碍和聋哑等不能配合完成检查者;(5)严重心肺疾病、肿瘤、肝肾疾病等慢性消耗性疾病者;(6)精神障碍者。
ET患者60例,其中男性35例,女性25例,年龄(55.25±13.69)岁。入选标准[5]:(1)双手及前臂明显且持续的姿势性和(或)动作性震颤;(2)不伴有其他神经系统体征;(3)可仅有头部震颤,但不伴有肌张力障碍。排除标准:(1)存在引起生理亢进性震颤的因素;(2)正在或近期使用过致震颤药物或处于撤药期;(3)起病前3个月内有神经系统外伤史;(4)有精神性(心理性)震颤的病史或临床证据;(5)突然起病或病情呈阶梯式进展恶化。
1.2 方法
1.2.1 临床资料 所有受试者均接受有关一般资料与临床特征资料的问卷,包括:性别、年龄、发病年龄、病程、现病史、既往史、家族史和用药情况等。受试者均由两位神经内科医师完成问诊和诊断。
1.2.2 TCS检查 所有入组的受试者均完成黑质TCS检查。选用PHILIPS IU22超声仪,超声探头为S5~1,动态范围为50~170dB,设置穿透深度14~16cm。受检者取仰卧位,将探头紧贴于受检者颅骨一侧颞窗,沿眶听线轴向扫描中脑水平横断面,以同样方法从对侧重复扫描。
所有受检者TCS检查均依照盲法原则由两名超声检查者完成,应用超声机器配套软件处理分析图像,分别标记3次黑质强回声区域,并测量面积,计算平均值。如果双侧颞窗均不能穿透,无法获得黑质区强回声面积者记为失败,不再入组。根据Berg等[6]的评定标准,正常黑质(substantia nigra,SN)强回声的面积上限为0.20cm2。黑质强回声面积≥0.20cm2为病理性,作为黑质TCS阳性的诊断标准。
1.3 统计学处理
应用SPSS17.0软件完成统计学分析。计量数据用±s表示,采用t检验比较组间差异;计数资料用百分率表示,采用χ2检验进行计数资料的组间比较。使用ROC曲线探寻TCS检测黑质的强回声面积,确定PD的最佳阈值,并计算在此阈值下的敏感度和特异度。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况及超声检查
排除黑质TCS失败的患者后,共纳入58名PD患者和60名ET患者,患者临床资料及检查结果见表1。PD患者的黑质强回声面积以及黑质强回声总面积占中脑总面积的百分比与ET患者比较,差异均具有统计学意义(P<0.05)。以黑质强回声面积<0.20cm2为阴性结果,黑质强回声面积≥0.20cm2为阳性结果,比较两组患者的TCS检查结果,PD患者的黑质强回声面积阳性率与ET患者比较,差异具有统计学意义(χ2=26.68,P<0.01;表2)。
2.2 TCS用于PD诊断的ROC曲线及诊断评价指标
将TCS用于PD诊断及鉴别诊断时,ROC曲线下面积为A=0.801,SE为0.041,95%CI为0.721~0.881。当其临界值取0.205时,敏感度为74.1%,特异度为76.7%,证明其具有良好的诊断及鉴别诊断的价值(图1)。
3 讨 论
PD是一种以运动迟缓、静止性震颤、肌强直和姿势平衡障碍为主要临床表现的神经系统变性疾病。以往PD的诊断主要依靠临床医师的经验,漏诊率和误诊率不容小觑。只有当黑质纹状体的多巴胺能神经元减少到正常值的70%以上才会产生临床症状。因此,PD患者出现临床症状之前可能已存在较长的无症状期。随着影像技术的发展,近年来PD的诊断更加依靠影像学证据。
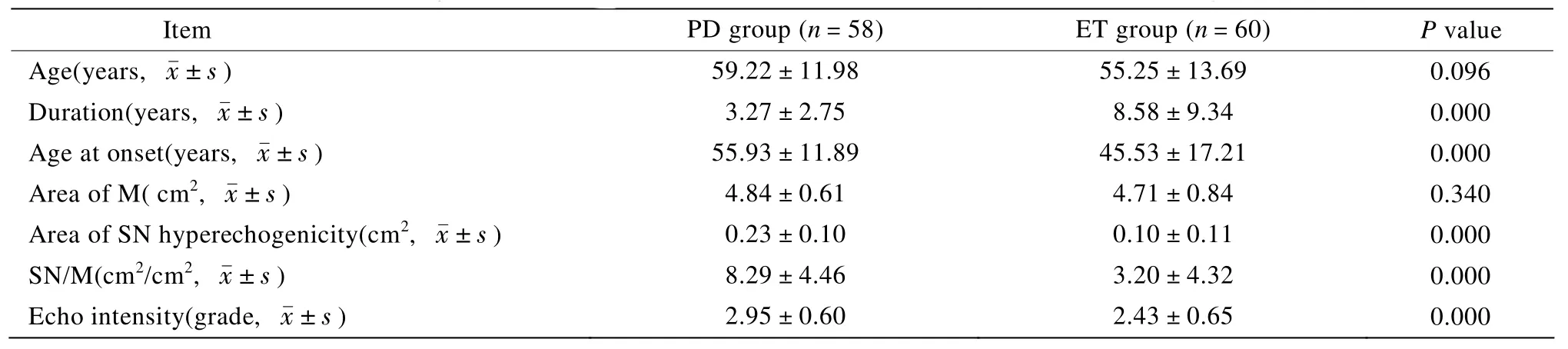
表1 PD患者及ET患者一般资料及TCS检测结果比较Table1 Comparison of demographics and TCS examinations between PD and ET patients

表2 PD患者及ET患者TCS检测黑质强回声阳性率比较Table2 Comparison of positive rate of TCS between PD and ET patients[n(%)]

图1 TCS用于PD鉴别诊断的ROC曲线Figure1 ROC curve of PD differential diagnosis by TCS
同时,我们观察到很多锥体外系疾病的患者存在相似的临床表现,如ET患者除表现有姿势性震颤外,还合并有静止性震颤[7]。有的PD患者不单存在静止性震颤,间或存在姿势性震颤[8]。给我们的临床诊断带来一定困难。因此,需要某些客观的辅助检查协助PD的临床诊断与鉴别诊断[9]。
TCS是一种透过完整颅骨测量脑组织回声强度的神经影像学技术,既往研究结果证实基底节强回声的产生与组织中铁含量相关,这可见于原发性PD、多系统萎缩、进行性核上性麻痹[10]以及认知功能障碍综合征[11]等。中脑黑质和苍白球内侧部超声回声增强是PD患者显著的超声特征[12]。即使是非常轻微的变性损伤,没有被核磁等检查发现,都有可能被超声探测到。中脑黑质色素细胞的缺失是PD退行性变的典型特征,伴随细胞结构的改变和胶质细胞增生。胶质细胞的相对增多及细胞内显微结构的改变会导致PD患者黑质TCS回声增强。
本研究结果显示,性别、年龄相匹配的PD患者与ET患者的病程与发病年龄具有显著性差异。ET患者病程长于PD患者、发病年龄远早于PD患者。两组患者中脑面积无差异;PD患者中脑强回声面积、中脑强回声面积占中脑总面积的百分比高于ET患者,具有显著性差异。以黑质强回声面积≥0.20cm2为TCS检查阳性的标准,PD患者阳性率明显高于ET患者,具有显著性差异。本研究通过ROC曲线确定,0.205cm2为最佳阈值,这与Gaenslen等[13]及Vlaar等[14]的研究相吻合。Berg等[6]早在2001年即将黑质TCS面积0.2cm2作为阳性结果的阈值,但也有研究将0.26cm2作为阳性结果的标准。无论采用哪种诊断标准,TCS均具有较高的诊断敏感度。我们的研究显示在取0.205作为界值时,诊断敏感度为74.1%,特异度为76.7%。
TCS具有较高的阳性预测价值,在国际上早有报道。2008年,Gaenslen等对60名具有轻度帕金森综合征症状的患者进行为期1年的随访,每3个月进行1次TCS检查,对不能明确诊断的患者行PET或SPECT检查,最终39名患者被诊断为PD,10人为非典型帕金森综合征,TCS的阳性预测值达到92.9%。但也有研究显示TCS诊断PD的敏感度只有50%左右,Vlaar等研究提示TCS将原发性PD患者与无黑质退行性变患者鉴别开的敏感度和特异度分别为50%和82%。这可能与研究中黑质TCS阳性的判断标准及研究方法的差异有关。
近期有研究报道[15],黑质TCS检测和嗅觉检测两种快速、安全、简易的方法联合应用对PD与ET的鉴别诊断效果比单一方法具有更高的特异性,并且对早期PD患者的诊断更具帮助。
本研究中PD患者与ET患者入组例数相对较少,在今后的研究中将近一步扩大样本量,对PD患者的病程及疾病严重程度进行分层,分析不同病程与疾病严重程度是否与黑质TCS检测级别呈相关性。
综上所述,对于具有PD样表现、临床诊断较为困难的患者,可选用TCS作为辅助诊断工具,TCS结果阳性则可能支持PD诊断,而TCS结果阴性的患者不可以排除PD诊断,需进一步进行其他检查以明确诊断。
【参考文献】
[1]Bekris LM, Mata IF, Zabetian CP. The genetics of Parkinson’s disease[J]. J Geriatr Psychiatry Neurol, 2010,23(4):228−242.
[2]Becker G, Seufert J, Bogdahn U,et al. Degeneration of substantia nigra in chronic Parkinson’s disease visualized by transcranial color-coded real-time sonography[J].Neurology, 1995, 45(1):182−184.
[3]Berg D, Siefker C, Ruprecht-Dörfler P,et al. Relationship of substantia nigra echogenicity and motor function in elderly subjects[J]. Neurology, 2001, 56(1):13−17.
[4]Gibb WR, Lees AJ. The relevance of the Lewy body to the pathogenesis of idiopathic Parkinson’s disease[J]. J Neurol Neurosurg Psychiatry, 1988, 51(6):745−752.
[5]Bain P, Brin M, Deuschil G,et al.Criteria for the diagnosis of essential tremor[J]. Neurology, 2000, 54(11 Suppl 4):S7.
[6]Berg D, Siefker C, Becker G. Echogenicity of the substantia nigra in Parkinson’s disease and its relation to clinical findings[J]. J Neurol, 2001, 248(8):684−689.
[7]Wu Y, Ding J, Gao Y,et al.Mini review:linkages between essential tremor and Parkinson’s disease[J]?Front Cell Neurosci, 2013, 7:118.
[8]Coria F, Gimenez-Garcia M, Samaranch L,et al.Nigrostriatal dopaminergic function in subjects with isolated action tremor[J]. Parkinsonism Relat Disord,2012, 18(1):49−53.
[9]Berardelli A, Wenning GK, Antonini A,et al.EFNS/MDS-ES/ENS Recommendations for the diagnosis of Parkinson’s disease[J]. Eur J Neurol, 2013, 20(2):16−34.
[10]Felletschin B, Bauer P, Walter U,et al. Screening for mutations of the ferritin light and heavy genes in Parkinson’s disease patients with hyperechogenicity of the substantia nigra[J]. Neurosci Lett, 2003, 352(1):53−56.
[11]Laučkaitė K, Rastenytė D, Šurkienė D,et al. Specificity of transcranial sonography in parkinson spectrum disorders in comparison to degenerative cognitive syndromes[J]. BMC Neurol, 2012, 12:12.
[12]Behnke S, Berg D, Naumann M,et al. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound[J]. J Neurol Neurosurg Psychiatry, 2005, 76(3):423−425.
[13]Gaenslen A, Unmuth B, Godau J,et al. The specificity and sensitivity of transcranial ultrasound in the differential diagnosis of Parkinson’s disease:a prospective blinded study[J]. Lancet Neurol, 2008, 7(5):417−424.
[14]Vlaar AM, de Nijs T, van Kroonenburgh MJ,et al. The predictive value of transcranial duplex sonography for the clinical diagnosis in undiagnosed parkinsonian syndromes:comparison with SPECT scans[J]. BMC Neurol, 2008, 8:42.
[15]López Hernández N, García Escrivá A, Shalabi Benavent M.Diagnostic value of combined assessment of olfaction and substantia nigra hyperechogenicity for Parkinson’s disease[J].Neurologia, 2014. doi:10.1016/j.nrl.2014.03.010.

