大豆ASR表达提高酵母和烟草细胞对Cu2+耐受力
高 阳,刘国宝,刘 科,李冉辉,郑易之
深圳市微生物基因工程重点实验室,深圳大学生命科学学院,深圳 518060

【生物工程 / Bioengineering】
大豆ASR表达提高酵母和烟草细胞对Cu2+耐受力
高 阳,刘国宝,刘 科,李冉辉,郑易之
深圳市微生物基因工程重点实验室,深圳大学生命科学学院,深圳 518060
利用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术,证明大豆幼苗在150 μmol/L CuSO4胁迫3 h后,其叶和根内GmASR基因表达均上调.将大豆GmASR基因转化Cu2+敏感型酵母菌ΔCUP2和烟草悬浮细胞BY-2,GmASR蛋白的表达可增强重组酵母和转基因烟草细胞抗Cu2+胁迫的能力.利用大肠杆菌表达体系表达、分离并纯化大豆GmASR蛋白,体外实验证明,GmASR蛋白可与Cu2+结合,并具有清除羟基自由基的能力.研究结果推测,ASR蛋白可通过螯合Cu2+降低细胞内Cu2+浓度,提高植物对Cu2+胁迫的耐受力.
植物基因工程;GmASR基因;转基因烟草;重组突变体酵母;抗金属离子胁迫;金属离子结合蛋白
ASR(abscisicacid,stress,ripening-induced)基因是植物中一类受脱落酸(abscisicacid,ABA)、胁迫和果实成熟诱导表达的基因.Gonzalez等[1]首次从西红柿叶中分离出了ASR基因,并在30余种单子叶和双子叶植物中克隆到ASR基因.然而,在模式植物拟南芥中未发现ASR同源基因[2].ASR基因可编码分子质量相对较小的碱性蛋白质(10~30kDa),富含甘氨酸、谷氨酸、丙氨酸、赖氨酸以及组氨酸,具有较高的亲水性及热稳定性.ASR蛋白序列中通常含有3~5个保守区,不同ASR蛋白具有不同的保守区域,每个保守区都富含组氨酸[3].
ASR蛋白的表达模式具有多样性,ABA、胁迫和果实成熟过程都可以诱导植物体内ASR基因表达[4-5].如ABA存在条件下,香蕉mAsr3和mAsr4的相对表达量上升显著[6].干旱胁迫可诱导西红柿叶中的ASR1和ASR2基因表达上调,然而在根中只有ASR2基因表达上调[7].铝胁迫时,水稻ASR5基因的转录水平上升[8].ASR基因表达模式的多样性意味着ASR蛋白可能参与植物细胞对多种环境信号的响应.一些转基因实验也证明,ASR基因的过表达能提高植物对非生物胁迫的耐受力,如大蕉MpASR基因的过表达可使转基因拟南芥耐旱性提高[9];百合花粉LLA23基因(ASR)和番茄ASR1基因的过表达可分别使转基因拟南芥和转基因烟草的耐盐性提高[10-11].ASR蛋白可通过多种机制提高植物的抗逆功能,如体外实验证明,西红柿ASR1蛋白能够保护乳酸脱氢酶、限制性内切酶SmaI等的活性[12].西红柿ASR1蛋白在Zn2+存在时能与DNA结合,可能起到转录因子的作用[13].ASR基因在植物细胞中的保护功能和保护机制仍需要进一步研究.
Cu2+是植物生长和发育的必需微量元素,但过量Cu2+积累会对植物细胞产生毒害作用[14].如前所述,ASR蛋白可能参与植物对干旱、高盐和铝胁迫的保护作用,然而它能否提高植物对重金属离子(如Cu2+)胁迫的耐受性还不清楚.大豆基因组编码3个ASR蛋白(Glyma10g36890.1、Glyma16g28150.1和Glyma20g30720.1),本实验室克隆得到第3个GmASR基因(Glyma20g30720.1),先前的研究表明,大豆GmASR蛋白具有结合Fe3+和Zn2+的特性,并能减少由Fe3+产生的羟基自由基[15].本研究检测了在Cu2+胁迫过程中,大豆幼苗GmASR基因的表达模式,并证明大豆GmASR基因表达可提高Cu2+敏感酵母突变株和转基因烟草悬浮细胞对Cu2+的耐受力,探讨了ASR蛋白对植物细胞保护的分子基础.
1 材料与方法
1.1 材 料
1.1.1 植物材料、菌株和载体
选取大豆(GlycinemaxL.)“白农六号”种子(由吉林省白城市农业科学研究所提供),萌发后将其移栽到Hoagland营养液中.培养至两片真叶期,将大豆幼苗进行150μmol/LCuSO4胁迫处理,间隔一定时间取幼根和幼叶于-80 ℃保存,用于RNA提取.
烟草悬浮细胞BY-2(由香港中文大学姜里文教授惠赠)在MS液体培养基中,于28 ℃条件下120r/min振荡培养.悬浮细胞3~4d继代一次[16].
酿酒酵母Cu2+敏感突变株ΔCUP2购自Euroscarf公司.酵母表达载体pYES2/CT载体(Invitrogen公司生产)、植物表达载体pCAMBIA1300和pBI121、大肠杆菌重组质粒pET28a/GmASR[15]、大肠杆菌菌株Top10和BL21star,以及农杆菌LBA4404菌株均由本实验室保存.
1.1.2 培养基及主要试剂
培养大肠杆菌使用LB培养基(lysogenybrothmedium),酵母细胞使用YPD培养基(yeastextractpeptonedextrosemedium),烟草悬浮细胞BY-2使用MS培养基(murashigeandskoogmedium;4.3g/LMS粉、30g/L蔗糖、0.255g/L磷酸二氢钾、1mg/L维生素B1、0.4mg/L2,4-D、100mg/L肌醇,pH=5.0).MS粉购于Caisson公司,分子克隆相关酶购于Takara公司,其余化学试剂均为国产分析纯试剂.
1.2 方 法
1.2.1 荧光实时定量PCR
采用Trizol(Invitrogen公司)法提取大豆根叶组织中的总RNA,利用反转录试剂盒PrimeScriptTMⅡ1ststrandcDNAsynthesis(Takara公司)反转录合成cDNA,用作荧光定量聚合酶链式反应(polymerasechainreaction,PCR)的模板,正反引物分别为qGmASR-F和qGmASR-R(表1).以大豆actin基因作为内参,对应引物为actinF和actinR(表1).采用SYBR®PremixExTaqTMⅡ(Takara公司)试剂盒,进行PCR扩增(ABI7500PCR仪).PCR扩增程序如下:95 ℃预变性30s,95 ℃变性5s,60 ℃反应31s,40次循环.采用2-△△Ct方法分析Real-timeqPCR数据.

表1 实验引物汇总表
1.2.2 酵母表达载体的构建及酵母转化
根据GmASR基因序列(GenBank登录号:AY382827)设计引物Y-F和Y-R(表1),以pET28a/GmASR为模板进行PCR反应.将扩增的PCR片段进行HindIII和SacI酶切,再连接至酵母表达载体pYES2/CT.采用醋酸锂方法,将空载体pYES2/CT和重组表达载体pYES2/GmASR转化铜敏感型酵母(ΔCUP2),并利用组氨酸营养缺陷型培养基SCR(syntheticcompletemediumcontainingraffinose,以20g/L蜜三糖为碳源的SC(syntheticcompletemedium)培养基)筛选出阳性克隆ΔCUP2/pYES2和ΔCUP2/GmASR.
1.2.3Cu2+胁迫下酵母生长曲线的测定
挑取对照菌ΔCUP2/pYES2和重组菌ΔCUP2/GmASR各3个单克隆,在SCR液体培养基中(30 ℃,200r/min)培养2~3d.按体积比1∶10将菌液接种于诱导培养基(YPGal,含10g/L酵母提取物,20g/L蛋白胨,10g/L半乳糖,pH=5.8)中培养8h后,分别接入含100μmol/LCuCl2的YPGal培养基,菌液的初始浓度调至光密度(opticaldensity,OD)D(600)=0.02.间隔时间取样,测D(600)值,绘制生长曲线.实验重复3次.使用SPSS进行t检验(t-test)方差分析.
1.2.4 植物表达载体的构建及转化烟草悬浮细胞
用HindIII和EcoRI分别酶切质粒pBI121和pCAMBIA1300,将pBI121上的35S-GUS-Nos片段连到pCAMBIA1300上,构建质粒pCAMBIA1300-GUS,然后用XbaI和SacI切除GUS.设计引物BY-F和BY-R(表1),以重组质粒pET28a/GmASR为模板,进行PCR反应.获得的PCR片段经XbaI和SacI酶切后连到切除GUS的植物表达载体pCAMBIA1300中.用电击法将空载体、重组表达载体转入根癌农杆菌菌株LBA4404,得到对照菌LBA/1300和重组菌LBA/GmASR.
用农杆菌LBA/1300和LBA/GmASR转染烟草悬浮细胞BY-2.将转化的BY-2细胞平铺到含有潮霉素B和头孢霉素的固体筛选培养基上,28 ℃避光培养3~4周,直至细胞团形成.选择3个独立的转基因细胞团BY/GmASR和1个对照BY/1300转入MS液体培养基(含有潮霉素B和头孢霉素)中悬浮培养,用于后续分析.
继代培养2~3次后,提取各转基因细胞核糖核酸(ribonucleicacid,RNA),反转录成互补脱氧核糖核酸(complementarydeoxyribonucleicacid,cDNA).以cDNA为模板,以GmASR-F和GmASR-R为引物(表1)进行PCR鉴定,确认获得转基因细胞.烟草BY-actin(表1)作为内参基因.
1.2.5Cu2+胁迫下转基因烟草细胞生长的测定
将转空载体的对照BY/1300及转GmASR基因的烟草悬浮细胞BY/GmASR培养至对数期,将其涂布在正常或含50μmol/LCuSO4的固体培养基上,观测愈伤组织的生长.
1.2.6 固相金属螯合亲和层析和内源荧光法研究GmASR蛋白与Cu2+的结合
将pET28a/GmASR载体转化BL21star菌.异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)诱导GmASR蛋白的表达,并利用His亲和层析分离纯化GmASR蛋白[15].
通过固相金属螯合亲和层析方法检测GmASR蛋白与Cu2+的结合[17].色谱柱使用HiTrapTMChelatingHP(5mL;AmershamPharmaciaBiotech,Tokyo公司生产).GmASR蛋白浓度为35μmol/L.同时,采用内源荧光方法研究GmASR蛋白与Cu2+的相互作用.GmASR蛋白溶解在10mmol/LHEPES(pH=7.0)中,加入不同浓度的CuSO4溶液,GmASR蛋白的终浓度为25μmol/L.室温下温育5min,用荧光分光光度计(F-4500,日本Hitachi公司生产)检测.激发波长为280nm,激发和发射狭缝均为5nm,扫描速度为1 200nm/min.
1.2.7 羟基自由基清除实验
羟基自由基清除实验参照Hara等[18]的方法并做出适当调整.配制200μL样品溶液:体积分数为10%的PBS(pH=7.4)、4.6μmol/LCuCl2、10mmol/Lcoumarin-3-carboxylicacid(购自Sigma)、1μmol/Ldesferrioxamine(购自Sigma)、300μmol/L抗坏血酸钠以及不同浓度的GmASR或BSA蛋白.加入抗坏血酸钠使该体系产生羟基自由基并产生荧光(395nm激发光,452nm发射光),用全波长酶标仪(日本Thermo公司生产)监测30min.
2 实验结果及分析
2.1 Cu2+胁迫不同时间大豆幼苗中GmASR基因相对表达量的变化
大豆幼苗在含150 μmol/L CuSO4的营养液中培养,利用实时荧光定量PCR检测Cu2+胁迫下GmASR基因在幼叶和幼根中的相对表达量,结果表明(图1),与0h相比,处理3h时,幼叶中GmASR基因表达水平显著上调;处理6h和12h时,该基因相对表达量下降;处理24h后,该基因的表达再次升高;而处理至72h时,其表达水平达到最高,如图1(a).在幼根中GmASR基因的表达趋势与叶中十分相似,只是在胁迫48h时,该基因表达水平达最高,在72h时略有下降,如图1(b).
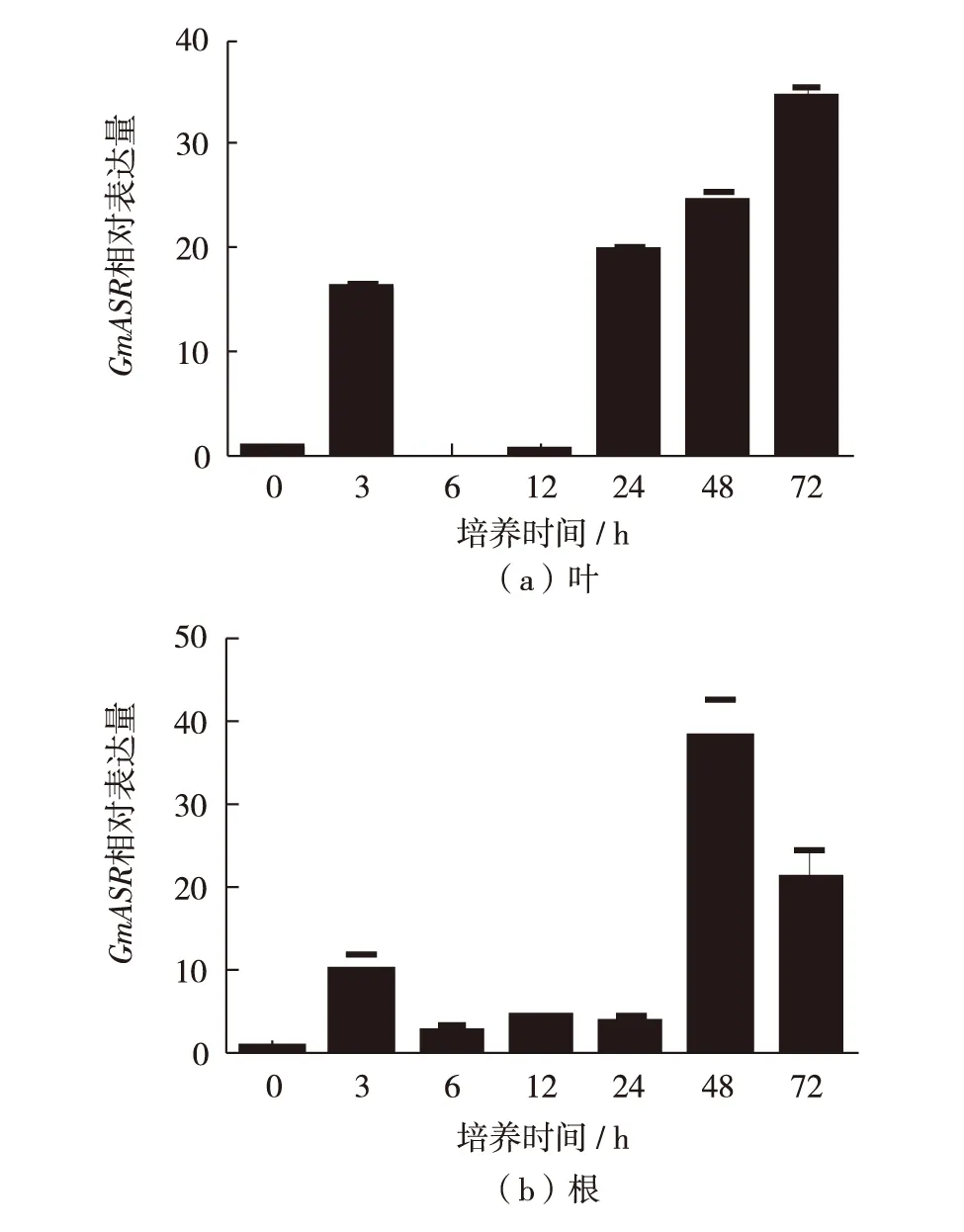
图1 GmASR基因在叶和根中的相对表达量Fig.1 Relative expression of GmASR gene in leaves and roots
2.2 GmASR蛋白表达提高Cu2+敏感酵母突变体(ΔCUP2)对Cu2+胁迫的耐受力
将空载体和含大豆GmASR基因的载体转化Cu2+敏感型酵母ΔCUP2.再将获得的对照菌ΔCUP2/pYES2和重组菌ΔCUP2/GmASR分别接入正常培养基和含100μmol/LCuCl2的液体培养基中.间隔一定时间后测定酵母细胞的D(600)值.从图2(a)生长曲线可知,在无Cu2+培养基中,对照菌和转基因重组菌生长速率十分接近,表明大豆GmASR蛋白的过表达对重组菌的生长无明显影响.图2(b)则显示在含Cu2+培养基中,在0~18h期间对照菌与转基因重组菌的生长速率基本一致;在24~36h,转基因重组菌的生长速率比对照菌快,差异达极显著(P<0.01). 可见,GmASR蛋白表达使Cu2+敏感酵母突变体(ΔCUP2)对Cu2+胁迫的耐受力得到提高.

图2 对照菌ΔCUP2/pYES2和重组菌ΔCUP2/GmASR的生长曲线Fig.2 Growth curves of ΔCUP2/pYES2 and ΔCUP2/GmASR
2.3 GmASR蛋白表达可提高转基因烟草悬浮细胞对Cu2+胁迫的耐受力
将空载体和含GmASR基因的植物表达载体转化烟草悬浮细胞BY-2,获得转空载体的对照BY/1300(contrastcheck,CK)和3个转基因烟草细胞系BY/GmASR(T1、T2和T3),提取RNA,反转录获得cDNA.以cDNA为模板,用GmASR-F和GmASR-R为引物(表1)进行PCR验证.从琼脂糖电泳可以看出,对照组CK不能扩增出特异条带,而3个转基因烟草细胞系T1、T2和T3均可扩增出700碱基对(basepair,bp)左右的特异性条带,如图3(a),表明GmASR基因已转入烟草细胞中,并得到了表达.
将对照组CK及转基因烟草悬浮细胞BY/GmASR(T1、T2和T3)分别涂布在正常固体培养基及含50μmol/LCuSO4的胁迫培养基上.培养15d后,在正常培养基上对照和转基因细胞系生长状况接近.但在含Cu2+的培养基上,转基因烟草细胞愈伤组织体积明显大于对照细胞(图3(b)),说明GmASR蛋白表达提高转基因烟草细胞对Cu2+胁迫的耐受力.

图3 GmASR基因表达可提高转基因烟草细胞BY-2抗 Cu2+胁迫的能力Fig.3 Expression of GmASR gene in transgenic tobacco BY-2 cells under copper stress
2.4 GmASR蛋白具有Cu2+结合的抗氧化能力
将pET28a/GmASR载体转化BL21star菌,加入异丙基-β-D硫代半乳糖苷(isopropyl-β-D-thiogaloctopyranoside,IPTG)诱导GmASR蛋白的表达,并利用His亲和层析分离纯化GmASR蛋白.将固相金属螯合亲和层析柱HiTrapchelatingHP螯合Cu2+,再加入GmASR蛋白.先用EQ缓冲液(equilibrationbuffer)洗脱未结合的蛋白,再利用乙二胺四乙酸(eathylenediaminetetraaceticacid,EDTA)将金属离子从HiTrap柱上洗脱下来.取样进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodiumdodecylsulfatepolyacrylamidegelelectrophoresis,SDS-PAGE),结果如图4(a).以牛血清白蛋白(bovineserumalbumin,BSA)作为阳性对照,以未加金属离子的作为阴性对照.结果显示,在EDTA洗脱的样品中可发现GmASR蛋白,表明GmASR蛋白能与Cu2+结合.

图4 GmASR 蛋白与Cu2+的结合及其清除羟基自由基活性的能力Fig.4 Cu2+ binding and hydroxyl radicals scavenging activity of GmASR protein
蛋白质的内源荧光主要是由Trp和Tyr残基产生.蛋白质与金属离子结合后常引起蛋白内源荧光的淬灭效应.图4(b)表明,在280nm光激发下,GmASR蛋白的荧光最大发射峰出现在310nm附近.随着GmASR蛋白溶液中Cu2+浓度的增加,最大荧光发射峰位未发生位移,荧光强度逐渐降低,即出现了猝灭效应,表明GmASR蛋白与Cu2+间存在相互作用,或者说Cu2+使GmASR蛋白的荧光生色团的微环境和分子构象发生了改变.
参照Hara等[18]的方法,检测GmASR蛋白是否可以减少由Cu2+产生的羟基自由基.羟基自由基的清除能力通过半数抑制浓度(inhibitoryconcentration50%,IC50)来表示,并以羟基自由基清除剂BSA为阳性对照,结果见图4(c).由图4(c)可见,GmASR蛋白具有清除羟基自由基的能力,其IC50=0.65μmol/L,GmASR蛋白的抗氧化能力比与BSA要好,且差异达极显著(P<0.01).
3 讨 论
现代冶炼、金属加工、机器制造及其他工业废水中都含有铜,其中,以金属加工和电镀工厂所排废水含铜量最高.这种废水排入水体,会影响水和土壤的质量.Cu2+影响植物生长和发育.植物受到Cu2+胁迫时,会表达多种蛋白质用于减轻胁迫带来的细胞伤害,ASR蛋白是其中重要的一类植物保护性蛋白.本研究结果证明,在Cu2+胁迫过程中,幼苗的叶片和根部GmASR基因的表达量在胁迫3h和24h(或48h)出现2次峰值,表明大豆GmASR基因对Cu2+胁迫存在快速应答和慢速应答.快速应答是植物对周围环境变化的应激性反应,而慢速应答是植物在较长时间胁迫下产生的适应性反应,即胁迫耐受性[19].GmASR基因的表达受到Cu2+胁迫的诱导,说明它可能与植物的抗Cu2+胁迫有关.而转基因实验也证明,GmASR基因的过表达确实能提高重组酵母和转基因烟草细胞的抗Cu2+能力.
非生物胁迫可以在生理水平和代谢水平上对植物造成影响,如细胞膜稳定性降低、水分丧失、离子平衡失调和离子毒害等,其中,金属(Cu、Fe、Cd和Pb等)离子浓度的升高可以催化活性氧物质(reactiveoxygenspecies,ROS)的产生,继而对细胞造成氧化伤害[20].已有研究结果证明蛋白质序列中的组氨酸可结合金属离子,减轻对细胞的氧化伤害.大豆GmPM1和GmPM9蛋白(LEA4)以及柑橘CuCOR19蛋白(LEA2),可通过其序列中的组氨酸结合Fe3+、Cu2+、Ni2+和Zn2+等金属离子,具有清除羟自由基和过氧自由基的功能[21-22].Hara等[18]也证明拟南芥中的AtHIRD11蛋白(LEA2)能减少由Cu2+产生的ROS,并且组氨酸是ROS清除的重要氨基酸.大豆GmASR蛋白含有高比例(9.8%)的组氨酸.文献[15]的研究已证明,GmASR蛋白可以与Fe3+结合,并降低Fe3+催化的羟基自由基.本研究用体外实验证明,GmASR蛋白可直接与Cu2+结合.推测植物受到Cu2+胁迫时,表达的GmASR可螯合细胞内高浓度的Cu2+,减轻Cu2+的毒害作用,降低ROS引起的氧化伤害.因此,利用植物表达ASR蛋白在治理环境中Cu2+污染可能有潜在应用前景.
利用酵母突变体及功能互补实验,可准确地鉴定基因的功能.本实验利用的是Cu2+敏感型酵母ΔCUP2,CUP2基因是Cu2+可诱导的转录因子,当酵母细胞的CUP2基因发生突变后,不能启动下游的Cu2+结合蛋白CUP1的表达,造成细胞内Cu2+积累过多,对细胞产生毒害[23].本研究构建了可表达大豆GmASR蛋白的酵母载体,转化Cu2+敏感型酵母ΔCUP2,证明GmASR蛋白的表达可以提高酵母突变体耐Cu2+胁迫的能力,即对Cu2+敏感型酵母细胞中CUP2基因的缺失起到了补偿效应.这一结果进一步支持了前述“ASR蛋白可通过结合Cu2+,参与植株对Cu2+胁迫的耐受性”的结论.
结 语
研究了大豆GmASR基因的表达能提高转基因重组型酵母和烟草细胞对Cu2+胁迫的耐受力.实时荧光定量PCR结果表明,Cu2+可以诱导大豆幼苗内GmASR基因的表达.体外实验固相金属螯合亲和层析和内源荧光法证明GmASR蛋白可直接螯合Cu2+,羟基自由基清除实验证明GmASR蛋白具有抗氧化能力,植物细胞中的ASR蛋白可以通过螯合多余的金属离子,起到保护植物细胞的作用.
/ References:
[1] Gonzalez R M, Iusem N D.Twenty years of research onAsr(ABA-stress-ripening)genesandproteins[J].Planta, 2014, 239(5):941-949.
[2]CarrariF,FernieAR,IusemND.Hearditthroughthegrapevine?ABAandsugarcross-talk:theASRstory[J].TrendsinPlantScience, 2004, 9(2):57-59.
[3]BattagliaM,OlveraCY,GarciarrubioA,etal.TheenigmaticLEAproteinsandotherhydrophilins[J].PlantPhysiology, 2008, 148(1):6-24.
[4]ChenJianye,LiuDujuan,JiangYueming,etal.MolecularcharacterizationofastrawberryFaASRgeneinrelationtofruitripening[J].PLoSOne, 2011, 6(9):e24649.
[5]BovyA,VosRD,KemperM,etal.High-flavonoltomatoesresultingfromtheheterologousexpressionofthemaizetranscriptionfactorgenesLCandC1[J].ThePlantCell, 2002, 14(10):2509-2526.
[6]HenryIM,CarpentierSC,PampurovaS,etal.StructureandregulationoftheAsrgenefamilyinbanana[J].Planta, 2011, 234(4):785-798.
[7]MaskinL,MaldonadoS,IusemND.Tomatoleafspatialexpressionofstress-inducedAsrgenes[J].MolecularBiologyReports, 2008, 35(4):501-505.
[8]ArenhartRA,MargisR,MargisPM.ThericeASR5protein:aputativeroleintheresponsetoaluminumphotosynthesisdisturbance[J].PlantSignaling&Behavior, 2012, 7(10):1263-1266.
[9]LiuHaiyan,DaiJinran,FengDongru,etal.Characteri-zationofanovelPlantainAsrgene,MpAsr,thatisregulatedinresponsetoinfectionofFusariumoxysporumf. sp.cubenseandabioticstresses[J].JournalofIntegrativePlantBiology, 2010, 52(3):315-323.
[10]YangChinyin,ChenYuchuan,JauhGuangyuh,etal.AlilyASRproteininvolvesabscisicacidsignalingandconfersdroughtandsaltresistanceinArabidopsis[J].PlantPhysiology, 2005, 139(2):836-846.
[11]KalifaY,PerlsonE,GiladA,etal.Overexpressionofthewaterandsaltstress-regulatedAsr1geneconfersanincreasedsalttolerance[J].Plant,Cell&Environment, 2004, 27(12):1459-1468.
[12]KonradZ,BarZD.Synergismbetweenthechaperone-likeactivityofthestressregulatedASR1proteinandtheosmolyteglycine-betaine[J].Planta, 2008, 227(6):1213-1219.
[13]KalifaY,GiladA,KonradZ,etal.Thewater-andsalt-stress-regulatedAsr1(abscisicacidstressripening)geneencodesazinc-dependentDNA-bindingprotein[J].BiochemicalJournal, 2004, 381:373-378.
[14]XingWei,HuangWenmin,LiuGuihua.EffectofexcessironandcopperonphysiologyofaquaticplantSpirodelapolyrrhiza(L.)Schleid[J].EnvironmentalToxicology, 2010, 25(2):103-112.
[15]LiRanhui,LiuGuobao,WangHui,etal.EffectsofFe3+andZn2+onthestructuralandthermodynamicpropertiesofasoybeanASRProtein[J].Bioscience,BiotechnologyandBiochemistry, 2014, 77(3):475-481.
[16]MoBeixin,YeHao,OuZhonghua,etal.Stress-inducedprocessingbodyformationintobaccosuspensioncells[J].JournalofShenzhenUniversityScienceandEngineering, 2012, 29(1):80-84.(inChinese) 莫蓓莘,叶 浩,欧忠华,等.逆境诱导烟草悬浮细胞内处理小体的形成[J].深圳大学学报理工版,2012,29(1):80-84.
[17]HaraM,FujinagaM,KuboiT.Metalbindingbycitrusdehydrinwithhistidine-richdomains[J].JournalofExperimentalBotany, 2005, 56(420):2695-2703.
[18]HaraM,KondoM,KatoT.AKS-typedehydrinanditsrelateddomainsreduceCu-promotedradicalgenerationandthehistidineresiduescontributetotheradical-reducingactivities[J].JournalofExperimentalBotany, 2013, 64(6):1615-1624.
[19]FinkelsteinR.Abscisicacidbiosynthesisandresponse[J].TheArabidopsisBook/AmericanSocietyofPlantBiologists, 2013,11:e0166.
[20]MayoJC,TanDX,SainzRM,etal.Protectionagainstoxidativeproteindamageinducedbymetal-catalyzedreactionoralkylperoxylradicals:comparativeeffectsofmelatoninandotherantioxidants[J].BiochimicaetBiophysicaActa(BBA)-GeneralSubjects, 2003,1620(1/2/3):139-150.
[21]LiuGuobao,XuHong,ZhangLiang,etal.Febindingpropertiesoftwosoybean(GlycinemaxL.)LEA4proteinsassociatedwithantioxidantactivity[J].PlantandCellPhysiology, 2011, 52(6):994-1002.
[22]HaraM,FujinagaM,KuboiT.Radicalscavengingactivityandoxidativemodificationofcitrusdehydrin[J].PlantPhysiologyandBiochemistry, 2004, 42(7/8):657-662.
[23]WelchJ,FogelS,BuchmanC,etal.TheCUP2geneproductregulatestheexpressionoftheCUP1gene,codingforyeastmetallothionein[J].TheEMBOJournal, 1989, 8(1):255-260.
【中文责编:晨 兮;英文责编:艾 琳】
Expression ofASRgene confers copper tolerance to yeast mutant and transgenic tobacco BY-2 cells
Gao Yang, Liu Guobao, Liu Ke, Li Ranhui, and Zheng Yizhi†
Shenzhen Key Laboratory of Microbiology and Gene Engineering, College of Life Science,Shenzhen University, Shenzhen 518060, P.R.China
Expression analysis by quantitative real-time polymerase chain reaction (PCR) shows thatGmASRisidentifiedwithincreasedexpressionintherootsandleavesofsoybeanseedlingsunder150μmol/LCuSO4stressfor3h.TheGmASRgeneisintroducedintoCu2+sensitiveyeastΔCUP2andtobaccosuspensionBY-2cells,andwefindthatexpressionofGmASRproteincouldimprovecoppertoleranceoftherecombinantyeastmutantandtransgenictobaccoBY-2cells.GmASRproteinisinduced,separatedandpurifiedbyusingtherecombinantE.Coli.ItisconfirmedthattheGmASRproteincanbindCu2+andalsoinhibithydroxylradicalgenerationinvitro.WecanspeculatethattheGmASRproteinwouldenhancetheplanttoleranceofcopperstressbychelatingCu2+,reducingintracellularCu2+concentrationandoxidantdamage.
plant genetic engineering;GmASRgene;transgenictobaccoBY-2cells;recombinantmutantyeast;metalionstresstolerance;metal-bindingprotein
:Gao Yang, Liu Guobao, Liu Ke, et al. Expression ofASRgene confers copper tolerance to yeast mutant and transgenic tobacco BY-2 cells[J]. Journal of Shenzhen University Science and Engineering, 2015, 32(2): 137-144.(in Chinese)
Q943.2;Q
A
10.3724/SP.J.1249.2015.02137
国家自然科学基金资助项目(31370289);深圳市科技创新委资助项目(JCYJ20120614085333654)
高 阳(1989—),女(汉族),湖北省孝感市人,深圳大学硕士研究生.E-mail:gaoy822@163.com
Received:2014-12-26;Accepted:2015-01-30
Foundation:National Natural Science Foundation of China (31370289);Science and Technology Project of Shenzhen(JCYJ20120614085333654)
† Corresponding author:Professor Zheng Yizhi.E-mail:yzzheng@szu.edu.cn
引 文:高 阳,刘国宝,刘 科,等. 大豆ASR表达提高酵母和烟草细胞对Cu2+耐受力[J]. 深圳大学学报理工版,2015,32(2):137-144.

