Ag85B调节小鼠髓样树突状细胞的成熟和TSLP介导下TSLPR和OX40L的表达*
钱 江,吴 健,安 弘,房祥峰,李东风,杨士芳,孟锦绣,高兴林(南方医科大学研究生院,广东广州5055;广东省人民医院,广东省医学科学院,广东省老年医学研究所呼吸内科,医学研究中心,广东广州50080)
Ag85B调节小鼠髓样树突状细胞的成熟和TSLP介导下TSLPR和OX40L的表达*
钱江1,2,吴健2△,安弘1,2,房祥峰1,2,李东风3,杨士芳2,孟锦绣3,高兴林2
(1南方医科大学研究生院,广东广州510515;广东省人民医院,广东省医学科学院,广东省老年医学研究所2呼吸内科,3医学研究中心,广东广州510080)
[摘要]目的:研究抗原85B(Ag85B)体外诱导小鼠未成熟的髓样树突状细胞(mDCs)的成熟以及对胸腺基质淋巴细胞生成素(TSLP)介导下mDCs表达TSLP受体(TSLPR)和OX40L的影响,探究Ag85B抑制哮喘气道炎症的可能机制。方法:应用重组小鼠GM-CSF和IL-4体外诱生C57BL/6小鼠未成熟的mDCs,并运用免疫磁珠分离的方法纯化,采用光镜和扫描电镜、流式细胞术进行形态学观察和细胞表型鉴定;分别用0、50、100、200 μg/L不同浓度的Ag85B或TSLP作用于纯化并鉴定后的mDCs,培养24 h,流式细胞术检测细胞表面分子CD80、CD86、TSLPR和OX40L的表达,选取最佳的Ag85B或TSLP处理浓度。随后将mDCs随机分为空白对照组、Ag85B处理组、TSLP处理组和Ag85B+ TSLP处理组,培养24 h后检测mDCs的促炎表面分子TSLPR和OX40L的表达。结果:体外诱导培养7 d,倒置相差显微镜下可见细胞表面呈现不规则树突样突起,扫描电镜下见细胞类圆形,表面有少量皱褶和较少分叉的树突状突起,符合未成熟mDCs的形态学特点;纯化后的mDCs表达表面分子CD11c的细胞较表达共刺激分子CD80和CD86的细胞多,符合未成熟mDCs的表型特征。与空白对照组比较,50~200 μg/L的Ag85B处理组mDCs表达CD80和CD86的细胞比率显著增高(P<0.05),表达TSLPR和OX40L的细胞比率无显著差异。与空白对照组相比较,50、100和200 μg/L浓度的TSLP处理组的mDCs表达CD80和CD86的细胞比率均显著增加(P<0.05) ;与空白对照组和50 μg/L TSLP处理组相比较,100 μg/L和200 μg/L TSLP处理组的mDCs表达TSLPR和OX40L的细胞比率均显著升高(P<0.05)。选取200 μg/L作为Ag85B和TSLP的优化作用浓度,结果发现Ag85B处理组和Ag85B+ TSLP处理组的mDCs表达TSLPR和OX40L的细胞比率较TSLP处理组均显著降低(P <0.05),与空白对照组比较差异不显著。结论: Ag85B可通过上调mDCs表达共刺激分子CD80和CD86促进其成熟,同时下调TSLP介导的mDCs表达促炎表面分子TSLPR和OX40L,推测Ag85B可能通过TSLP介导的mDCs途径抑制气道炎症。
[关键词]抗原85B;胸腺基质淋巴细胞生成素;髓样树突状细胞;胸腺基质淋巴细胞生成素受体; OX40L
[修回日期]2015-07-14
树突状细胞(dendritic cells,DCs)分为两类:髓样树突状细胞(myeloid dendritic cells,mDCs),由骨髓中的髓样前体细胞分化而来,表达特异性的标记物CD11c;浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs),由骨髓中的淋巴样祖细胞分化而来,主要表达CD4、CD123和CD68等,而缺乏CD11c[1]。CD4+T细胞的增殖活化需要来自抗原提呈细胞(antigen presenting cell,APC)的两个刺激信号才能被激活发挥功能,一类由T淋巴细胞受体与APC主要组织相容性复合物-抗原肽复合体相互作用产生的第一信号(识别信号),另一类由APC表面的共刺激分子与T细胞表面对应受体相结合产生的第二信号(共刺激信号)。研究表明,除了B7(CD80 和CD86) -CTLA4/CD28和CD40-CD40L两对共刺激分子外,OX40及其配体OX40L在T细胞初次和再次免疫应答中亦发挥重要作用[2]。
mDCs是机体重要的专职抗原提呈细胞,参与哮喘发病的整个过程[3]。辅助性T淋巴细胞(helper T lymphocytes,Th)功能亢进、Th1/Th2比例失衡是哮喘气道炎症的主要发病机制[4],另外,气道上皮细胞应激和损伤可触发趋化因子和生长因子的释放,两者均参与气道的慢性炎症和结构重塑,其中胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)及TSLP受体(thymic stromal lymphopoietin receptor,TSLPR)信号通路从中发挥重要的作用[5]。气道上皮细胞在过敏原、病毒、物理损伤等刺激下可分泌大量的TSLP,TSLP作用于mDCs表面的TSLPR促进其成熟与活化,活化后的mDCs通过上调表达OX40L与初始CD4+T细胞表面的OX40相互作用促进其向Th2分化,最终导致哮喘气道Th2型炎症反应[6]。
结核分枝杆菌抗原85B(antigen 85B,Ag85B)是分支杆菌属或卡介苗(bacille calmette guerin,BCG)分泌的最主要的抗原蛋白。在人和小鼠体内,Ag85B可明显促进初始CD4+T细胞向Th1分化,诱导机体产生抗结核的保护性Th1型免疫反应[7]。本课题组前期小鼠哮喘模型或哮喘患者体外实验发现,Ag85B DNA疫苗能增强Th1型免疫反应,抑制Th2型免疫反应,从而抑制哮喘气道炎症[8-9],Ag85B慢病毒转染正常人气道上皮细胞可抑制其表达TSLP和TSLPR[10]。但Ag85B如何调控哮喘的作用机制仍不清楚,推测Ag85B可能通过抑制气道上皮细胞释放TSLP和改变起抗原提呈作用的树突状细胞的功能来调控哮喘Th2为主的气道炎症。
本研究首先体外诱导小鼠骨髓前体细胞分化为未成熟mDCs,并将经免疫磁珠法纯化后、倒置相差显微镜和电镜形态证实以及流式细胞进一步鉴定的mDCs作为研究靶细胞,运用mDCs与Ag85B和TSLP共培养体系,以mDCs表面分子CD80和CD86、TSLPR和OX40L为研究切入点,探讨Ag85B诱导mDCs的成熟以及对TSLP介导下的mDCs表达促炎表面分子TSLPR和OX40L的调节作用,研究Ag85B抑制哮喘气道炎症的分子调控机制。
材料和方法
1实验动物
SPF级健康C57BL/6雌性小鼠,6~8周龄,20~25 g,均购自广东省实验动物中心,许可证号为SCXK(粤) 2013-0002。
2实验主要器材和试剂
超净工作台(苏州安泰公司) ; CO2细胞培养箱、离心机、酶标仪、自动洗板机(Thermo) ;磁珠纯化仪(MiniMACS) ;流式细胞仪(BD) ;倒置相差显微镜(Nikon) ;扫描电镜(Olympus)。
6孔培养板、RPMI-1640培养基(Corning) ;胎牛血清(Gibco) ;红细胞裂解液(康为世纪) ;重组小鼠细胞因子rmIL-4、rmGM-CSF、抗小鼠流式抗体PEOX40L、APC-TSLPR、重组鼠TSLP蛋白(R&D) ;小鼠CD11c磁珠抗体(MiniMACS) ; Ag85B蛋白(RayBiotech) ;抗小鼠流式抗体PE-CD11c、CD80、FITC-CD86 (eBioscience)。
3小鼠mDCs诱导培养和分离纯化[11]
3.1小鼠mDCs的诱导培养处死小鼠,无菌分离股骨和胫骨,暴露骨髓腔,用RPMI-1640冲洗骨髓腔3~4次,将骨髓冲至50 mL离心管中,反复吹打均匀骨髓组织成细胞悬液,1 500 r/min离心10 min;去上清液,加入红细胞裂解液和生理盐水,离心后细胞沉淀用RPMI-1640冲洗2遍,1 000 r/min离心10 min后收集细胞。50 mL RPMI-1640完全培养液(含RPMI-1640、100 U青霉素、100 mg/L链霉素、10%胎牛血清、10 μg/L rmGM-SCF和10 μg/L rmIL-4)重悬收集的细胞,以2×106的浓度接种至6孔培养板,每孔2 mL,37℃、5% CO2恒温培养3 d,全量换液,除去未贴壁的淋巴细胞和细胞碎片,并补足细胞因子;以后隔天半量换液,培养至第7天后,轻轻吹打培养皿,收获半悬浮细胞和疏松贴壁细胞待纯化和鉴定。3.2小鼠mDCs的纯化按磁珠抗体说明书操作步骤进行。收集第7天的mDCs,按每108个细胞加入100 μL CD11c磁珠抗体,混匀4℃孵育15 min; 1 200 r/min离心10 min弃上清液,每108个细胞加入500 μL缓冲液重悬细胞;将重悬的细胞加入磁珠分选柱中,500 μL缓冲液洗涤分选柱3次,收集流下的未标记细胞,最后向分选柱中加1 mL缓冲液,下压活塞,收集标记的阳性细胞。
4小鼠mDCs的形态学观察和鉴定
4.1倒置相差显微镜观察分别于培养48 h、第3、5、7天,显微镜下观察细胞形态变化。
4.2扫描电镜观察取培养第7天的mDCs,于多聚赖氨酸包被的细胞爬片上用2.5%戊二醛内固定2 h,再依次乙醇梯度脱水、纯丙酮置换乙醇、醋酸异戊酯置换丙酮,最后CO2临界干燥、镀膜、观察。
4.3小鼠mDCs的流式细胞术鉴定分别收集培养第3、5、7天和纯化后的mDCs,用PBS洗涤2次,重悬细胞为(1~2)×106,再用PBS洗涤3次,按使用说明书加入适宜工作浓度的抗小鼠树突状细胞表面分子的荧光抗体: PE-CD11c、CD80和FITC-CD86,避光4℃作用30 min,PBS洗涤3次,以荧光标记的同型IgG作为对照,上机检测CD11c、CD80和CD86的表达情况。
5 Ag85B和TSLP对小鼠mDCs表达共刺激分子CD80、CD86、OX40L和TSLPR的作用
为选择适宜的Ag85B或TSLP的作用浓度,分别按0(空白对照组)、50、100以及200 μg/L的浓度处理纯化鉴定后的mDCs,培养24 h,流式细胞术检测mDCs表面CD80、CD86、OX40L和TSLPR的表达情况。
6 Ag85B对TSLP介导的mDCs表达TSLPR和OX40L的影响
选择200 μg/L作为Ag85B和TSLP优化处理浓度,将纯化后的mDCs分为空白对照组、Ag85B处理组、TSLP处理组以及Ag85B+ TSLP处理组,培养24 h,流式细胞术检测mDCs表面TSLPR和OX40L的表达。
7统计学处理
用SPSS 20.0统计软件进行统计学分析。实验数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用q检验进行多重比较。以P<0.05为差异有统计学意义。
结果
1小鼠mDCs的形态特点
倒置相差显微镜观察可见,培养48 h,培养液中充满了大量的骨髓原始细胞,多悬浮,部分贴壁;第3天贴壁细胞明显增加,可见明显细胞集落形成;第5天细胞集落逐渐悬浮,并可见细胞从集落边缘分离; 第7天悬浮细胞大量增多,可见细胞突起,见图1。扫描电镜观察可见细胞呈类圆形,表面粗糙,有少量皱褶和分叉的树突状突起,突起长度短,较纤细,符合典型的mDCs的形态特征,见图2。
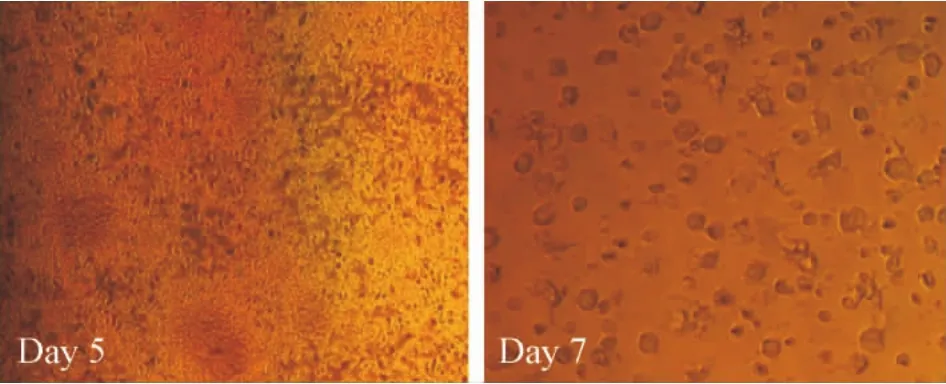
Figure 1.Morphological characteristic of mouse mDCs at day 5 (×200) and day 7(×400).图1培养第5天和第7天小鼠mDCs的形态学特征
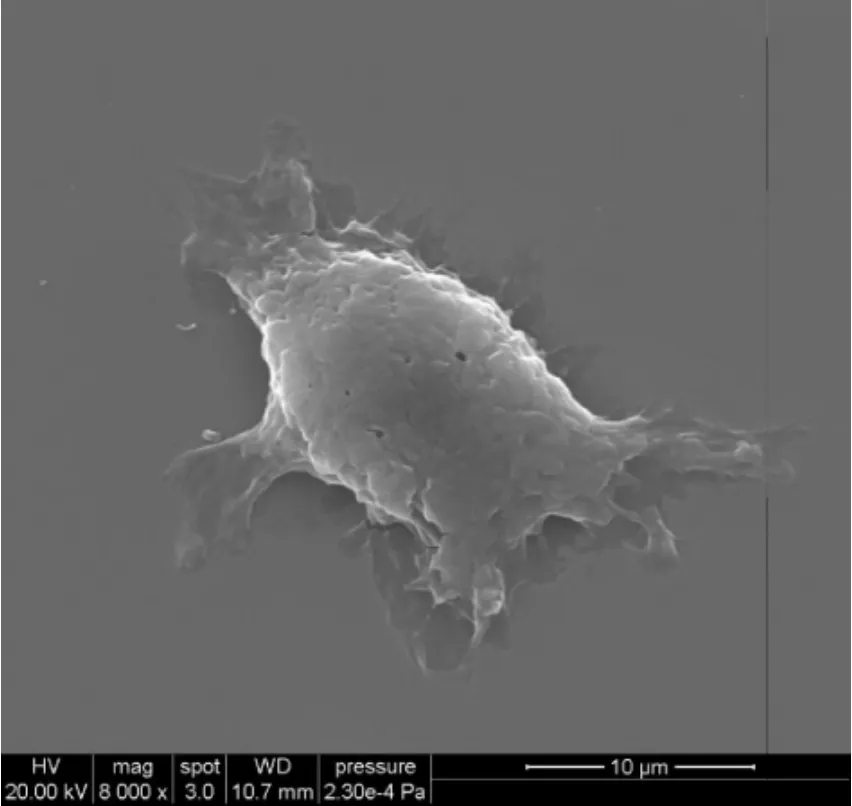
Figure 2.The morphology of mouse mDCs under scanning electronic microscope at day 7.图2培养第7天小鼠mDCs扫描电镜下的形态学特征
2小鼠mDCs的流式细胞术鉴定
未纯化前,体外培养第7天,CD11c+、CD80+、CD86+细胞表达比率均较第3天显著增加(P<0.05),第5天CD11c+、CD80+细胞表达比率均较第3天显著增加(P<0.05)。结果显示随着培养时间的延长,CD80+和CD86+细胞表达量虽然有所增加,但不如CD11c+细胞表达比率增加明显,说明骨髓前体细胞逐渐向mDCs分化和增殖,处于高表达CD11c、低表达CD80和CD86的状态。将培养第7天的细胞经磁珠纯化,富集后的CD11c+细胞表达比率为(90.78±5.79) %较未纯化前的(65.60± 1.66) %显著增高,前者是后者的1.4倍(P<0.05),而纯化前后mDCs表达CD80、CD86的细胞比率相似,说明纯化后的mDCs进一步高表达CD11c,低表达CD80、CD86,此结果与文献报道的未成熟mDCs表型一致,见表1。
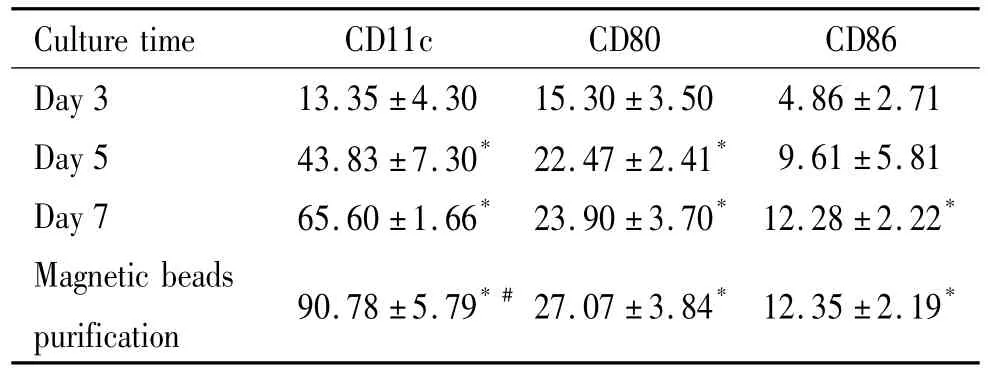
表1 不同培养时间小鼠mDCs特异性标记物和共刺激分子的表达水平Table 1.The expression levels of specific marker and costimulatory molecules on the surface of mouse mDCs during different culture times (%.Mean±SD.n=5)
3Ag85B和TSLP对小鼠mDCs表达CD80、CD86、OX40L和TSLPR的作用
3.1Ag85B对mDCs表达共刺激分子CD80和CD86的作用50~200 μg/L的Ag85B刺激后,mDCs表达共刺激分子CD80和CD86的细胞比率均较空白对照组明显增高(P<0.05),Ag85B的不同浓度处理组间CD80+细胞表达比率相似,无浓度依赖性变化。高浓度Ag85B(200 μg/L)处理组的CD86+细胞表达比率是低浓度(50 μg/L)处理组的1.5倍,差异显著(P<0.05),CD86+细胞的表达比率显示浓度依赖性增高的特点,见表2。表明Ag85B具有上调mDCs表面共刺激分子CD80、CD86的表达,促进mDCs成熟的作用。
3.2Ag85B对mDCs表达促炎表面分子TSLPR和OX40L的作用空白对照组和各浓度Ag85B处理组间TSLPR+和OX40L+细胞表达比率无统计学差异,见表2,表明单一的Ag85B刺激对mDCs促炎表面分子TSLPR和OX40L的表达无明显作用。
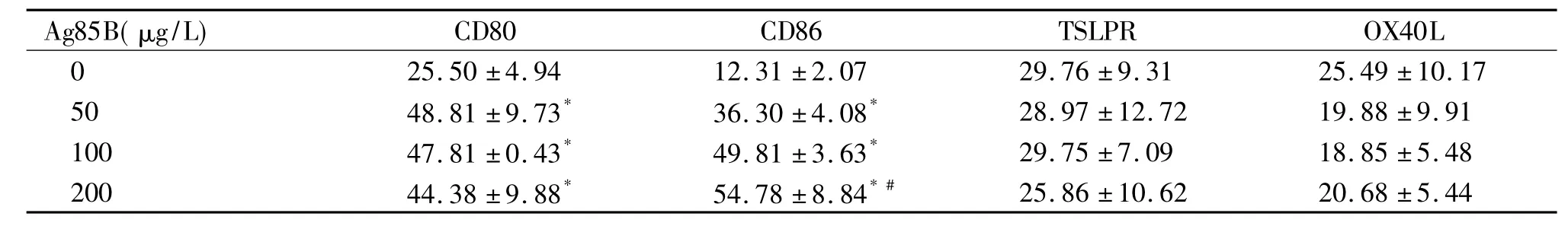
表2 不同浓度Ag85B对小鼠mDCs的CD80、CD86、TSLPR和OX40L表达的影响Table 2.The effects of different concentrations of Ag85B on the expression of CD80,CD86,TSLPR and OX40L in the mouse mDCs (%.Mean±SD.n=3)
3.3TSLP对mDCs表达共刺激分子CD80和CD86的作用与空白对照组比较,50~200 μg/L的TSLP均可以上调mDCs的共刺激分子CD80和CD86的表达比率(P<0.05),TSLP(200 μg/L)处理组CD80+细胞表达比率明显高于其它2种浓度处理组(P<0.05),显示出一定程度的浓度依赖性,但各处理组间CD86+细胞表达比率差异不显著,无浓度依赖性变化,见表3,这表明TSLP具有上调mDCs表面共刺激分子CD80、CD86的表达,促进mDCs成熟的作用。
3.4TSLP对mDCs表达促炎表面分子TSLPR和 OX40L的作用与空白对照组和TSLP(50 μg/L)处理组相比较,100 μg/L和200 μg/L的TSLP处理组的TSLPR+和OX40L+细胞表达比率均增高1倍左右,差异显著(P<0.05),而100 μg/L、200 μg/L两处理组间TSLPR+和OX40L+细胞表达比率相似,见表3。这表明TSLP可以促进mDCs促炎表面分子TSLPR和OX40L的表达,较低浓度时表达量随着TSLP浓度递增而增高,达100 μg/L浓度后不进一步增高。

表3 不同浓度TSLP对小鼠mDCs的CD80、CD86、TSLPR和OX40L表达的影响Table 3.The effects of different concentrations of TSLP on the expression of CD80,CD86,TSLPR and OX40L in the mouse mDCs (%.Mean±SD.n=3)
4 Ag85B对TSLP介导下的mDCs表达促炎表面分子TSLPR和OX40L的影响
选择200 μg/L作为Ag85B和TSLP的优化处理浓度,观察Ag85B、TSLP、Ag85B+ TSLP处理组及空白对照组的mDCs的促炎表面分子TSLPR和OX40L表达比率。TSLP组的TSLPR+和OX40L+细胞表达比率分别是(36.52±13.30) %和(43.96±4.60) %,显著高于空白对照组,分别是空白对照组的2.1倍和2.8倍(P<0.05)。Ag85B处理组、Ag85B+ TSLP处理组的TSLPR+和OX40L+细胞表达比率显著低于TSLP组(P<0.05),并与空白对照组的阳性表达比率相似。结果表明Ag85B可能对TSLP介导的mDCs表达促炎表面分子TSLPR和OX40L具有抑制作用,见图3、表4。
讨论
目前体外诱导DCs扩增多采用联合细胞因子刺激树突状细胞前体细胞增殖的方法,前体细胞主要来自骨髓、脐带血等,GM-CSF和IL-4是最常用的联合细胞因子,在DCs的体外扩增中发挥重要作用。GM-CSF是DCs体外扩增最重要的细胞因子,它不仅能诱导前体细胞形成集落向树突状细胞分化,而且能够延长树突状细胞的寿命。IL-4能抑制培养细胞中中性粒细胞和巨噬细胞的产生,并维持DCs处于未成熟状态。因此,GM-CSF联合IL-4共同刺激骨髓前体细胞,可以使其在体外定向诱导成mDCs,既提高细胞产量,又保持细胞处于未成熟的特点。本研究参照文献报道的方法[11],利用rmGM-CSF(10 μg/L)和rmIL-4(10 μg/L)联合细胞因子共同刺激小鼠骨髓前体细胞,进行诱导培养和体外扩增mDCs,再采用免疫磁珠对mDCs进行纯化,进一步增加细胞的纯度。接着,为进一步保证分离纯化的mDCs是未成熟的mDCs,本课题组对纯化后的mDCs进行了形态学和细胞表型的进一步鉴定。扫描电镜下细胞呈类圆形,表面粗糙似云雾状,有少量皱褶和分叉的树突状突起,符合未成熟mDCs的形态特征[12];流式细胞术检测分离纯化的mDCs的细胞表型,发现经过7 d培养,每只小鼠骨髓细胞可获得1~2×107个mDCs,经免疫磁珠纯化后,细胞表达特异性的标记物CD11c的细胞比率高达90%,呈现高水平表达CD11c,低水平表达表面共刺激分子CD80、CD86的特点,与国内外文献报道的未成熟mDCs表型特征一致[13-14]。本实验体外成功诱导出高产量、高纯度的未成熟mDCs,为后续mDCs的免疫、生物功能学研究奠定了实验基础。
研究证实未成熟mDCs具有很强的吞噬、加工处理抗原的能力,表面低表达CD80、CD86等共刺激分子,捕获抗原后,在一些活化因子如脂多糖、TNF-α等作用下可分化为成熟mDCs,其表面共刺激分子的表达也会显著上调[15]。
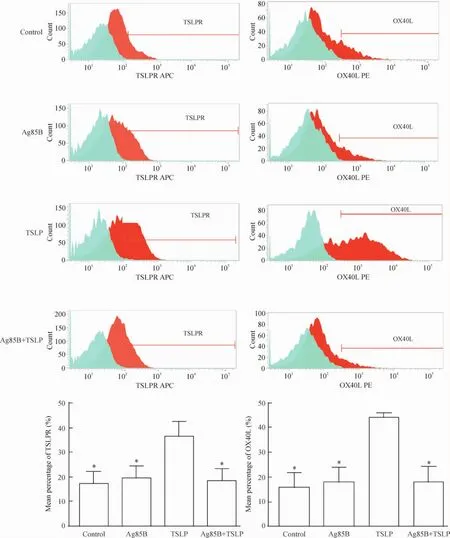
Figure 3.The effects of Ag85B on the expression of OX40L and TSLPR in TSLP-mediated mDCs.Mean±SD.n=5.*P<0.05 vs TSLP group.图3 Ag85B对TSLP介导下mDCs表达TSLPR和OX40L的影响
本研究应用不同梯度浓度的重组鼠TSLP蛋白,探讨优化TSLP作用浓度,从中研究TSLP对鼠源性未成熟mDCs的作用。既往研究证实TSLP介导的mDCs在诱导哮喘Th2型炎症反应中发挥重要作用,首先,TSLP作用于mDCs表面受体TSLPR,可促进其成熟,上调表达CD80和CD86[16];其次,TSLP促进mDCs表面表达OX40L,后者与初始CD4+T细胞表面的OX40相互结合,促使初始CD4+T细胞分化成Th2细胞并分泌Th2型细胞因子,导致哮喘嗜酸性细胞为主的气道炎症和气道高反应[17]。目前,Yokoi等[18]用15 μg/L浓度的TSLP可刺激培养健康人外周血分离出mDCs成熟,未见关于TSLP与鼠源mDCs的相关研究。由于本实验中诱导培养的细胞为鼠源的mDCs,考虑到种属的差异性,故采用相对较高的作用浓度来培养24 h,结果发现50 μg/L、100 μg/L和200 μg/L的TSLP浓度均可以上调mDCs表达CD80和CD86。而进一步的研究发现,较高浓度的TSLP(100 μg/L和200 μg/L)可以上调mDCs表达促炎分子TSLPR和OX40L。这些结果说明TSLP可以通过上调mDCs表面的共刺激分子CD80、CD86表达,促进mDCs进一步成熟。TSLP活化后的mDCs上调表达OX40L,这为mDCs与初始CD4+T细胞表面的OX40相互作用促进后者向Th2分化奠定了基础;同时TSLP还可以促进mDCs表达TSLPR,进一步放大了TSLP对mDCs的成熟和活化的驱动作用。值得注意的是,虽然拥有相同的配体CTLA4/CD28,但CD80和CD86的作用机制却存在差异性,研究表明APC细胞的表面共刺激分子CD80主要刺激初始CD4+T细胞向Th1分化,而CD86刺激初始CD4+T细胞向Th2分化。CD86单克隆抗体可以降低哮喘小鼠Th2型细胞因子水平,升高Th1型细胞因子水平,使失调的Th1/Th2平衡得到纠正[19]。CD80 DNA疫苗可以提高哮喘小鼠的肺泡灌洗液中和脾淋巴细胞Th1/Th2比例,从而抑制哮喘气道炎症[20]。从既往研究和本实验结果看,TSLP既可促进mDCs表达共刺激分子CD80和CD86促进其成熟,又可以促进mDCs表达促炎分子TSLPR和OX40L,提示TSLP可介导mDCs的成熟、活化,并加强了其与下游的初始CD4+T淋巴细胞的炎症级联效应和免疫效应,其作用是通过上调mDCs共刺激信号和表面促炎分子的共同表达,诱导初始CD4+T细胞向Th2分化。

表4 Ag85B对TSLP介导下mDCs表达TSLPR和OX40L的影响Table 4.The effects of Ag85B (200 μg/L) on the expression of TSLPR and OX40L in TSLP (200 μg/L) -mediated mDCs (%.Mean±SD.n=5)
研究发现,BCG对动物实验性哮喘具有预防性治疗作用[21],而Ag85B在哮喘抗炎作用也愈受重视。在小鼠哮喘模型中,不论是采用经鼻滴入或经腹腔注射Ag85B DNA疫苗,还是腹腔注射重组Ag85B,均可抑制哮喘小鼠以嗜酸性粒细胞浸润为主的肺部炎症,并伴随气道Th2型免疫应答下调,Th1型免疫应答上调[9,22-23]。但Ag85B的这种免疫调节作用的具体机制仍不清楚。本课题组前期将Ag85B慢病毒转入正常人气道上皮细胞,发现Ag85B慢病毒感染气道上皮细胞可抑制其表达TSLP和TSLPR[10],故推测Ag85B可能通过调节炎症启动的上游环节如气道上皮细胞或起抗原递呈、处理作用的mDCs,而调控下游炎症主要的效应细胞初始CD4+T细胞的分化。国外有报道称BCG可以上调mDCs表达CD80和CD86促进其成熟[18,24],Ag85B作为BCG最主要分泌的蛋白,也是一种抗原蛋白,因此可能同样具有促进mDCs成熟的功能。本实验为了探讨Ag85B对mDCs作用,采用同选择TSLP对mDCs作用浓度相似的思路摸索Ag85B的作用浓度,结果发现,各浓度的Ag85B也可以上调mDCs表达共刺激分子CD80和CD86,促进mDCs成熟,进一步实验发现,空白对照组和各浓度Ag85B处理组间TSLPR 和OX40L的表达均无统计学差异,表明单一的Ag85B虽然也具有类似TSLP的刺激mDCs表达共刺激分子CD80、CD86的作用,也能促进未成熟mDCs成熟,但单一Ag85B对促炎分子TSLPR和OX40L表达影响甚微,与TSLP促进mDCs表达促炎分子TSLPR和OX40L不同,这提示Ag85B促进的mDCs成熟,不利于Th2免疫反应的发生,无明显加重哮喘的慢性气道炎症过程。
为了探讨Ag85B对TSLP介导下mDCs表达TSLPR和OX40L是否有影响,我们又进一步设计了Ag85B和TSLP联合处理mDCs,结果发现TSLP处理组的mDCs其TSLPR和OX40L的表达明显增高,而Ag85B+ TSLP处理组的mDCs其TSLPR和OX40L的表达明显降低至基本与空白对照组和单独Ag85B处理组相似的水平,结合50~200 μg/L各浓度梯度的单独Ag85B处理组的mDCs其TSLPR和OX40L的表达无显著差异,推测Ag85B具有TSLP依赖性地抑制mDCs表达TSLPR和OX40L的作用,而在无TSLP刺激下,对mDCs表达TSLPR和OX40L的作用甚微,从一定程度上表明Ag85B具有体外抑制炎症介质TSLP介导的、以TSLPR和OX40L为作用靶点的、树突状细胞与下游的CD4+T淋巴细胞共同参与的气道炎症和Th2免疫反应的可能性。
本实验仍存在一定的缺陷和局限性。Ag85B和TSLP的作用浓度为本实验条件下的摸索浓度,不同实验条件下可能存在一定的差异;在本实验中单用流式细胞术检测了TSLPR和OX40L的表达,还可以进一步结合聚合酶链式反应和蛋白免疫印迹法等实验技术来检测TSLPR和OX40L的表达;实验所得出的结论均是基于体外细胞实验的结果,仍需要进一步在动物模型(哮喘模型)中验证。
[参考文献]
[1]van Helden MJ,Lambrecht BN.Dendritic cells in asthma [J].Curr Opin Immunol,2013,25(6) : 745-754.
[2]Watts TH,Debenedette MA.T cell co-stimulatory molecules other than CD28[J].Curr Opin Immunol,1999,11 (3) : 286-293.
[3]Holgate ST.Innate and adaptive immune responses in asthma[J].Nat Med,2012,18(5) : 673-683.
[4]Robinson DS.The role of the T cell in asthma[J].J Allergy Clin Immunol,2010,126(6) : 1081-1091.
[5]Zhou B,Comeau MR,De Smedt T,et al.Thymic stromal lymphopoietin as a key initiator of allergic airway inflammation in mice[J].Nat Immunol,2005,6(10) : 1047-1053.
[6]Ziegler SF.Thymic stromal lymphopoietin and allergic disease[J].J Allergy Clin Immunol,2012,130(4) : 845-852.
[7]Takamura S,Matsuo K,Takebe Y,et al.Ag85B of mycobacteria elicits effective CTL responses through activation of robust Th1 immunity as a novel adjuvant in DNA vaccine[J].J Immunol,2005,175(4) : 2541-2547.
[8]吴健,徐军,钟南山.结核分支杆菌抗原85B DNA疫苗转染人气道上皮细胞对哮喘患者Th1/Th2平衡的调节作用[J].中华结核和呼吸杂志,2003,26(08) : 20-24.
[9]Wu J,Xu J,Cai C,et al.Ag85B DNA vaccine suppresses airway inflammation in a murine model of asthma[J].Respir Res,2009,10(1) : 51-59.
[10]房祥峰,钱江,孟锦绣,等.Ag85B慢病毒抑制人支气管上皮细胞TSLP及其受体的表达[J].中国病理生理杂志,2014,30(11) : 2015-2020.
[11]Roney K.Bone marrow-derived dendritic cells[J].Methods Mol Biol,2013,1031(10) : 71-76.
[12]李纪鹏,黄怡,王为忠,等.大鼠未成熟树突状细胞体外扩增及功能鉴定[J].中国普通外科杂志,2007,16 (9) : 859-863.
[13]廖娟红,林祥梅,贾广乐.小鼠髓源未成熟树突状细胞的分离与培养[J].中国畜牧兽医,2013,40(7) : 107-111.
[14]Mayordomo JI,Zorina T,Storkus WJ,et al.Bone marrow-derived dendritic cells serve as potent adjuvants for peptide-based antitumor vaccines[J].Stem Cells,1997,15(2) : 94-103.
[15]Liu Q,Shu X,Sun A,et al.Plant-derived small molecule albaconol suppresses LPS-triggered proinflammatory cytokine production and antigen presentation of dendritic cells by impairing NF-κB activation[J].Int Immunopharmacol,2008,8(8) : 1103-1111.
[16]Ziegler SF,Artis D.Sensing the outside world: TSLP regulates barrier immunity[J].Nat Immunol,2010,11(4) : 289-293.
[17]Kaur D,Brightling C.OX40/OX40 ligand interactions in T-cell regulation and asthma[J].Chest,2012,141(2) : 494-499.
[18]Yokoi T,Amakawa R,Tanijiri T,et al.Mycobacterium bovis Bacillus Calmette-Guérin suppresses inflammatory Th2 responses by inducing functional alteration of TSLP-activated dendritic cells[J].Int Immunol,2008,20 (10) : 1321-1329.
[19]Haczku A,Takeda K,Redai I,et al.Anti-CD86 (B7.2) treatment abolishes allergic airway hyperresponsiveness in mice[J].Am J Respir Crit Care Med,1999,159(5 Pt 1) : 1638-1643.
[20]Li Y,Shi XL,Cheng ZY,et al.HSP70/CD80 DNA vaccine inhibits airway remodeling by regulating the transcription factors T-bet and GATA-3 in a murine model of chronic asthma[J].Arch Med Sci,2013,9(5) : 906-915.
[21]刘金保,钟南山,李树浓,等.卡介苗对豚鼠实验性哮喘的预防性治疗作用[J].中国病理生理杂志,2003,19 (04) : 33-36.
[22]Karamatsu K,Matsuo K,Inada H,et al.Single systemic administration of Ag85B of mycobacteria DNA inhibits allergic airway inflammation in a mouse model of asthma [J].J Asthma Allergy,2012,5(11) : 71-79.
[23]Tsujimura Y,Inada H,Yoneda M,et al.Effects of mycobacteria major secretion protein,Ag85B,on allergic inflammation in the lung[J].PLoS One,2014,9 (9) : e106807-e106819.
[24]Ahrens B,Gruber C,Rha RD,et al.BCG priming of dendritic cells enhances T regulatory and Th1 function and suppresses allergen-induced Th2 function in vitro and in vivo[J].Int Arch Allergy Immunol,2009,150(3) : 210-220.
(责任编辑:林白霜,余小慧)
Ag85B regulates myeloid dendritic cell maturation and suppresses expression of TSLPR and OX40L mediated by TSLP in vitro
QIAN Jiang1,2,WU Jian2,AN Hong1,2,FANG Xiang-feng1,2,LI Dong-feng3,YANG Shi-fang2,MENG Jin-xiu3,GAO Xing-lin2
(1Graduate School of Southern Medical University,Guangzhou 510515,China;2Department of Respiratory Medicine,3Medical Research Center,Guangdong General Hospital,Guangdong Provincial Institute of Geriatrics and Guangdong Academy of Medical Sciences,Guangzhou 510080,China.E-mail: wjxst@hotmail.com)
[ABSTRACT]AIM: To investigate the maturation of mice immature myeloid dendritic cells (mDCs) induced by antigen(Ag) 85B of mycobacterium tuberculosis,and the expression of TSLPR and OX40L mediated by TSLP in vitro.METHODS: Recombinant mouse GM-CSF (rmGM-CSF) and rmIL-4 were used to induce bone marrow precursor cells of C57BL/6 mice to differentiate into immature mDCs in vitro.mDCs were identified followed by purification using CD11c binding magnetic beads.The morphological characteristic of mDCs was observed under inverted phase-contrast microscopebook=1681,ebook=153and scanning electron microscope.The surface phenotypes of mDCs were determined by flow cytometry.To obtain the optimal concentrations of Ag85B and TSLP,immature mDCs were cultured with different concentrations of Ag85B or TSLP at 0 (control group),50,100 and 200 μg/L for 24 h,and the expression of cell surface molecules CD80,CD86,TSLPR and OX40L was detected by flow cytometry.In addition,the expression of TSLPR and OX40L in Ag85B and TSLP-co-stimulated mDCs was determined by flow cytometry.RESULTS: After 7 d of culture in vitro,the cells showed irregular dendritic protrusions under the inverted-phase contrast microscope,and had wrinkles and dendritic splits under scanning electron microscope,conformed to the morphological characteristics of immature mDCs.The mDCs cells expressed higher level of specific marker CD11c,lower level of co-stimulatory molecules CD80 and CD86,which conformed to the phenotype of immature mDCs.The CD80+and CD86+cell ratios of mDCs displayed significant increases in 50,100 and 200 μg/L Ag85B or TSLP groups compared with control group (P<0.05).The ratios of TSLPR+and OX40L+cells did not differ among different concentrations of Ag85B groups.The ratios of TSLPR+and OX40L+cells were significantly increased in 100 μg/L and 200 μg/L TSLP groups compared with control group and 50 μg/L TSLP group (P<0.05).Under the circumstance of optimal Ag85B or TSLP treatment concentration at 200 μg/L,there was significantly decreased in TSLPR and OX40L cell ratio of mDCs in Ag85B group or Ag85B combined with TSLP group when compared with TSLP group (P<0.05),and no significant difference among Ag85B group,Ag85B combined with TSLP group and control group was observed.CONCLUSION: Ag85B enhances mDCs maturation by up-regulating the expression of co-stimulatory molecules CD80 and CD86,and inhibit the expression of pro-inflammatory specific molecules TSLPR and OX40L on TSLP-activated mDCs,indicating that Ag85B modifies the development of asthmatic airway inflammation through the pathway of TSLP-activated mDCs.
[KEY WORDS]Antigen 85B; Thymic stromal lymphopoietin; Myeloid dendritic cells; Thymic stromal lymphopoietin receptor; OX40L
通讯作者△Tel: 020-83827812; E-mail: wjxst@hotmail.com
*[基金项目]广州市科技计划项目(No.2014J4100040) ;广东省自然科学基金资助项目(No.S2011010003664) ;广州市健康医疗协同创新重大专项基金(No.201400000002) ;广东省科技计划项目(No.2013B031800026)
[收稿日期]2015-05-07
[文章编号]1000-4718(2015)09-1680-08
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.027

