茶氨酸配合物的合成及热化学研究
屈景年,聂 雪,刘 兴,邹 亮
(衡阳师范学院 化学与材料科学学院,湖南 衡阳 421008)
1950年酒户弥二郎博士从茶叶新梢中分离出一种不参与组成蛋白质的特殊氨基酸—茶氨酸,其化学组成和结构式如图1所示[1]。随后科学工作者对茶氨酸进行了深入的研究。
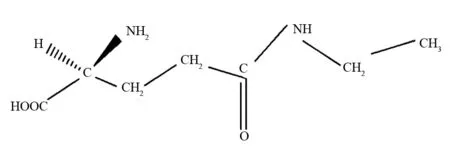
图1 茶氨酸分子结构
陆续发现茶氨酸对人体具有很好的保健功能和药理学作用[2]。近年,科技工作者进一步发现茶氨酸可以增强抗癌药物的药效,而且茶氨酸锌配合物还具有类胰岛素作用,生物兼容性强,体内外降糖作用明显[3]。这些研究成果进一步激发了科技工作者对茶氨酸及其配合物的研究兴趣。但茶氨酸与微量金属元素配合物的合成和其配合物的热化学性质文献报道很少,为了填补这类重要化合物的热化学数据,我们合成了茶氨酸Zn(Ⅱ)、Mn(Ⅱ)、Cu(Ⅱ)三种配合物,通过红外、化学分析确定配合物的组成。在HR-15型静态热量计上测定了配合物的燃烧热,由热化学原理计算出配合物在298.2K时的标准生成焓,为进一步研究茶氨酸配合物的其它性质提供热化学参数。
1 实验部分
1.1 仪器与试剂
茶氨酸BR,纯度大于99%(上海源叶生物科技有限公司),乙酸铜CP(Cu C4H6O4·H2O),乙酸锌CP(Zn C4H6O4·2H2O),乙酸锰 AR(Mn C4H6O4·4H2O),三(羟甲基)氨基甲烷AR(上海化学试剂公司),苯甲酸AR(天津市大茂化学试剂厂),实验前所用试剂均未作特别处理。HHS-恒温水浴(江苏金坛县医疗仪器厂)、HR-15型数显式氧弹热量计(长沙长兴高教仪器设备有限公司)、电子天平(梅特勒-托利多仪器上海有限公司)、FTIR-8000红外光谱仪(日本岛津)。
1.2 配合物的制备
1.2.1 茶氨酸与Cu(Ⅱ)配合物的制备
在分析天平上准确称取1.996~2.000g乙酸铜,用蒸馏水配成溶液备用。按乙酸铜与茶氨酸物质的量比为1∶2的比例,准确称取3.5g茶氨酸(茶氨酸略过量)配成溶液备用。将茶氨酸溶液加入到圆底烧瓶中,在60℃的恒温水浴上加热恒温,用稀碱调节溶液的pH值为7,在磁力搅拌条件下将乙酸铜溶液缓慢滴加到茶氨酸溶液中,续继恒温反应约2小时。当有沉淀析出时,将溶液转入蒸发皿中,在45℃恒温水浴上缓慢蒸发部分溶剂,然后在室温条件下结晶1~2天后分离出配合物,在抽滤条件下用冷的95%乙醇淋洗数次,收集固体放入存有干燥剂的玻璃干燥器中真空干燥至恒重备用。
1.2.2 茶氨酸与 Mn(Ⅱ)和Zn(Ⅱ)配合物的制备
分别准确称取乙酸锰2.448~2.450g;乙酸锌2.190~2.194g,配成溶液备用。按金属盐和配体茶氨酸1∶2的物质的量比准确称取3.5g茶氨酸两份(茶氨酸略过量),配成溶液备用。按1.2.1同样的步骤制备茶氨酸与Mn(Ⅱ)和茶氨酸与Zn(Ⅱ)配合物。
1.3 配合物的表征
1.3.1 配合物红外光谱分析
用KBr压片法测定配体(C7H14N2O3)和配合物的红外光谱。按文献[4]只考察配体和配合物中(COO-)基团的红外光谱,配体和铜配合物中(COO-)基团的红外光谱见图2和图3。从红外图可见,配体中 (COO-)的对称伸缩振动和反对称伸缩振动红外光谱分别是va(COO-)=1412cm-1;vas(COO-)=1582cm-1由此计算得到Δv(vas-vs)=169cm-1。在Cu[(C7H12N2O3)2]配合物红外光谱图中,vas(COO-)=1572cm-1;对称伸缩振动在配合物中出现两个峰,分别是va(COO-)=1429cm-1和va(COO-)=1413cm-1,计算它们的差值得到Δv(vas-vs)=143cm-1和Δv(vas-vs)=158cm-1,与配体比较分别减少了26cm-1和11cm-1。文献[6]指出:在羧酸或 氨基酸配合物中,-COO-伸缩振动频率的变化能敏感地反映金属离子与-COO-的相互作用程度。实验结果表明在Cu[(C7H12N2O3)2]配合物中Δv发生了改变,据此可以判断茶氨酸中的-COO-与Cu2+发生了配合作用。而且在配合物中Δv是降低的,表明配合物中-COO-与Cu2+的作用主要是离子键,其共价键成份较小。另外,Zn[(C7H12N2O3)2]和 Mn[(C7H12N2O3)2]的红外光谱与Cu(Ⅱ)配合物类似不重述。

图2 茶氨酸红外光谱
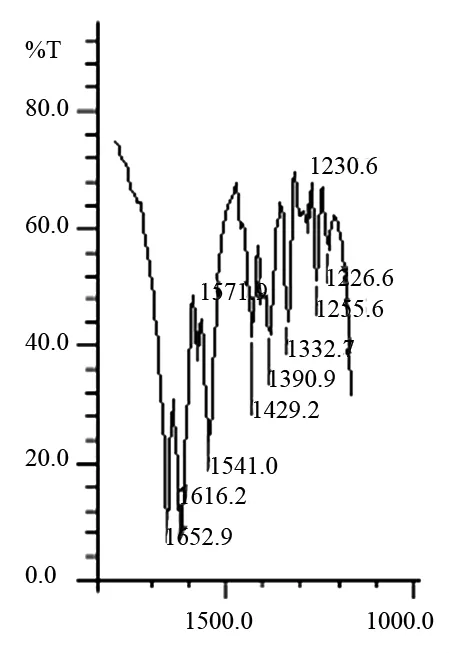
图3 铜配合物红外光谱
1.3.2 配合物中结晶水测定
化学分析法测定化合物中的结晶水是一种经典方法,与仪器分析相比不足之处是费时费力,但其优点在于实验结果更具可靠性。本实验采用EDTA络合滴定分析法测定配合物中的结晶水。以NH3-NH4Cl作为缓冲液,二甲酚橙为指示剂,用标准EDTA直接滴定Zn2+,实验结果,锌配合物中Zn(Ⅱ)的质量分数为0.1548(0.1597)括号为理论计算值。以PAN(1-(2-吡啶偶氮)-2-萘酚)为指示剂,用标准EDTA滴定Cu2+,测得Cu(Ⅱ)的质量分数为0.1527(0.1559)。Mn(Ⅱ)测定,以铬黑T作指示剂,以氨水-氯化铵缓冲溶液,调节溶液的pH值为10左右,用EDTA标准溶液滴定,测得 Mn(Ⅱ)的质量分数为0.1308(0.1377)。根据结果推断配合物中不含结晶水。由此确定配合物的组成 分 别 为:Zn[(C7H12N2O3)2]、Cu[(C7H12N2O3)2]、Mn[(C7H12N2O3)2]。
1.4 配合物燃烧热的测量
1.4.1 热量计的标定
用HR-15型静态弹式热量计测定化合物的标准生成焓已有文献报道[7]。此热量计密封性能好,热量损失较少,同时由于弹体静止,引入附加不确定因素也相对较少,对只含C、H、O、N化合物的燃烧热可以得出准确度较高的实验结果。实验前用热值基准物质苯甲酸(纯度99.95% ,发热量为26460J/g),对HR-15型数显式氧弹热量计的热当量进行标定。粗称0.8~0.9g苯甲酸,压片后用分析天平精确称量,安装好实验仪器设备,向氧弹中充入2MPa的氧气后放入盛水桶内,桶内加入3000mL低于室温1℃的水,启动微机和燃烧热程序进行实验。实验结束后收集燃烧过程的温度~时间数据,用雷诺校法进行数据处理,得出燃烧过程的真实温差。按公式-m样QV-l·Ql-Q酸=CVΔT进行计算,式中 QV/J.g-1样品等容发热量,l/cm 点火丝长度,Ql为点火丝单位长度发热量;Q酸为燃烧过程产生酸的发热量,CV/J.g℃-1为热量计热当量,ΔT为雷诺校正的真实温差。五次平行实验测定取平均值,结果见表1。
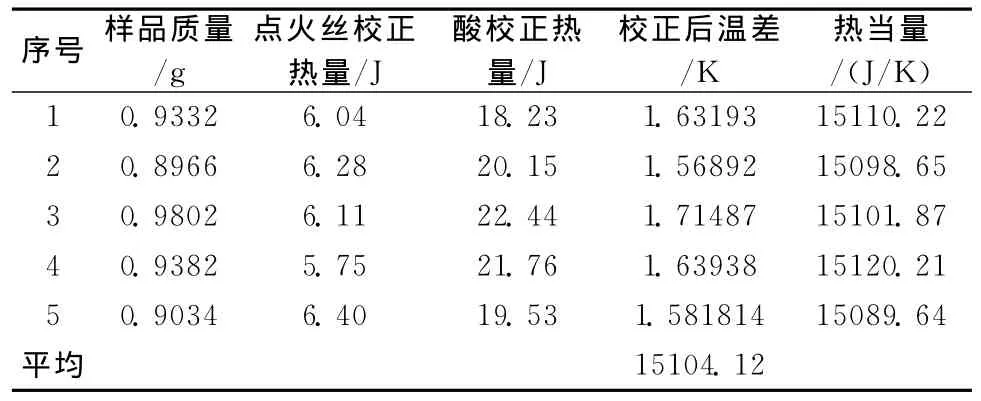
表1 热量计热当量标定实验结果
为了确定热量计测量结果的可靠性,采用THAM (Tris hydroxy methy amino methan)作样品,在氧弹热量计上测定其燃烧热,对热量计的可靠性能进行验证,三次平行实验测定取平均值,THAM 的 燃 烧 热 为 -20.048kJ/g,与 文 献-20.041kJ/g基本一致[8],说明热量计测定的结果准确可靠。
1.4.2 配合物燃烧热的测量
粗称称一定质量的样品压片,用分析天平精确称量。按1.4.1相同的步骤测定配合物的发热量,并以相同的数据处理方法对三次平行实验数据进行处理,取平均值列于表2中。
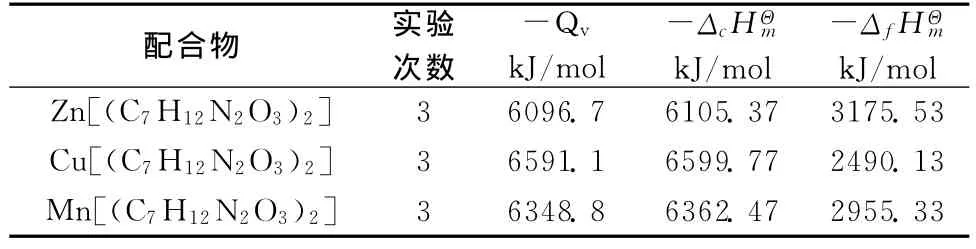
表2 配合物燃烧热实验结果
1.5 标准生成焓的估算
配合物燃烧化学反应方程式分别为:
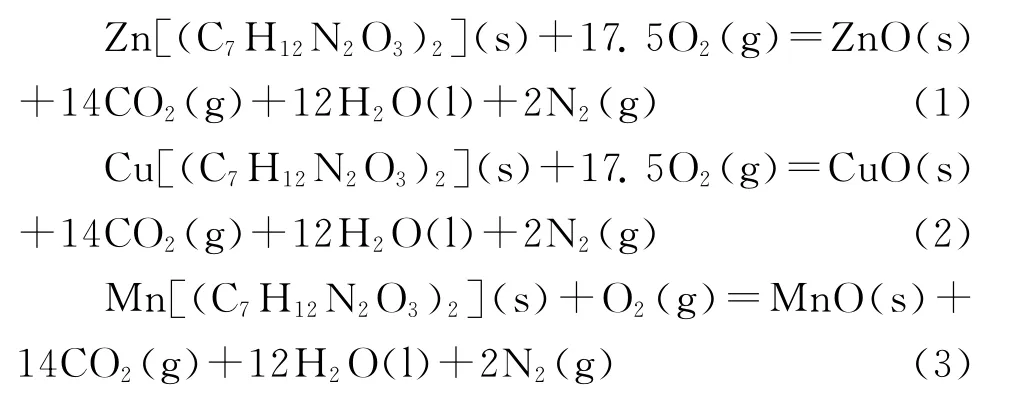
根据盖斯定律和配合物的燃烧反应方程式,可得到配合物的标准生成焓ΔfHΘm计算公式为:
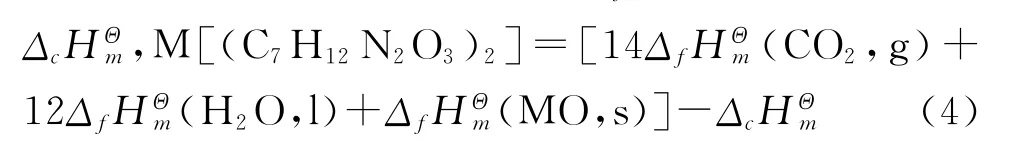
式中 M 代表(Zn、Cu、Mn)。由文献[9]查得燃烧反应中所涉及到的各物质在298.2K时的标准生成焓列于表3中。

表3 298.2K各物质的标准生成焓
由配合物燃烧反应式(1)~(3),以表3各物质的标准生成焓分别代入式(4)中进行计算,得到配合物的标准生成焓分别为:

2 结果与讨论
用燃烧热法求化合物的标生焓其方法比较简单,实验结果相对较为准。从实验结果可以看出,在配体和配位数相同条件下,配合物中配位键的强弱和金属氧化物的生成焓是影响配合物燃烧热的主要因素。金属离子与配体形成配位键较强时,燃烧时破坏化学键需要消耗的能量更多,放出的热相对减少。金属氧化物的生成焓越大,配合物燃烧放出的热也大。这一定性分析可以用于粗略比较配合物燃烧热的大小,以推断配合物燃烧样品的质量。
[1]高小红,袁华,喻宗沅.茶氨酸的研究进展[J].化学与生物工程,2004(1):7-9.
[2]吕毅,郭雯飞,倪捷儿,等.茶氨酸的生理作用及合成[J].茶叶科学,2003,23(1):1-5.
[3]Matsumoto K,Yamamoto S,Yoshikawa Y,et al.Antidiabetic activity of Zn(Ⅱ)complexes with a derivative of L-glutamine[J].Bull chem Soc Japan,2005,78(6):1077-1081.
[4]闵蔚宗,柳华,钟淑林.茶氨酸镧(Ⅲ)、钕(Ⅲ)配合物的合成和表征[J].四川大学学报:自然科学版,1995,32(6):706-712.
[5]万红贵,彭银成,黄志旭,等.Zn(N2O2)型锌配合物及L-茶氨酸锌与糖尿病关系的研究进展[J].中国药理学与毒理学杂志,2014(5):774-778.
[6]中本一雄.无机和配合物的红外和拉曼光谱(中译本)[M].北京:化学工业出版社,1991.
[7]屈景年,李俊华,曾荣英,等.8-羟基喹啉过渡金属配合物的标准生成焓测定[J].衡阳师范学院学报,2008,29(3):63-65.
[8]张发明.精密转动氧弹燃烧热量计的建立及卟啉化合物热化学性质的研究[D].武汉:武汉大学,1987.
[9]伊赫桑·巴伦.纯物质热化学数据手册[M].北京:科学出版社,2003.

