石墨烯修饰电极电化学检测食盐中碘
吴锁柱,郭俊杰,韩悌云,霍乃蕊,程原生
(1.山西农业大学 食品科学与工程学院,山西 太谷030801;2.山西农业大学 动物科技学院,山西 太谷030801;3.山西农业大学 实验教学中心 山西 太谷030801)
碘是人体生长必需的一种微量元素。人体中所需的碘主要通过摄取海产品和加碘盐获得。当膳食中碘过量或不足时,会引起一些健康问题如精神发育迟滞、甲状腺肿、甲状腺机能亢进等[1,2]。因此,建立一种灵敏度高、选择性好、准确度高的碘检测方法是非常必要的。目前,国内外研究者已发展多种碘检测方法,包括荧光法[3]、毛细管电泳法[4]、高效液相色谱法[5]、气相色谱-质谱法[6]等。然而,这些方法存在仪器价格昂贵、试剂耗量大、分离时间长等缺陷。与上述方法相比,电化学方法是一种简单、廉价、选择性好、灵敏度高的方法,且可利用碘离子的电化学活性实现其检测[7,8]。
石墨烯是近年发展起来的一种新型纳米材料,由于具有导电性好、比表面积大等优点,广泛用于构建电化学传感器和生物传感器,在碘离子检测中的应用较少[7,9]。本文采用一步电化学沉积法将胶态水溶液中的氧化石墨烯沉积到电极表面制得石墨烯修饰电极,利用该修饰电极建立了一种电化学检测碘离子的新方法,进一步将该方法用于食盐中碘的测定。
1 材料及方法
1.1 材料与试剂
氧化石墨购自南京先丰纳米材料科技有限公司;碘化钠、溴化钠、氯化钠、氟化钠、磷酸氢二钠、磷酸二氢钠、氢氧化钠、高氯酸锂、抗坏血酸购自上海晶纯生化科技股份有限公司。实验用水为超纯水。pH为1.0~2.0缓冲溶液由0.1mol·L-1硫酸和0.1mol·L-1氢氧化钠配制,pH 为3.0~5.0缓冲溶液由0.1mol·L-1磷酸氢二钠和0.1 mol·L-1磷酸二氢钠配制。不同浓度碘化钠溶液(支持电解质为0.1mol·L-1缓冲)现用现配。
1.2 石墨烯修饰电极的制作
将直径为2mm裸金电极先用粒径为0.5和0.05μm的氧化铝湿粉打磨,待将其在超纯水中超声清洗3min后,采用循环伏安法将它在0.1 mol·L-1硫酸中进行电化学打磨,电位扫描范围为0~1.6V,扫速为100mV·s-1,直到获得稳定的循环伏安图为止。将氧化石墨在0.1mol·L-1高氯酸锂中超声剥离30min,制得3g·L-1氧化石墨烯胶体水溶液。用高纯度氮气处理上述胶体水溶液10min,采用直接电化学沉积法将石墨烯修饰在电极表面,即可制得石墨烯修饰电极,沉积电位为-1.2V,沉积时间为800s。
1.3 电化学检测碘离子
将石墨烯修饰的金工作电极、银-氯化银(3 mol·L-1氯化钾)参比电极和铂丝对电极与电化学工作站连接,将上述三电极浸入碘离子溶液中,采用方波伏安法对溶液中的碘离子进行了测定,阶跃电位为5mV,振幅为20mV,频率为10Hz。
2 结果与分析
2.1 碘离子在石墨烯修饰电极上的电化学行为
图1为1×10-4mol·L-1碘化钠(支持电解质为0.1mol·L-1缓冲,pH=1.0)在石墨烯修饰金电极上的循环伏安图(扫速为100mV·s-1)。当溶液中不存在碘化钠时,未在裸金电极(灰色虚线)和石墨烯修饰的金电极(黑色虚线)上观察到明显的氧化峰和还原峰;与裸金电极相比,在石墨烯修饰电极上获得的充电电流信号明显增大,这一现象表明石墨烯已成功修饰在金电极表面。而当溶液中存在1×10-4mol·L-1碘化钠时,可在0.54V和0.43V处分别明显观察到碘离子的氧化峰和还原峰(黑色实线)。因此,可利用碘离子在石墨烯修饰电极表面的电化学信号实现对其含量的测定。

图1 碘离子在工作电极上的循环伏安图Fig.1 Cyclic voltammograms of iodide at the working electrodes
2.2 电极浸泡时间的影响
图2A为石墨烯修饰电极在1×10-4mol·L-1碘化钠(支持电解质为0.1mol·L-1缓冲,pH=1.0)溶液中浸泡不同时间的方波伏安图。由图2可知,碘离子的氧化峰电流值随电极浸泡时间的延长而不断增加,4min后峰电流值基本保持不变。因此,后续实验选择4min为最佳电极浸泡时间进行碘离子的测定。
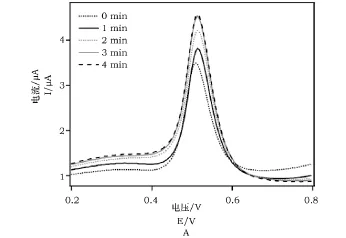
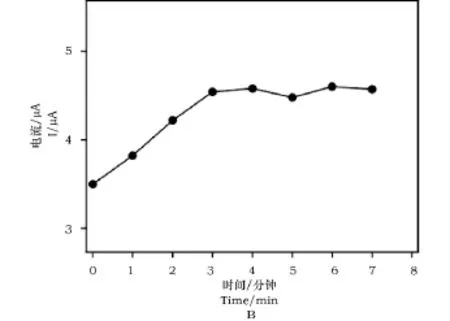
图2 (A)石墨烯修饰电极浸入碘溶液中不同时间的方波伏安图;(B)氧化峰电流随电极浸泡时间的变化图Fig.2 (A)Effect of electrode immersion time on square wave voltammograms of graphene modified electrode;(B)Dependence of oxidization peak current on electrode immersion time
2.3 溶液pH的影响
图3为1×10-4mol·L-1碘化钠(支持电解质为0.1mol·L-1缓冲)在石墨烯修饰电极上的氧化峰电流随溶液pH的变化图。当溶液pH为1.0时,获得的碘离子的氧化峰电流最大。因此,后续实验选择最佳pH为1.0的条件下进行碘离子的检测。
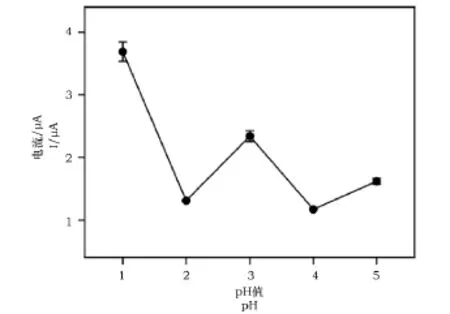
图3 氧化峰电流随溶液pH的变化图Fig.3 Dependence of oxidization peak current on solution pH
2.4 石墨烯修饰电极对不同浓度碘离子的响应
图4为浓度为1×10-7至1×10-2mol·L-1碘化钠(支持电解质为0.1mol·L-1缓冲,pH=1.0)在石墨烯修饰电极上的方波伏安图。由图4可见,碘离子的氧化峰电流随碘离子浓度的增加而不断增大,且氧化峰电位向负电位方向发生明显的移动。实验结果表明,氧化峰电流的对数与碘离子浓度的对数在5×10-6至1×10-2mol·L-1浓度范围内具有良好的线性关系(R=0.9965),检出限为5×10-6mol·L-1。
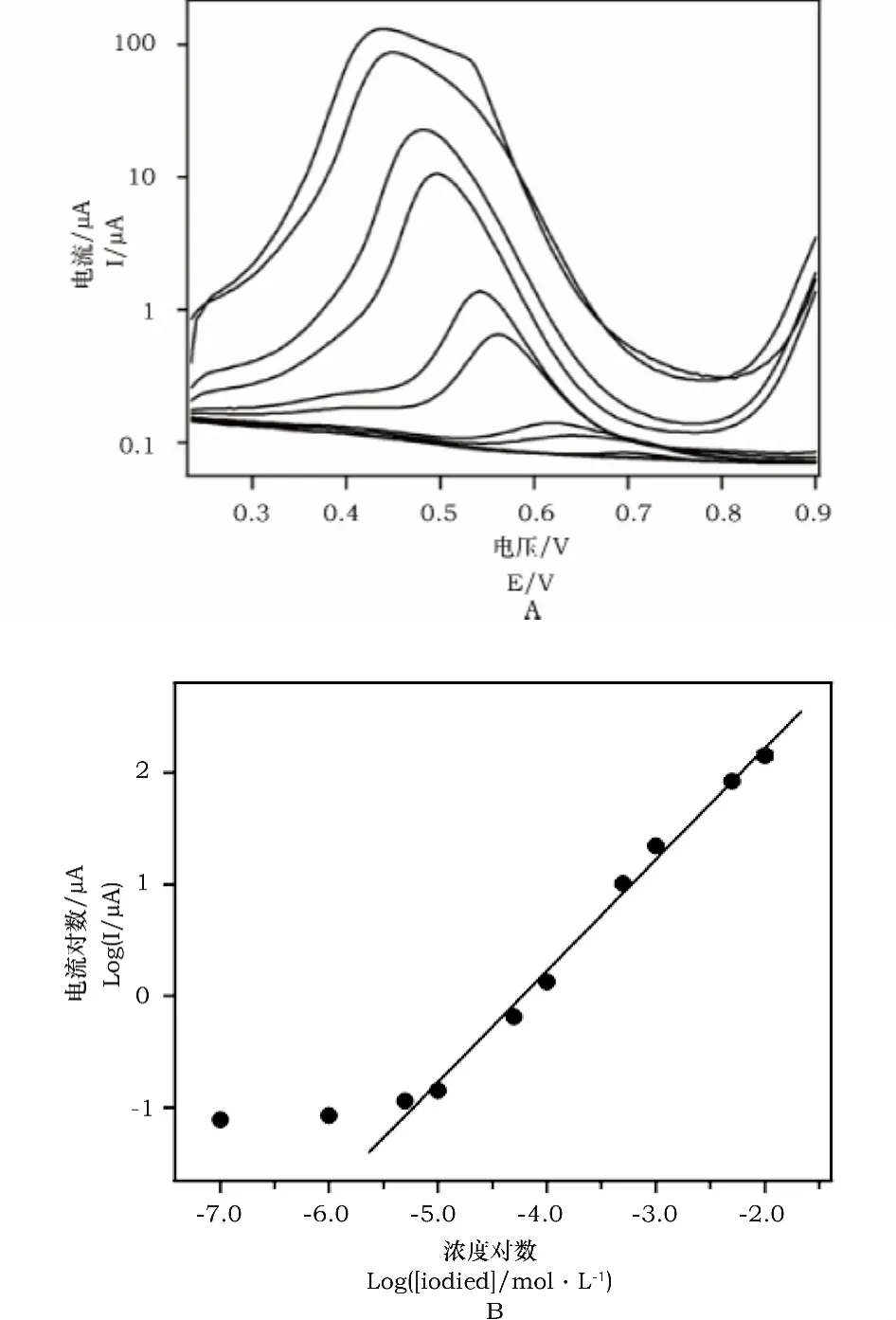
图4 (A)石墨烯修饰电极对不同浓度碘离子的方波伏安图(从下到上碘离子浓度:0,1×10-7,1×10-6,5×10-6,1×10-5,5×10-5,1×10-4,5×10-4,1×10-3,5×10-3和1×10-2 mol·L-1);(B)氧化峰电流随碘离子浓度的变化图Fig.4 (A)Square wave voltammograms of graphene modified electrode to different concentration of iodide(iodide concentration from bottom to up:0,1×10-7,1×10-6,5×10-6,1×10-5,5×10-5,1×10-4,5×10-4,1×10-3,5×10-3 and 1×10-2 mol·L-1);(B)Dependence of oxidization peak current on iodide concentration
2.5 选择性
考察了其它卤素离子对碘离子测定的影响。采用石墨烯修饰电极对1×10-4mol·L-1碘化钠、溴化钠、氯化钠和氟化钠(支持电解质为0.1 mol·L-1缓冲,pH=1.0)溶液分别进行测定,结果如图5所示。由图5可知,除碘离子外,其它卤素离子未在同一电位范围内观察到明显的氧化峰。这一结果表明可忽略其它卤素离子对碘离子的测定产生的干扰。

图5 不同卤化钠在石墨烯修饰电极上的方波伏安图Fig.5 Square wave voltammograms of graphene modified electrode to NaF,NaCl,NaBr and NaI,respectively
2.6 重现性
采用石墨烯修饰电极对1×10-4mol·L-1碘化钠(支持电解质为0.1mol·L-1缓冲,pH=1.0)平行测定11次,碘离子的氧化峰电流值的相对标准偏差为4.4%,表明该方法具有良好的重现性。
2.7 样品检测
将添加有19.0mg·kg-1碘(添加剂为碘酸钾)的市售食盐用过量的抗坏血酸处理,碘酸钾将完全还原为碘离子[10]。10倍稀释的样品溶液通过在100mL 0.1mol·L-1缓冲溶液(pH=1.0)中溶解10.000g食盐和0.100g抗坏血酸配制,采用标准加入法对样品中的碘离子含量进行了测定。采用石墨烯修饰电极对样品溶液平行测定3次,获得样品中碘离子的浓度为15.2mg·kg-1。这一结果与厂家的测定值接近,表明建立的方法有望用于实际样品中碘离子的检测。
3 结论与讨论
循环伏安图结果表明石墨烯可成功修饰到电极表面,且获得了碘离子在该电极表面明显的氧化峰电流信号,这些均为建立基于石墨烯修饰电极的电化学检测碘离子方法奠定了坚实基础。在此基础上,获得石墨烯修饰电极对碘离子的响应范围为1×10-7至1×10-2mol·L-1,线性范围为5×10-6至1×10-2mol·L-1,检出限为5×10-6mol·L-1。进一步将其用于食盐样品中碘的测定,且结果满意。这种方法具有电极制作简单、响应范围宽、检测时间短、选择性高、重现性好等优点,为食盐中碘含量的检测提供了一种新途径。除可用于食盐中碘含量的检测外,该方法还有望进一步用于其它含碘食品的测定。
[1]Delange F,De Benoist B,Pretell E,et al.Iodine deficiency in the world:Where do we stand at the turn of the century[J].Thyroid,2001,11(5):437-447.
[2]Delange F,De Benoist B,Alnwick D.Risks of iodine-induced hyperthyroidism after correction of iodine deficiency by iodized salt[J].Thyroid,1999,9(6):545-556.
[3]Nabavi S,Alizadeh N.A highly sensitive and selective turn-on fluorescence sensor for iodide detection based on newly synthesized oligopyrrole derivative and application to real samples[J].Sens Actuator B-Chem,2014,200:76-82.
[4]Huang Z,Ito K,Timerbaev A R,et al.Speciation studies by capillary electrophoresis-simultaneous determination of iodide and iodate in seawater[J].Anal Bioanal Chem,2004,378(7):1836-1841.
[5]Woollard D C,Indyk H E.Determination of iodide in high-dose dairy ingredient premixes by high performance liquid chromatography[J].Int Dairy J,2014,34(1):62-64.
[6]Reddy-Noone K,Jain A,Verma K K.Liquid-phase microextraction-gas chromatography-mass spectrometry for the determination of bromate,iodate,bromide and iodide in high-chloride matrix[J].J Chromatogr A,2007,1148(2):145-151.
[7]Liu S Q,Hu F T,Liu C B,et al.Graphene sheet-starch platform based on the groove recognition for the sensitive and highly selective determination of iodide in seafood samples[J].Biosens Bioelectron,2013,47:396-401.
[8]Pereira F C,Moretto L M,De Leo M,et al.Gold nanoelectrode ensembles for direct trace electroanalysis of iodide[J].Anal Chim Acta,2006,575(1):16-24.
[9]Chen D,Tang L H,Li J H.Graphene-based materials in electrochemistry[J].Chem Soc Rev,2010,39(8):3157-3180.
[10]杨彦丽,林立,寇琳娜.电感耦合等离子体质谱-离子色谱法检测食盐中的碘[J].分析化学,2010,38(9):1381-1381.

