RAPD-PCR分析超重力处理对拟南芥基因组DNA的影响
高建华,王文斌,刘建东,王金胜
(山西农业大学 生命科学学院,山西 太谷030801)
受空间诱变育种(微重力、强辐射和高真空等复杂因素)的启示[1],人们尝试研究利用大于地球重力加速度的超重力环境进行作物诱变育种。研究显示,超重力能够从不同水平影响植物的生长发育。比如从植物器官发育水平研究,发现超重力能够抑制幼苗胚轴的伸长。在细胞水平,超重力处理能导致细胞壁硬度增加,延展性降低,液泡的pH值提高,细胞骨架微管量增加等等[2~7]。从基因水平上讲,超重力还能使基因表达水平发生变化[2,8~10]。另外,也有直接证据观察到超重力对基因组DNA的直接影响。比如,18×g的超重力处理人肿瘤细胞,导致微卫星DNA序列的图谱的变化[11]。
一般认为,植物对超重力的反应系统是位于质膜上的机械力感受系统,比如NADH氧化酶、Ca2+/CaM 系统等[12~14]。而前述超重力导致微卫星DNA序列的变化,也可能是机械力对遗传物质的直接或间接的损伤引起的。Tauchi等检测到超重力作用可直接干扰DNA双链断裂后的同源重组效率[15]。Pedroso等[16]指出,超重力处理使高凉菜属植物(Kalanchoe daigremontiana)的DNA断裂,并且叶绿体DNA的断裂要早于核DNA。为进一步证明该观点,我们设置不同的离心条件,模拟不同的超重力环境,对模式植物拟南芥(Arabidopsis thaliana)的种子进行超重力处理。对其M2代植株进行 RAPD-PCR(Random Amplified Polymorphic DNA,随机扩增多态性DNA)检测,期望直接筛选到DNA突变位点,并确认其核苷酸序列变化,进一步找到超重力导致遗传物质突变的直接证据,并分析其潜在机理。
1 材料与方法
1.1 实验材料
实验材料为野生型拟南芥Arabidopsis thaliana cv.Columbia的种子(由英国诺丁汉大学拟南芥储藏中心提供)。
1.2 拟南芥的超重力处理及栽培
将拟南芥干种子用75%的酒精浸泡消毒30 s,清洗干净,用水浸种2h。然后分装至1.5mL的离心管中,按不同的条件离心处理(参照表1)。处理完毕,将种子撒播在预先湿润的营养块上。最后置于光照培养箱培养(培养条件16h光照,23℃;8h黑暗,20 ℃)。
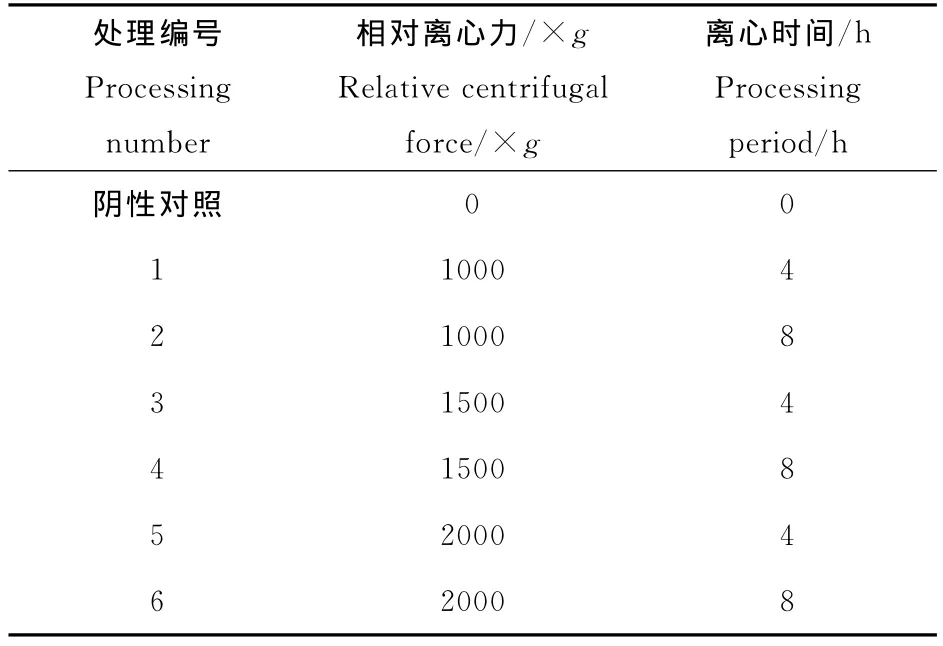
表1 拟南芥种子的超重力处理条件Table 1 The processing conditions for the Arabidopsisthaliana seeds
1.3 拟南芥基因组DNA的提取与检测
将上述不同处理诱变的拟南芥种子播种,为M1代。种子收获后,继续分别种植,获得M2植株。对不同处理的M2代拟南芥,分别取叶片0.5 g,并以CTAB法提取基因组DNA(对于同一处理的拟南芥,取不同植株上的叶片,等重量混合后,共取0.5g)。将样品叶片在液氮中研磨,加入65℃预冷的CTAB提取缓冲液[2% (w/v)CTAB,100 mmol·L-1的 Tris-HCl,500mmol·L-1的 EDTANa2,1.4mol·L-1的 NaCl,1%(v/v)的β-巯基乙醇,以及2%(w/v)的聚乙烯吡咯烷酮,pH8.0]。混匀后,置于65℃的水浴中,温浴40 min,期间不时地颠倒混匀。加入等体积的氯仿异戊醇(24∶1),温和颠倒2min,12 000rpm离心10 min。取上清,重复氯仿异戊醇提取步骤。取离心后的上清,加入等体积预冷的异丙醇,轻轻摇匀,置-70℃冰箱30min。4℃,12 000rpm离心5 min,弃上清。用70%乙醇洗涤沉淀3次,风干后,加入100μL TE缓冲液(10mmol·L-1的 TriSHCl,1mmol·L-1的 EDTANa2,pH 8.0。)溶解DNA。向DNA溶液中加入5μL10mmol·L-1RNase A,37℃温浴20min。最后,取3μLDNA溶液,在0.8%的琼脂糖凝胶中进行电泳,检测DNA的完整性。另外,取5μL提取的DNA,用灭菌双蒸水50倍稀释,使用紫外分光光度计检测DNA的纯度。其余的DNA置于4℃,备用。
1.4 不同处理拟南芥的RAPD检测
本实验选用20条随机引物(见表2,TaKaRa公司)对不同处理的M2代拟南芥,进行了RAPD分析。RAPD-PCR使用的反应体系为:10×PCR Buffer,2.5μL;MgCl2(25mmol·L-1),2.5μL;dNTPs Mixture(各2.5mmol·L-1),2μL;引物(20μmol·L-1),1μL;Taq(5U·μL-1,Takara TaqTM,碱基错配率介于万分之四到五之间),0.125μL;模板 DNA(负对照用水代替 DNA),1 μL;双蒸水补齐25μL。PCR反应条件为,首先94℃预变性3min,然后进行40个循环的扩增(94℃变性45s,36℃退火45s,72℃延伸1min),最后,72℃保持10min。
将PCR产物取5μL,在1.5%的琼脂糖凝胶上进行电泳检测,然后使用凝胶成像系统记录实验结果。每条引物,至少进行3次重复。

表2 本实验使用的引物序列Table 2 The primers for RAPD analysis
2 结果与分析
2.1 M2代拟南芥的RAPD分析
以未经处理的野生型拟南芥为对照,对6个处理的M2代拟南芥的DNA进行RAPD分析。实验使用20条RAPD引物进行PCR检测,结果显示,大部分引物未检测出差异,只有3条引物找出了稳定的差异性。使用引物M的PCR反应中,处理2缺失了一条约1.3kb的条带;使用引物S的PCR反应中,处理1出现一条略小于750bp的条带;使用引物T的PCR反应中,处理5检测出一条约460bp的条带(图1)。
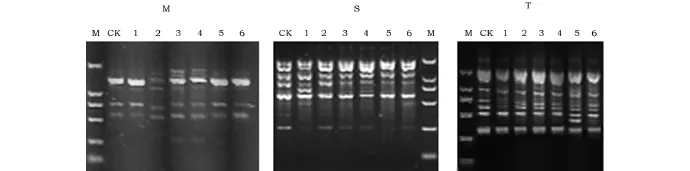
图1 不同处理拟南芥M2代植株的RAPD多态性分析Fig.1 The results of the RAPD-PCR analysis for the M2generation plants注:图1中显示分别使用引物M、S和T筛选出的RAPD图谱变化。其中,“CK”泳道为阴性对照,使用未处理的拟南芥基因组DNA为模板;“M”泳道为标准DNA分子,从大到小依次为2 000、1 000、750、500、250和100bp;“1~6”泳道样品分别来自处理1~6(见表1)的M2代植株。Note:Figure 1shows the RAPD map of samples in different treatment groups with primer M,S and T.Lane CK,the negative control using the DNA of wild Arabidopsis thalianaas the template for PCR.Lane M,the DNA marker including 2 000,1 000,750,500,250and 100bp bands.Lane 1~6,RAPD-PCR results of M2generation plants whose parents were processed in the different hypergravity conditions,respectively(processing number 1to 6,Table 1).
2.2 部分特异性片段的序列分析
对在RAPD-PCR中筛选出来部分特异性片段(引物T,处理2)进行了测序分析。处理2中,使用引物T检测到一条约460bp的特异性条带,将该片段回收,纯化并测序。然后在线(http://www.arabidopsis.org/)进行 Blastx,发现该序列全长464bp,与拟南芥线粒体中琥珀酸脱氢酶的铁硫蛋白亚基 AT3G27380.1(3号染色体)、AT5G40650.1(5号染色体)和 AT5G65165.1(5号染色体)的氨基酸序列表现出较高的同源性(相似性依次为78%,76%和70%)。
进一步分析其核酸序列,发现该464bp条带的1~336bp与AT3G27380.1基因第一个外显子3'序列匹配较好,而337~464bp序列与该基因第一内含子3'端至第二外显子5'附近的序列匹配,但是同源性略低(图2)。

图2 464bp特异性条带序列与AT3G27380.1基因的对比图Fig.2 The alignment of the DNA sequence of 464bp band and AT3G27380.1gene注:“464bp”表示处理5中,使用引物T筛选到的特异性条带,共464bp。“AT3G27380.1”基因是拟南芥琥珀酸脱氢酶中的铁硫蛋白亚基基因基因组DNA序列,图中只列出该基因第251~1 400bp处的序列(从起始密码子ATG对应的位点计数)。阴影部分为相同序列。两个三角形分别标注出第一个内含子的起始和结束位点。Note:“464bp”represents the sequences of the extra 464bp band detected by the primer T in the samples of processing number 5.“AT3G27380.1”shows the 251~1400nucleotides of genomic DNA sequences of the Fe-S protein subunit of the succinate dehydrogenase genes(counting started from the A of the start codon ATG).The matched sites are shaded and the black triangles indicate the boundaries of the first intron of the AT3G27380.1gene.
以上比对结果暗示,2000×g的离心力处理拟南芥种子4h后,基因组DNA在琥珀酸脱氢酶中的铁硫蛋白亚基基因处产生缺失突变,导致其第一内含子部分丢失。同时,产生了一系列的点突变。
3 讨论
本实验设置不同的重力加速度和持续时间的组合,对拟南芥种子进行超重力处理,并对处理过的材料进行DNA水平的检测。20条RAPD引物,共检测出3处突变。即,引物M检测出处理2中的拟南芥材料缺失了一条约1.3kb的条带;引物S检测出处理1中的材料多扩增出一条略小于750bp的条带;引物T检测出处理5中的拟南芥多扩增出一条464bp的条带。该结果证明,超重力处理能够对拟南芥基因组造成直接的影响。类似的结果已在人肿瘤细胞中被发现[11]。
将处理5中出现的464bp的特异性条带进行测序并在线比对,结果发现该处理可能导致拟南芥粒体中琥珀酸脱氢酶的铁硫蛋白亚基突变。而拟南芥共有三个相关基因,分别为AT3G27380.1、AT5G40650.1和 AT5G65165.1。Blastx分析,该464bp片段与AT3G27380.1基因的编码蛋白同源性最高。该结果暗示,此突变位点可能位于3号染色体上。当然,由于该片段序列本身存在较多的突变位点,且与 AT5G40650.1和 AT5G65165.1基因也有一定的同源性,因此也有可能真正的突变位点位于5号染色体上相应的位置。要精确该突变位点仍需要进一步的检测和分析。
另外,该464bp特异性条带的测序结果,说明该拟南芥突变体很有可能是琥珀酸脱氢酶的铁硫蛋白亚基编码基因的第一个内含子缺失。结合已有报道[12,16],我们推测超重力引发突变的重要机理可能是导致基因组DNA片段的断裂或丢失。同时,由于超重力影响同源重组的效率,从而使机体在修复这种较为严重的损伤时,更多地使用易错修复(error-prone repair),最终导致片段缺失及缺失位点两侧的序列严重突变。
4 结论
本实验设置了一系列重力加速度条件,通过RAPD引物对处理后的材料进行突变筛选。结果显示,超重力作用能够直接引发遗传物质——DNA的突变,为超重力诱变育种的可行性提供了直接支持。当然,由于筛选到的突变数量较少,暂时无法揭示不同程度的重力加速度对基因组DNA的影响规律,因此,仍需要更全面的筛选和研究。
[1]郑景生.微重力下的植物生物学效应与空间诱变育种研究 [J].江西农业大学学报,2003,25(5):671-675.
[2]Martzivanou M,Hampp R,Hyper-gravity effects on the Arabidopsis transcriptome[J].Physiologia Plantarum,2003,118(2):221-231.
[3]Soga K,Wakabayashi K,Hoson T,et al,Hypergravity-induced increase in the apoplastic pH and its possible involvement in suppression of beta-glucan breakdown in maize seedlings[J].Physiologia Plantarum,2000,27(10):967-972.
[4]Soga K,Wakabayashi K,Kamisaka S,et al,Graviperception in growth inhibition of plant shoots under hypergravity conditions produced by centrifugation is independent of that in gravitropism and may involve mechanoreceptors[J].Planta,2004,218(6):1054-1061.
[5]Soga K,Wakabayashi K,Kamisaka S,et al,Growth restoration in azuki bean and maize seedlings by removal of hypergravity stimuli[J].Advances in space research,2003,31(10):2269-2274.
[6]Soga K,Wakabayashi K,Kamisaka S,et al,Perception mechanism of gravity stimuli in hypergravity-induced growth inhibition of azuki bean roots[J].Biological sciences in space,2003,17(3):179-180.
[7]Soga K,Wakabayashi K,Kamisaka S,et al,Mechanoreceptors rather than sedimentable amyloplasts perceive the gravity signal in hypergravity-induced inhibition of root gowth in azuki bean[J].Functional plant biology,2005,32(2):175-179.
[8]Yoshioka R,Soga K,Wakabayashi K,et al,Hypergravity-induced changes in gene expression in Arabidopsis hypocotyls[J].Advances in space research,2003,31(10):2187-2193.
[9]Kittang AI,van Loon JJ,Vorst O,et al,Groud based studies of gene expression in Arabidopsis exposed to gravity stresses[J].Journal of gravitational physiology,2004,1(2):223-224.
[10]Saito Y,Soga K,Wakabayashi K,et al,Increase in expression level of alpha-tubulin gene in Arabidopsis seedlings under hypergravity conditions[J].Biological sciences in space,2003,17(3):177-178.
[11]Han ZM,Ishizaki K,Nishizawa K,et al,A genetic effect of altered gravity:mutations induced by stimulated hypogravity and hypergravity in microsatellite sequences of human tumor cells[J].Mutation research,1999,426(1):1-10.
[12]Bacon E,Morre DJ,Plasma membrane NADH oxidase of maize roots responds to gravity and imposed centrifugal forces[J].Plant physiology and biochemistry,2001,39(6):487-494.
[13]Garcia C,Hicks C,Morre DJ,Plasma membrane NADH oxidase is gravi-responsive[J].Plant physiology and biochemistry,1999,37(7-8):551-558.
[14]Poovaiah BW,Yang T,van Loon JJ,Calcium/calmodulin-mediated gravitropic response in plants[J].Journal of gravitational physiology,2002,9(1):211-214.
[15]Tauchi H,Matsumoto E,Iijima K,et al,Effect of gravity stress on fidelity of DNA double-strand break repair[J].Biological sciences in space,2003,17(3):255-256.
[16]Pedroso MC,Durzan DJ,Effect of different gravity environments on DNA fragmentation and cell death in Kalanchoe leaves[J].Annals of Botany,2000,86(5):983-994.

