青蒿提取物对牦牛瘤胃发酵及甲烷产量的影响
孙红梅,郝力壮*,冯宇哲,刘书杰,吴克选,牛建章
(1.青海省高原放牧家畜营养与生态国家重点实验室培育基地/青海省高原放牧家畜动物营养与饲料科学重点实验室,青海 西宁 810016;2.青海高原牦牛研究中心,青海 西宁 810016;3.青海大学畜牧兽医科学院,青海 西宁 810016)
青蒿提取物对牦牛瘤胃发酵及甲烷产量的影响
孙红梅1,2,3,郝力壮1,2,3*,冯宇哲1,2,3,刘书杰1,2,3,吴克选1,2,3,牛建章1,2,3
(1.青海省高原放牧家畜营养与生态国家重点实验室培育基地/青海省高原放牧家畜动物营养与饲料科学重点实验室,青海 西宁 810016;2.青海高原牦牛研究中心,青海 西宁 810016;3.青海大学畜牧兽医科学院,青海 西宁 810016)
为研究青蒿提取物对牦牛瘤胃液体外培养青藏高原高寒草甸四期牧草体外发酵及甲烷产量的影响,选取3头健康、年龄相近的瘘管牦牛为瘤胃液供体,采用体外产气法,全年四期牧草作为发酵底物,每期牧草分别添加0%、0.25%、0.5%、1.0%和2.0%的青蒿提取物,筛选最佳添加量。结果显示,青蒿提取物可在一定程度上增加不同期牧草体外发酵的累积产气量,显著增加慢速降解部分产气量和潜在产气量,并有改善牦牛瘤胃发酵的作用,促进短链脂肪酸(SCFA)生成,提高有机物质消化率(OMD),增加代谢能(ME)和泌乳净能(NEL)(P<0.05);在维持瘤胃正常发酵的条件下,青蒿提取物作为甲烷抑制剂在枯草期、返青期、青草期、枯黄期的适宜添加量分别为0.5%、2.0%、1.0%、0.25%。当返青期添加0.5%时抑制效果最佳。
青蒿提取物;牦牛;四期牧草;发酵参数;甲烷
青蒿提取物(Artemisinin)是一种具有过氧基的新型倍半萜类化合物,最早由我国研究者从青蒿中提取的抗疟疾药物,广泛应用于医药研究,近些年由于其抗虫性、可增强免疫等优势也在畜牧生产中逐渐应用起来。研究证明青蒿及其提取物能提高动物生长性能且提高机体免疫力[1-2],并能抗球虫和显著杀灭纤毛虫[3-4]。目前,反刍动物排放甲烷作为能量损失和温室气体日益受到关注,寻求有效抑制动物甲烷排放的绿色添加物成为研究热点。尽管已有报道青蒿提取物能显著抑制瘤胃产甲烷量[5-7],但至今在牦牛上的应用研究尚未见报道。因此,本研究采用体外产气技术,以青蒿提取物作为研究对象,高寒草甸草场全年不同物候期天然牧草作为发酵底物,研究各期牧草添加不同水平青蒿提取物时牦牛瘤胃发酵参数和产甲烷量,筛选全年不同物候期牦牛采食天然牧草的适宜添加量,为牦牛低碳生产提供技术支撑。
1 材料与方法
1.1 试验地点
在青海省高原放牧家畜营养与生态国家重点实验室培育基地、青海省高原放牧家畜动物营养与饲料科学重点实验室和青海省高原牦牛研究中心进行牧草营养成分测定,体外产气培养及相关指标评定。
1.2 试验材料
四期牧草样品采集结合青藏高原高寒草地实际情况,在三江源区核心区设置采样样地,采用1.0×1.0 m2样方,齐地面刈割,挑出不可食部分,称重并记录,风干称重带回实验室,粉碎过40目筛备用[8]。青蒿提取物为市售商品。
1.3 试验动物管理及日粮
选择健康、体重接近、相同年龄的安装有永久性瘤胃瘘管的3头牦牛作为瘤胃液供体,单独饲喂。试验日粮为燕麦青干草和小麦秸秆组成,全天自由采食,自由饮水,预饲15 d后,开始正试期,晨饲前采集瘤胃液,采集至保温瓶中迅速带到实验室。
1.4 试验方法
1.4.1 牧草常规养分分析法 粗蛋白质(CP)测定:半微量凯氏定氮法;粗脂肪(EE):采用索氏(Soxhlet)脂肪提取法;酸性洗涤纤维(ADF)和中性洗涤纤维(NDF):VanSoest法;干物质(DM):国标方法(GB/T 6435-86 );灰分(Ash):马福炉灼烧法;钙(Ca):高锰酸钾法(GB/T 6436-92);磷(P):钼黄显色光度法(GB/T 6437-92);非结构性碳水化合物(NFC)采用NRC(2001)[9]方法计算,公式为:100-(NDF+CP+EE+Ash)。四期牧草常规营养成分见表1。
1.4.2 体外产气法 分别以全年四期天然混合牧草作为发酵底物,四期牧草培养为四个单因素独立试验,底物为220 mg,另外设置空白组(仅瘤胃液和培养液),作为产气量校正。青蒿提取物添加水平为0%、0.25%、0.5%、1.0%、2.0%,每个水平设三个重复。通过瘤胃瘘管在晨饲前抽取牦牛瘤胃液混合后立即放入保温瓶中备用,防止微生物区系发生变化。采用Menke等[10]的方法准备缓冲液,并将缓冲液与瘤胃液以2∶1的比例混合。混合好的培养液在发酵前通入CO2保证厌氧环境后,分液至对应编号的培养管内(30 mL),放入水浴(39±0.5)℃的摇床上开始培养。
产气量的记录:从培养管放入培养箱中开始计时,在0 h、2 h、4 h、6 h、8 h、12 h、14 h、16 h、24 h、36 h、48 h各时间点快速读数记录。当读数超过80 mL时,为了防止气体超过刻度而无法读数,需要排气,收集气体到对应编号集气袋中,记录排气后的刻度值。
发酵参数测定:体外培养48 h后,将培养管取出放入冰水混合物中停止发酵。将发酵液排到50 mL玻璃管内,测定pH;取部分发酵液经离心(4 000 r/30 min),取上清液进行氨态氮(NH3-N)浓度测定,测定方法参照改进的比色法[11]进行。
产气量(mL)=该时间段内培养管产气量(mL)-对应时间段内空白管平均产气量(mL);
SCFA(mmol/L)=0.0222×GP-0.00425 (r2=0.94)[12];
OMD(%)=0.9042×GP+0.0492×CP+0.0387×CA+16.49 (n=85/r2=0.93);
ME (MJ/kg DM)=0.136×GP+0.0057×CP+0.000286×CP2+2.20(n=200/r2=0.94);
NEL (MJ/kg DM)=0.096×GP+0.0038×CP+0.000173×CP2+0.54(n=200/r2=0.93)[10]。
式中:GP为24 h净产气量(mL),CP为粗蛋白含量(%),EE为粗脂肪含量(%),CA为灰分含量(%)。
发酵气体甲烷含量测定委托兰州中科安泰分析科技有限公司进行测定。分析条件[13]为:仪器GC 3420(北分);检测器FID(氢火焰检测器);柱长30 m,内径0.53 mm,膜厚20 μm;柱温80 ℃;汽化温度120 ℃;检测温度130 ℃;进样量:10 μL。
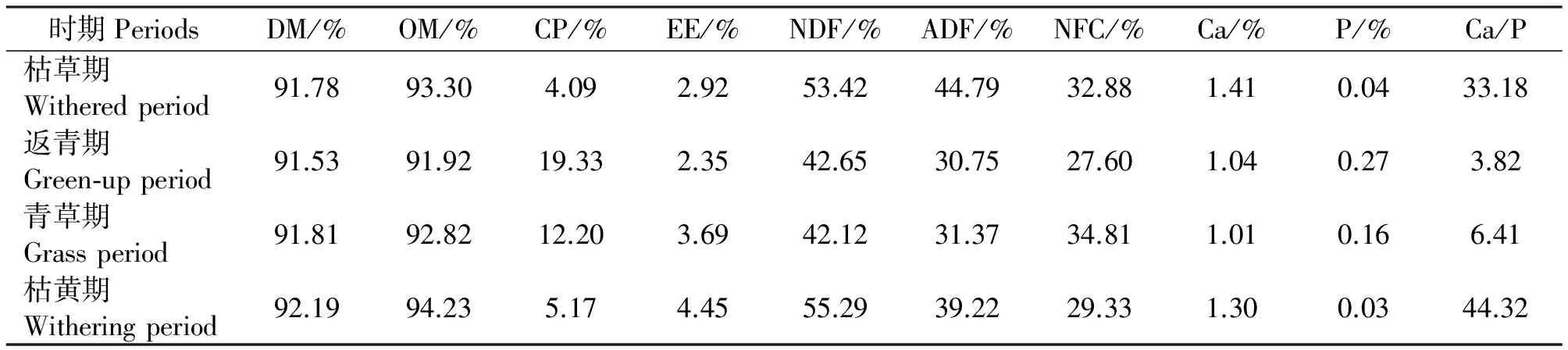
表1 全年四期高寒草地牧草常规营养含量(干物质基础)
产气动力学参数:分别将2 h、4 h、6 h、8 h、12 h、14h、16 h、24 h、36 h、48 h的累积产气量代入模型公式:
Y=A+B(1-e-ct)
式中:Y为时间t的产气量(mL/g),A为快速降解部分的产气量(mL/g);B为慢速降解部分的产气量(mL/g),c为慢速降解部分的产气速率常数(%/h)[14],A+B为潜在产气量(mL/g)[15]。
1.5 数据统计分析
采用Excel 2003进行数据的整理,SAS 9.1统计软件中单因素和双因素试验统计分析及Duncan新复极差法进行多重比较,P<0.05作为差异显著的判断标准。
2 结果与分析
2.1 不同添加水平青蒿提取物对四期牧草累积产气量的影响
由表2、表3可见,枯草期1.0%和2.0%青蒿提取物48 h累积产气量较对照(0%)组显著升高(P<0.05),0~48 h,2.0%组产气量均大于对照组,而0.25%和0.5%组均减少(P>0.05),对快速降解部分的产气量(A)无显著影响(P>0.05),慢速降解部分的产气量(B)呈上升趋势,1.0%和 2.0%组增大显著(P<0.05),潜在产气量(A+B)也升高,添加量0.25%以上时显著(P<0.05),对产气速率常数(C)影响不显著(P>0.05);在返青期,0.25%和0.5%组产气减少,48 h累积产气量较对照组减少(P<0.05或P<0.01),1.0%和2.0%组在发酵前8 h产气量下降,1.0%和2.0%组分别在36 h、12 h开始回升,48 h累积产气量1.0%组显著高于(P<0.05)对照组,0.5%组产气动力学参数B、C和A+B激增导致累积产气量的突然增大,其余与对照组均无显著差异(P>0.05);青草期牧草的体外产气量整体升高,但0.5%组前12 h较对照有所下降,48 h累积产气量均显著高(P<0.05),A和B总体较对照增大,A在0.25%和2%组显著,B在0.5%和1%组显著(P<0.05),各水平下A+B均增大(P<0.05),C均显著减小(P<0.05);在枯黄期牧草发酵期间,仅0.25%组产气量增大,其余组的产气量均低于对照,其中,0.5%和1.0%组48 h的累积产气量显著较低(P<0.05),对A和C影响不显著(P>0.05),0.25%组B和A+B升高(P>0.05),随添加量增大而下降(P<0.05)。
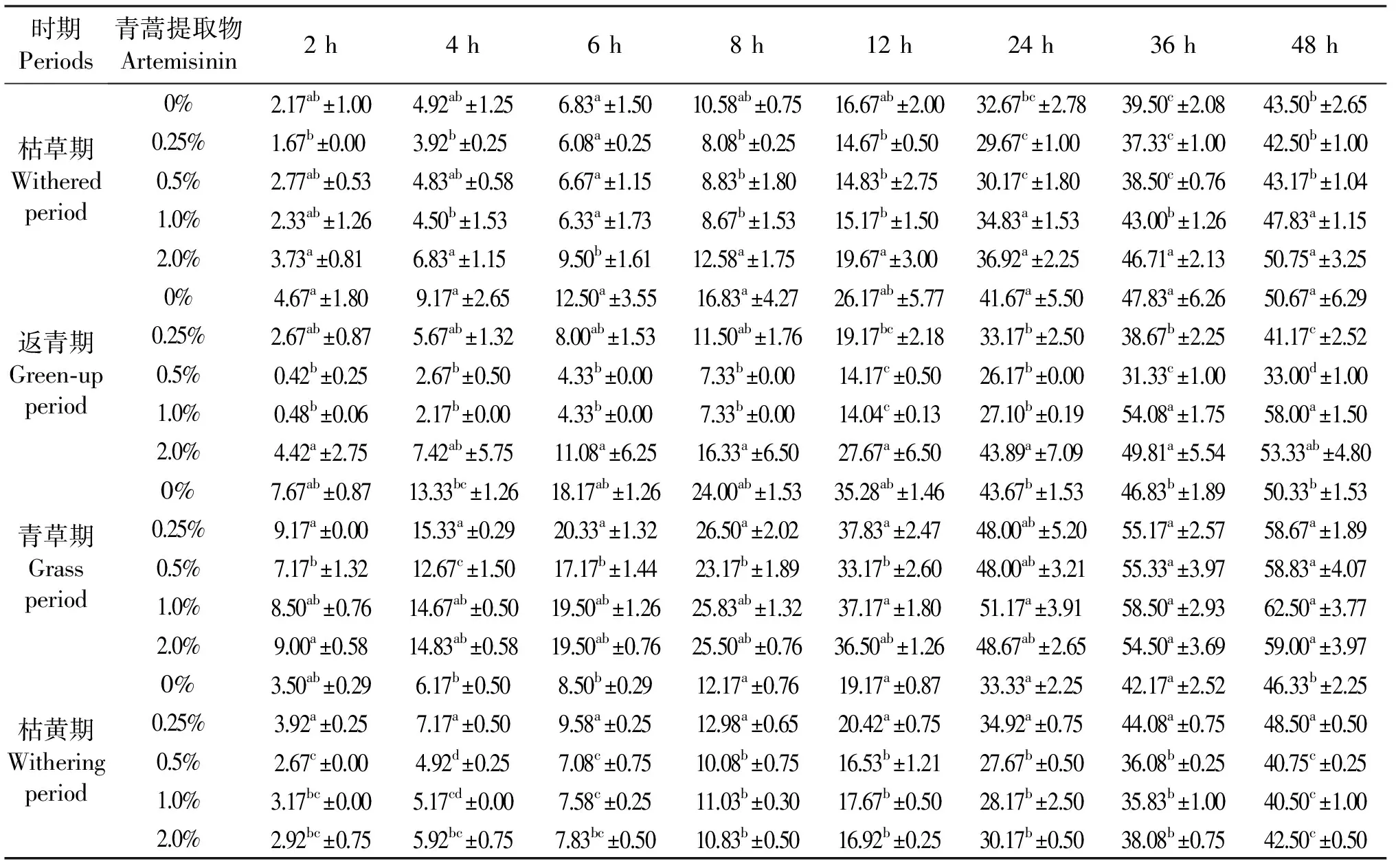
表2 四期天然牧草中添加青蒿提取物后体外培养条件下的累积产气量
注:同列肩标相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下同。
Notes:The same letter superscripts indicate no significant difference (P>0.05), and different letters mean significant difference (P<0.05).The same as below.
2.2 添加不同量青蒿提取物时四期牧草的发酵参数与甲烷产量
选取发酵液pH、NH3-N浓度、SCFA含量、OMD、ME和NEL为对比参数,检验青蒿提取物对甲烷生成量的影响。在各期试验中,添加青蒿提取物对发酵液的pH影响不显著(P>0.05),均维持在正常范围内,见表4。在各期试验中,青蒿提取物不同添加水平对发酵NH3-N浓度的影响不一致,枯草期和枯黄期的发酵因青蒿提取物存在导致NH3-N浓度上升,均为0.5%组增加幅度最大,返青期中,0.5%(P<0.05)和2.0%组(P>0.05)较对照增大,0.25%和2.0%组下降(P>0.05),青草期中,0.25%和2.0%组较对照下降(P>0.05),0.5%和1.0%组变大(P<0.05)。
同期试验中,青蒿提取物对SCFA含量、OMD、ME及NEL的影响一致。枯草期试验,当青蒿提取物0.25%和0.5%时,SCFA含量、OMD、ME及NEL较对照均下降,1.0%和2.0%组增大,差异均不显著青蒿提取物添加低于2.0%时,返青期4项参数较对照均显著下降(P<0.05),2.0%组时回升,较对照略高(P>0.05);青草期较对照均增大(P>0.05);对于枯黄期,0.25%组较对照使4项参数值略有提高,增大添加量后值下降,但差异均不显著(P>0.05)。
枯草期中,青蒿提取物0.25%、0.5%组可减少甲烷产量,而2.0%组较对照升高显著(P<0.05);对返青期,0.25%和0.5%组的甲烷产量均显著减少(P<0.05),而1.0%组(P<0.05)和2.0%组(P>0.05)甲烷产量增大;青草期时,不同水平青蒿提取物均使甲烷产量下降,其中1.0%组下降显著(P<0.05);枯黄期时,0.25%组甲烷产量较对照有小增幅(P>0.05),添加量增大时甲烷产量减少,1.0%组减小显著(P<0.05)。
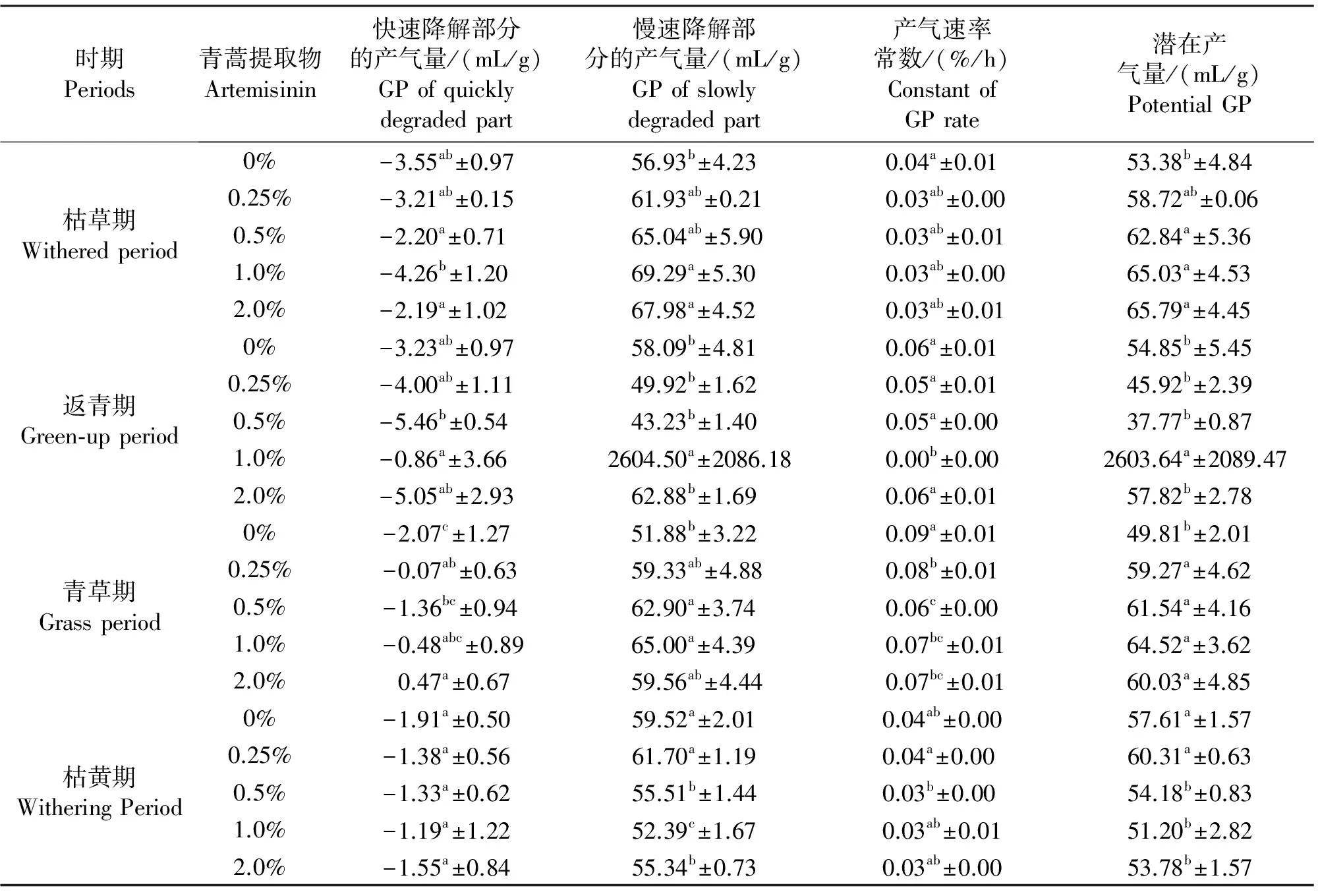
表3 青蒿提取物对牦牛体外发酵四期牧草各组分产气量的影响
2.3 不同期、不同青蒿提取物添加水平对牦牛体外发酵甲烷生成量的影响
从表4知,青草期的甲烷生成量均显著高于返青期、青草期和枯黄期(P<0.05),而这三期间甲烷生成量差异较小(P>0.05),不考虑各期间差异,对照组和添加量2.0%时甲烷生成量较大,0.5%组量最小,显著低于其余水平添加组(P<0.05)。由于不同期牧草与青蒿提取物不同添加水平之间对甲烷的生成量存在交互作用(P<0.05),即降低不同时期牧草甲烷产量需要不同添加量的青蒿提取物。本试验结果表明,随着青蒿提取物添加量增多,牦牛每kg采食量的甲烷生成量呈先下降后升高的趋势,在返青期添加0.5%的抑制效果最佳。
3 讨 论
3.1 青蒿提取物对牦牛瘤胃液体外培养四期牧草产气量的影响
瘤胃发酵产气主要来自饲料中OM的降解[10-16],这些气体包括VFAs、CO2、H2及甲烷等,反映饲料的可发酵程度,用以衡量饲料营养价值[7-17]。四期试验发现,添加青蒿提取物不影响体外正常发酵模式,但对牧草的降解率存在抑制和促进双重作用,表现为累积产气量的变动。
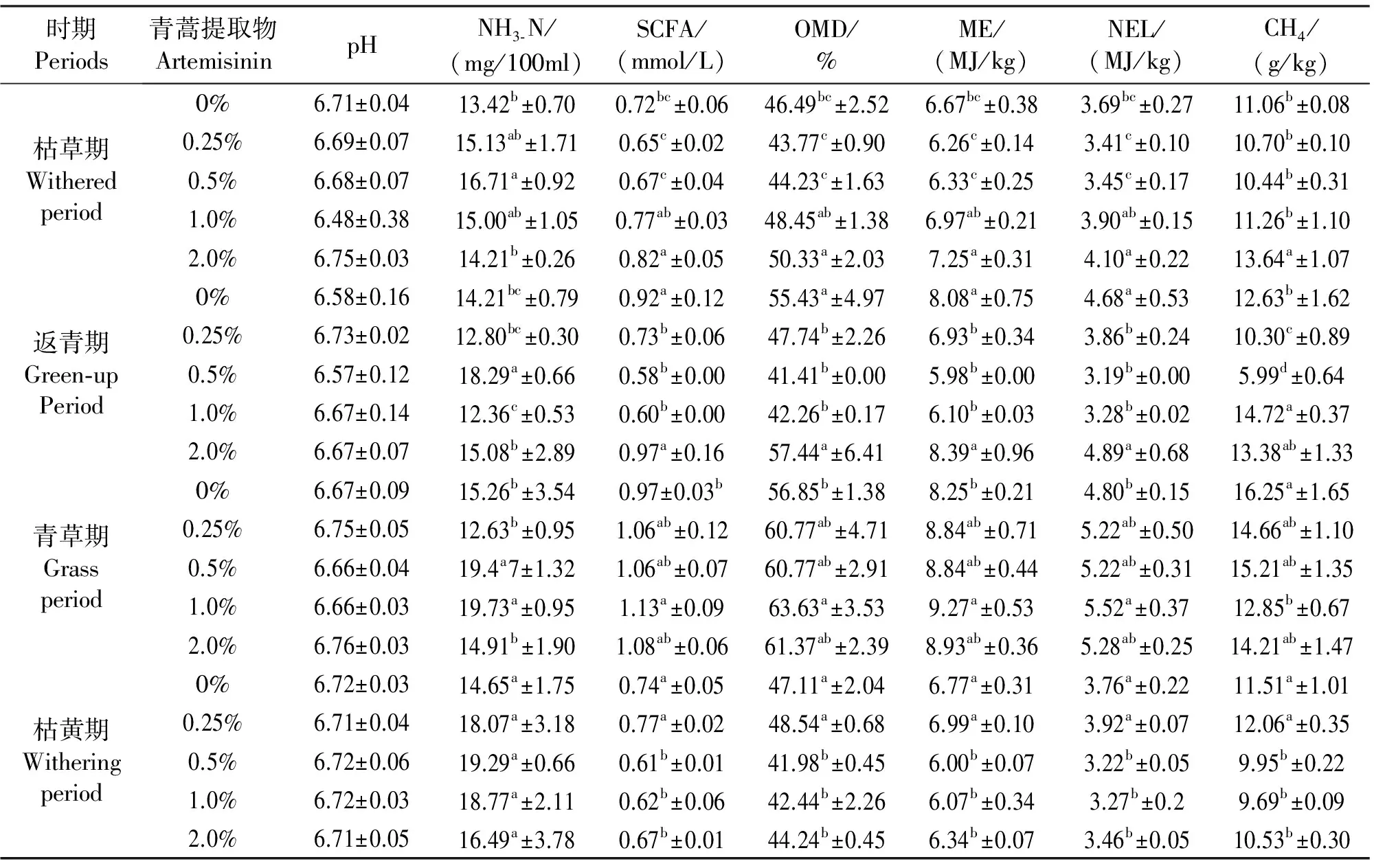
表4 添加青蒿提取物后发酵液的发酵参数与甲烷产量
利用产气动力学参数,可较直观发现产气量变化的原因。总体上, A的量较少,大量产气来自B,48 h累积产气量的统计值受B影响较大,C与产气量呈负相关关系。各期牧草添加青蒿提取物后,48 h累积产气量由A+B与B决定。不同水平青蒿提取物对发酵底物降解程度造成不同影响。在枯草期,添加青蒿提取物后产气量增大,A未受影响,相应发酵前8 h的产气量与对照差异不显著(P>0.05),而B的增大解释了12 h后产气量显著升高的现象,牧草的降解率提高,可能有促进了牦牛瘤胃纤维分解菌活性的作用;返青期时,A和B均有减小,产气量也随之下降,与秦韬[18]的研究偶合,他设计青蒿提取物添加量为0%~0.45%,发现添加后瘤胃细菌减少,原虫活性减弱,这可能是导致产气量下降的原因,但随添加量增多,发现瘤胃细菌蛋白会增多,细菌活性也增强,加大了饲料被分解程度[5],因此产气量提高,但1.0%组A和B均显著增大,因此48 h累积产气量升高,但前24 h产气量并未见升高,需要进一步求证;青草期A+B因青蒿提取物加入升高,因此累积产气量增大;枯黄期0.25%青蒿提取物可显著(P<0.05)促进纤维的分解,使48 h累积产气量显著升高(P<0.05),随添加量增多产气量减小,推测青蒿提取物可能会与牧草中某些成分产生拮抗作用,或抑制瘤胃微生物的活性,大量存在时作用效果明显,发酵受阻。
3.2 青蒿提取物对牦牛瘤胃液体外培养四期牧草各发酵参数的影响
瘤胃酸碱环境与动物消化机能密切联系,瘤胃细菌以及诸多作用酶对环境pH很敏感,维持瘤胃正常的酸碱环境对机体正常活动尤为重要[19]。本试验青蒿提取物对瘤胃发酵pH无影响,维持在6.45~6.78范围,均在正常变动范围内。氨态氮是饲料中蛋白氮和非蛋白氮降解的终产物,大部分会被瘤胃微生物利用合成MCP[20],成为反刍动物直接可利用的氮来源[21],其浓度是饲料分解和微生物利用情况的平衡动态值。一般,瘤胃内NH3-N浓度为6.58~36.7 mg/100mL[22],也有报道为6~30 mg/100 mL[23],变动范围较大。本试验中,NH3-N浓度为14.21±0.79~19.73±0.95 mg/100mL,均在正常范围内。四期试验0.5%组NH3-N浓度均高于(P<0.05)对照组,但随添加量增多又呈下降趋势,已有类似研究结果[18]。说明0.5%青蒿提取物可提高牧草中氮源的利用率,促进MCP合成,随添加量继续增大,瘤胃细菌的大量繁殖会抑制原虫蛋白合成,原虫密度减小,其特有的脱氨基作用减弱而导致NH3-N浓度下降;而青蒿提取物在低于0.5%时,促进瘤胃原虫类群的增殖和活性作用强于细菌,因此脱氨基作用加强,而NH3-N累积量增大。而也有试验发现青蒿提取物对NH3-N浓度的影响不大(P>0.05)[24],归结于不同添加量或发酵底物的选择而异,这也解释了本试验四期结论不一致的现象。SCFA含量、OMD、ME和NEL为饲料中碳水化合物等OM被反刍动物消化后的饲料表观能量转化效率,这4个能量参数值密切相关。SCFA也称挥发性脂肪酸(VFAs),大部分的碳水化合物经瘤胃微生物降解后,生成单糖或二糖,后经糖酵解过程转化为丙酮酸,最后分解为VFAs和ATP,为机体供给70%的能量[25]。OMD反映饲料中OM的转化利用效率,转化率越高,反刍动物所摄入饲料效价越高,可降低饲喂成本,提高养殖经济效益。试验中, SCFA含量减少,说明饲料碳水化合物的降解受到抑制, NH3-N浓度的增大促使大量非纤维降解菌争夺了合成菌体蛋白的优势,而导致纤维降解菌数量和活性受限,因此饲料OMD下降,能量转化效率降低;而SCFA含量升高,可能是青蒿提取物对纤维菌活性的促进作用变得显著的原因。添加青蒿提取物对四期试验SCFA影响不显著的结果同于王小晶等的报道[18-24]。由于枯草期的营养胁迫,青蒿提取物对能量转化率影响不显著(P>0.05);返青期中,较少青蒿提取物限制纤维分解菌的活性,或抑制生成SCFA的某些酶作用,致使SCFA含量、OMD、ME和NEL均减小;随着青蒿提取物添加量增大,促进纤维降解菌活性作用增强,有效提高饲料能量转化率。结合本试验,青蒿提取物对瘤胃转化饲料能量率不可一概而论,应全面考虑试验日粮、试验对象及添加量等多方面影响因素,而牦牛属于高寒地区畜种,拥有特殊的发酵模式,所以应深入研究青蒿提取物在牦牛瘤胃的作用机理。
3.3 青蒿提取物对牦牛瘤胃液体外培养四期牧草甲烷产量的影响
联合国专委会表示,每年仅反刍动物向大气中排放的甲烷量达85 Tg,占全球温室效应危害的2%左右[26],同时,反刍动物瘤胃甲烷的产生也浪费掉2%~12%[27]的饲料总能,面临高寒牧区天然草场日渐退化的压力,在可持续发展和减排温室气体的胁迫下,有效抑制甲烷的研究变得尤为重要。本试验发现青蒿提取物可有效减少牦牛瘤胃液体外发酵条件下的甲烷生成量。枯草期甲烷产量(g/kg)变化与其产气量及瘤胃发酵参数紧密相关,2.0%组促进瘤胃微生物的活性,使产气量、SCFA含量和OMD变大,产甲烷菌获得较多活性能量和甲烷合成底物,因此甲烷产量增大。返青期甲烷产量在青蒿提取物添加量为0.25%和0.5%时减少最显著(P<0.05),相应的能量转化率也下降,说明瘤胃微生物整体活性减弱。青草期牧草营养丰富且含量相对均衡,满足所有瘤胃微生物的生长需要,当青蒿提取物加入时,可能会使微生物的代谢活动失衡,阻碍产甲烷菌利用氢或限制原虫活性致使甲烷产生量下降。虽然各期试验都证实青蒿提取物确能减少牦牛瘤胃发酵后甲烷的生成,但造成这一结果的机理仍需要探索。有研究指出,添加青蒿提取物都会降低甲烷产量(P<0.05)[24],但对乙酸/丙酸比影响不显著(P>0.05),说明青蒿提取物不是通过改变饲料发酵生成的乙丙酸量去调节甲烷生成的,可能是青蒿提取物中有效成分改变原虫的活性,正如秦韬等[28]发现,通过荧光标记技术观测到原虫活性被抑制,瘤胃中原虫数、原虫蛋白量减少,较少的氢被释放,减少产甲烷菌可利用的氢浓度,限制了甲烷合成。
4 结 论
青蒿提取物在一定程度上能增加不同期牧草体外发酵的累积产气量,显著增加慢速降解部分产气量和潜在产气量。青蒿提取物可在一定程度上改善牦牛瘤胃发酵状况。作为牦牛甲烷抑制剂,青蒿提取物在枯草期、返青期、青草期、枯黄期的推荐添加量分别为0.5%、2.0%、1.0%、0.25%;在返青期添加0.5%的抑制效果最佳。
[1] 潘存霞,刘卢生,张 敏,等.青蒿提取物对獭兔生长性能和免疫功能的影响[J].饲料博览,2007(11):9-12.
[2] 韩洪英,陈东颖,全瑞兰,等.青蒿提取物作为饲料添加剂对断奶仔猪生产性能的影响[J].饲料工业,2011,32(6):5-6.
[3] 戴小军,刘延庆,梅全喜.蒿属药用植物药理活性研究进展[J].中药材,2005,28(3):243-247.
[4] 席世玲,高 玲,赵 瑾,等.青蒿素的药理作用及其在畜牧生产中的应用[J].上海畜牧兽医通讯,2009(6):64-66.
[5] 王洪荣,郝志敏,李世霞,等.植物次生代谢产物对瘤胃发酵调控的研究进展[J].动物营养学报,2010,22(6):1 471-1 476.
[6] 张志红,黄江丽,田晓娟,等.几种植物提取物对瘤胃体外培养物甲烷生成的影响[J].江西科学,2011,29(1):43-46.
[7] 王小晶,董国忠,刘智波.青蒿提取物和大黄对山羊瘤胃发酵和甲烷产量的影响[J].畜禽业,2009(4):52-55.
[8] 郝力壮,王万邦,王 迅,等.三江源区嵩草草地枯草期牧草营养价值评定及载畜量研究[J].草地学报,2013(1):56-64.
[9] NRC.Nutrient requirements of dairy cattle[M].7thed.Washington,D C:National Academy Press,2001.
[10] Menke K H,Steingass H.Estimation of the energetic feed value[J].Animal Research and Development,1988,28:7-55.
[11] 冯宗慈,高 民.通过比色测定瘤胃液氨氮含量方法的改进[J].内蒙古畜牧科学,1993(4):40 -41.
[12] Makkar H P S.In vitro gas method for evaluation of feeds containing phytochemicals-a review[J].Animal Feed Science and Technology,2005,123- 124(1):291-302.
[13] 郭雪峰.内蒙古白绒山羊甲烷产生量估测模型的建立及其影响因素的研究[D].呼和浩特:内蒙古农业大学,2008.
[14] Ørskov E R,Mcdonald I.The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J].Journal of Agricultural Science,1979,92:499-503.
[15] 黄雅莉,邹彩霞,韦升菊,等.体外产气法研究半胱胺对水牛瘤胃发酵参数和甲烷产量的影响[J].动物营养学报,2014,26(1):125-133.
[16] Menke K H,Raab L,Salewski A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquor in vitro[J].Journal of Agricultural Science,1979,93:217-222.
[17] 哈斯花.体外发酵产气技术在饲料营养价值评定中的作用[J].当代畜禽养殖业,2013(1):15-19.
[18] 秦 韬.青蒿素对山羊瘤胃发酵和微生物氮素微循环的影响[D].扬州:扬州大学,2010.
[19] NRC.Nutrient requirements of beef cattle[M].7thed. Washington,D.C.: National Academy Press,1996:85-97.
[20] Leng R A,Nolan J Y.Nitrogen metabolism in the rumen[J].Journal of Dairy Science,1984,67(5):1 072-1 089.
[21] Bandle S V,Gupta B N. Rumen fermentation,bacterial and total volatile fatty acid(TVFA) production rates in cattle fed on urea-molasses-mineral block licks supplement[J].Animal Feed Science and Technology,1997,65:275-286.
[22] Coleman G S,Sandford D C.The uptake and utilization of bacteria, amino acids and nucleic acid components by the rumen ciliate Eudiplodinium maggii [J].Journal of Applied Bacteriology,1979,47:409.
[23] 王加启,李树聪.不同日粮类型对奶牛营养代谢影响的研究//动物营养研究进展[C].北京:中国农业科技出版社,2004:124-133.
[24] 王小晶.不同日粮中添加酸化剂、植物提取物和中草药对山羊体外发酵剂甲烷产量的影响[D].重庆:西南大学,2009.
[25] 卢德勋.反刍动物营养调控理论及其应用[J].中国动物营养学报,1994(1):51.
[26] 王嘉厚.反刍动物甲烷产生与控制措施[J].畜禽业,2013(10):46.
[27] Johnson K A, Johnson D E.Methane emissions from cattle[J].Journal of Animal Science,1995,73:2 483-2 492.
[28] 秦韬,王洪荣,朱素华,等.青蒿素对山羊瘤胃发酵参数、原虫数量及产气量的影响[J].上海畜牧兽医通讯,2010(2):37- 39.
Effect of Artemisinin on Rumen Fermentation and Methane Emissions of Yak
SUN Hong-mei1,2,3,HAO Li-zhuang1,2,3*,FENG Yu-zhe1,2,3,LIU Shu-jie1,2,3,WU Ke-xuan1,2,3,NIU Jian-zhang1,2,3
(1.StateKeyLaboratoryofCultivatingBaseofPlateauGrazingAnimalNutritionandEcologyofQinghaiProvince/KeyLaboratoryofPlateauGrazingAnimalNutritionandFeedScienceofQinghaiProvince,Xining,Qinghai810016; 2.QinghaiPlateauYakResearchCenter,XiningQinghai810016;3.QinghaiAcademyofScienceandVeterinaryMedicine,QinghaiUniversity,Xining,Qinghai810016)
This article studied the effect of artemisinin on Qinghai-Tibet Plateau alpine meadow pastures' fermentation and methane emissions in vitro in the four periods yearly.3 fit and fistulad yaks were selected as the rumen gastric juice donor for in vitro GP test and fermentation substrate. Yearly four periods pastures were added 0%,0.25%,0.5%,1.0% and 2.0% artemisinin, respectively, to screen optimum additive amount. Results showed artemisinin could increase the cumulative gas production(GP),GP in slowly degraded part and potential GP of each period to some extent, improved fermentation inner yak rumen, promoted the production of short chain fatty acids(SCFA),and the digestibility of organic matter(OMD),and increased metabolism energy(ME)and net energy lactation(NEL)(P<0.05).Maintaining the normal rumen fermentation conditions, the optimum additive amount of artemisinin as methane inhibitors in withered period, green-up period, grass period and withering period were 0.5%,2.0%,1.0% and 0.25%,respectively,and 0.5% in green-up period performed the best inhibition effect.
artemisinin; yak; four periods pastures; fermentation parameter; methane
2014-10-08
2014-12-10
青海大学中青年科研基金(2011-QNY-8);国家重点基础研究发展计划(973项目)(No. 2012CB722906);国家自然科学基金(31060315)
孙红梅(1990-),女,陕西韩城人,在读硕士,主要从事动物营养与饲料开发研究。E-mail:342597521@qq.com
*[通讯作者] 郝力壮(1984-),男,河北邢台人,副研究员,研究方向:反刍动物营养。E-mail:lizhuanghao1122@foxmail.com
S811.6
A
1005-5228(2015)08-0034-07

