蒙药扎冲十三味丸对大鼠缺血性脑损伤后海马组织细胞凋亡影响的初步研究*
刘鑫 陶春 林琳
扎冲十三味丸出自《蒙医经典》[1],又名嘎日迪十三,在蒙医临床中是最常用的首选传统方剂之一,主要用于心脑血管和神经系统疾病的治疗[2],经临床证实,对于脑血栓、脑梗死、脑萎缩、脑中风偏瘫、言语不清等脑血管病、心肌缺血等疾病有明确疗效[3-6]。扎冲十三味丸目前虽然在临床治疗方面已经显示出较为确切的疗效,近年来很多学者致力于从作用机理、作用靶点等方面为此药提供理论依据,实验结果证实扎冲十三味丸可以保护血脑屏障,可以减轻氧自由基对细胞的损害[7],减轻缺血后脑组织水肿[8]。明确此药的作用机理,对于扎冲十三味丸的进一步开发和应用具有重要意义。
细胞凋亡与脑缺血再灌注后的损伤关系密切,且在脑梗死的发生、发展过程中发挥重要作用[8-9]。脑缺血及再灌注损伤后及时进行抗凋亡治疗具有重要意义。本研究拟通过诱发小鼠脑梗死缺血缺氧引起神经细胞损伤后,从凋亡的角度研究扎冲十三味丸对脑缺血性损伤的保护性,研究其作用机理,从细胞和分子水平上阐明蒙成药扎冲十三味丸的作用机制。
1 材料与方法
1.1 试剂及仪器 扎冲十三味丸,PBS,annexin-V-FITC/PI细胞凋亡检测试剂盒(购自上海贝博生物试剂公司),BD Calibur流式细胞仪,BD公司产品;bax/bcl-2 Elisa试剂盒(购自天津海晶精细化工厂),酶标仪,MK3型,芬兰雷勃公司。
1.2 动物与分组 清洁级SD大鼠,雌雄均可,共72只,重量180~210 g,购自吉林大学实验动物中心(许可证号吉2007-0003),动物分笼饲养(环境温度24~26 ℃,湿度60%~70%),自由饮水,术前12 h禁食。将大鼠随机分为三组:正常对照组、模型组、给药组。模型组和给药组根据术后处死时间不同,又分作1、3、5、7 d组。每组各8只大鼠。
1.3 模型制备 制作SAH模型,采用大鼠自体颅内血经枕大池二次注射。配制10%水合氯醛(0.35/100 g)于腹腔注射麻醉后,在操作台上将大鼠俯卧位固定,安尔碘常规消毒,项部备皮。取左右耳根部连线的中点,沿正中线纵向切开颈部皮肤,将枕骨、环椎及环枕膜暴露于视野下,用1 mL注射器针头将环枕膜刺破后再微微推进至枕大池,待有脑脊液流出后,自大鼠左眼球后静脉丛抽取0.3 mL自体血,无需抗凝,随后按照0.15 mL/100 g(体重)标准,将自体非抗凝血以0.1 mL/min的注射速度缓慢注入大鼠枕大池。用明胶海绵压迫穿刺点3 min,缝合切口。将大鼠俯卧位30 min,并保持头低30°体位,以利于血液凝固并沉积在脑底血管周围。待大鼠保温复苏至清醒后,可自由饮食饮水。48 h后同样操作方法制作大鼠脑梗死模型。嘎日迪-13味丸组在手术第2天开始给嘎日迪-13味丸灌胃。在第2次注射后第1、3、5、7天取脑待检。
1.4 模型成功标志 待大鼠自然苏醒后,根据Longa 5分制评分标准,对大鼠神经功能缺失进行评分。无明显损伤症状者为0分;对侧前爪不能完全伸展者为1分;行走时肢体向对侧旋转者为2分;行走时向对侧倾倒者为3分;意识丧失,不能自发行走者为4分。评分结果在1~3分内的鼠为有效模型。剔除未入选及死亡的大鼠,每组剩余6只。
1.5 给药方法 按照2%的浓度,将扎冲十三味丸用蒸馏水配制成溶液,灌胃给药,每日1次,模型组大鼠均喂予蒸馏水。正常对照组大鼠置同一环境下饲养。
1.6 标本取材 待第2次注血后,在第1、3、5、7天分别采用断头法处死各组大鼠,迅速取出脑海马组织。全部取材过程置于冰盒上进行。
1.7 凋亡细胞的检测 将取出的海马组织置于金属细胞筛上,用玻璃注射器芯研磨,并用显微镜下观察,待研磨成单细胞后,加入PBS离心10 min,弃上清后取沉淀用PBS稀释至10 mL,反复吹打制成单细胞悬液,经400目细胞筛过滤,调整细胞浓度至1×106/mL,按照试剂盒操作步骤,取1 mL细胞悬液,依次标记annexin-V-FITC和PI,上机检测,检测结果进行统计学处理。
1.8 Bcl-2、Bax蛋白的表达检测 取海马组织研磨后离心的上清液,加50 μL于反应孔内,然后立即加入50 μL的生物素标记的抗体,37 ℃温育1 h,洗涤后每孔加入60 μL的亲和链酶素-HRP,37 ℃温育30 min,洗涤后每孔加入底物A、B各50 μL,37 ℃温育10 min。加入50 μL终止液,在450 nm波长处测定各孔的OD值。计算Bcl-2、Bax蛋白的浓度。
1.9 统计学处理 使用SPSS 17.0统计分析软件,计量资料以(x-±s)表示,组间比较采用方差分析,两两比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 各组凋亡细胞检测结果比较 模型组各时间点中细胞凋亡率均高于正常对照组(P<0.05),造模成功;给药组中,各时间点与相应时间点模型组比较,凋亡率显著降低,与正常对照组相比较亦有明显降低(P<0.05)。见表1。
2.2 各组Bax、Bcl-2蛋白的表达检测比较 模型组Bax蛋白表达水平均高于正常对照组的(40.53±3.39)pg/mL;给药组与模型组相比较,Bax蛋白表达减少,其中1 d和5 d组有显著差异(P<0.05)。模型组Bcl-2蛋白表达水平均低于正常对照组的(24.71±1.44)pg/mL;给药组与模型组相比较,各时间点Bcl-2蛋白表达均增高(P<0.05)。见表2。
表1 蒙药扎冲十三味丸对海马组织流式细胞仪的检测数据(±s) %

表1 蒙药扎冲十三味丸对海马组织流式细胞仪的检测数据(±s) %
组别 7 d 5 d 3 d 1 d给药组(n=6)0.43±0.19 0.30±0.35 0.20±0.02 0.13±0.09模型组(n=6)7.05±2.60 2.08±0.80 3.94±2.47 1.50±0.35正常对照组(n=6)1.13±0.14 1.13±0.14 1.13±0.14 1.13±0.14
表2 蒙药扎冲十三味丸对缺血缺氧脑海马组织Bax蛋白和Bcl-2蛋白的影响(±s) pg/mL
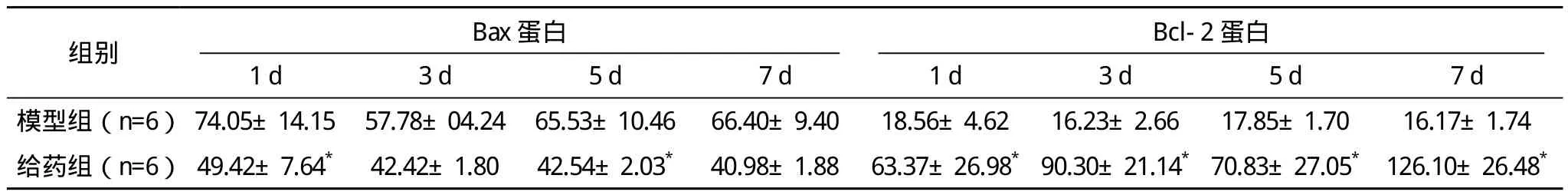
表2 蒙药扎冲十三味丸对缺血缺氧脑海马组织Bax蛋白和Bcl-2蛋白的影响(±s) pg/mL
*与模型组比较,P<0.05
Bcl-2蛋白组别 Bax蛋白1 d 3 d 5 d 7 d 1 d 3 d 5 d 7 d模型组(n=6) 74.05±14.15 57.78±04.24 65.53±10.46 66.40±9.40 18.56±4.62 16.23±2.66 17.85±1.70 16.17±1.74给药组(n=6) 49.42±7.64* 42.42±1.80 42.54±2.03* 40.98±1.88 63.37±26.98*90.30±21.14*70.83±27.05* 126.10±26.48*
3 讨论
缺血性脑损伤中细胞死亡机制包括细胞坏死和细胞凋亡,坏死发生迅速且不可逆,目前没有办法可以干扰这一过程。而在梗死灶周边的缺血半暗带区内,细胞坏死和凋亡共存,如不能进行及时有效的治疗,会向着不可逆性损伤发展,细胞启动凋亡程序存在一段时间延搁,抓住这段机间进行有效治疗可以在一定程度上逆转缺血后的脑损伤。
本实验通过流式细胞术检测凋亡细胞数量变化来探讨扎冲十三味丸在缺血发生后对神经细胞的保护作用。流式细胞检测结果显示,正常对照组仍有少量凋亡细胞,可能是脑组织细胞生长发育过程中发生的生理性凋亡以及手术刺激引起的凋亡;模型组各时间点凋亡细胞均较正常对照组显著增多,证实脑缺血引发细胞损伤过程中,细胞凋亡确实是一种重要损伤形式;扎冲十三味丸给药组所有时间点细胞凋亡率均显著少于与模型组,显示扎冲十三味丸可以明显降低脑缺血损伤后神经细胞凋亡的程度 ,通过抗凋亡的机制对脑神经细胞起到保护作用。本课题组其他实验已经证实[10]扎冲十三味丸能够减小脑组织梗死范围,给药组脑梗死范围比实验组有明显减小,说明扎冲十三味丸可以通过缓解神经细胞凋亡,达到逆转缺血性损伤的目的,起到对脑缺血损伤神经的保护作用。
目前认为细胞凋亡主要有两条途径,凋亡受体途径及线粒体途径[11]。胞外刺激和胞内刺激往往启动线粒体途径[12]。Bax蛋白和Bcl-2蛋白主要分布在线粒体外膜、内质网及胞质面上,Bax蛋白能在线粒体膜上形成孔道,使细胞色素C等小分子物质进入胞质从而促进凋亡的发生,Bcl-2蛋白能通过封闭孔道,调控线粒体膜电位等方式抑制凋亡[13]。而本实验选择Bcl-2蛋白家族成员中Bax蛋白和Bcl-2蛋白进行研究,Elisa检测结果显示,模型组大鼠脑梗死灶中,对于促进凋亡的Bax蛋白,蛋白表达水平均高于正常对照组,提示缺血大鼠脑组织的损伤中有Bax促凋亡机制的参与,而给药组与模型组相比较,Bax蛋白表达量减少。说明通过药物治疗后,促凋亡蛋白表达下降。在检测抑制凋亡的Bcl-2蛋白时显示,模型组蛋白表达水平均低于正常对照组,给药组蛋白表达量均显著高于模型组,以上结果提示扎冲十三味丸可以增加bcl-2蛋白表达量,同时下调bax蛋白表达,促进Bcl-2同源二聚体形成,通过线粒体凋亡途径从而发挥抗凋亡作用。
从上述结果可以看出,辅以扎冲十三味丸能够更大限度的缓解神经细胞凋亡的发生,从而起到保护脑细胞及神经功能的作用。这一结果符合目前广泛采用的急性脑梗死治疗的抢救原则,即降低病灶半暗区中受损脑细胞的凋亡程度[14]。同时,减少细胞凋亡发生,能够缓解脑缺血恢复血液再灌注后的损伤[15-19]。综上所述,扎冲十三味丸可以通过减少神经细胞凋亡,阻止梗死范围扩大,达到逆转缺血性损伤的目的,同时减轻恢复血液再灌注后的进一步损伤。在脑缺血发生后,应用扎冲十三味丸能够对缺血性脑损伤海马组织中的神经细胞起到很好的保护作用。
[1]中国百科全书编委会.中国医学百科全书·蒙医药[M].上海:上海科学出版社,1985.
[2]韩国珍,温爱平.高效液相色谱法测定扎冲十三味丸中木香烃内酯和去氢木香烃内酯的含量[J].中国药物与临床,2007,7(10):796-797.
[3]王玉山. 扎冲十三味丸治疗脑梗死400例临床疗效观察[J].中国民族医药杂志,2005,6(10):3.
[4]满达. 扎冲十三味丸治疗短暂性脑缺血发作[J].中国民族医药杂志,2005,6(12):6.
[5]刘阳姣.扎冲十三味丸治疗脑梗死60例临床观察[J].中国当代药,2012,19(4):110-111.
[6]林芳华,彭永宏,江顺.沉香叶提取工艺及其抗氧化活性实验研究[J].中草药,2012,43(3):613.
[7]彭春梅,韩瑞兰.蒙药扎冲十三味丸对大鼠心肌缺血再灌注损伤的保护作用[J].时珍国医国药,2013,24(2):363-364.
[8]乔海霞,杨玉梅,武海军.蒙药扎冲十三味丸片对局灶性脑缺血血脑屏障的保护作用[J].中国药理学与毒理学杂志,2012,26(3):416.
[9] Sun G L,Han Y K,Li G Q.Study on the ultrastructure of apoptosis after cerebral hypoxia-ischemia in the neonatal rat[J].Chin J Perinat Med,1999,2(1):21-23.
[10]陶春,林琳,宋葆华.蒙成药扎冲十三味丸对预处理急性脑梗死大鼠的影响[J].中国老年学杂志,2014,2(34):693-694.
[11] Danial N N, Korsmeyer S J. Cell death:critical control points[J].Cell,2004,116(45):205-219.
[12]周建华,丛国正,高闪电.细胞凋亡的研究进展[J].生物技术通讯,2008,19(2):274-276.
[13] Behrens T W, Mueller D L. Bcl-x and the regulation of survival in the immune system[J]. Immuonl Res,1997,16(12):149-160.
[14]张建伟,徐辉,邵瑞芳.依达拉奉对急性脑梗死神经功能缺损及C-反应蛋白水平的影响[J].中外医学研究,2014,12(16):38-39.
[15] Jie Pan,Angelos-Aristeidis Konstas,Brian Bateman,et al.Reperfusion injury following cerebral ischemia pathophysiology,MR imaging and potential therapies[J].Neuroradiology,2007,49(2):93-102.
[16]先雄斌.脑缺血再灌注损伤后神经元损伤机制的研究进展[J].海南医学,2008,19(1):131-134.
[17]王晓哲,李金国,王海英.灵芝对大鼠脑缺血再灌注后神经细胞凋亡率及线粒体跨膜电位的影响[J].中国医学创新,2009,6(20):15-18.
[18]臧福才,唐伟,白鹰.丁苯酞对大鼠脑缺血再灌注损伤神经保护作用的研究[J].中国医学创新,2013,10(9):15-16.
[19]任岩,曹余恒,李杰萍.补阳还五汤对大鼠脑缺血再灌注损伤后神经细胞凋亡Caspase-3基因表达的影响[J].中国医学创新,2014,11(13):16-18.

