腹腔镜下远端胃癌根治术38例临床分析
冯疆勉 谢伟 梁文杰
我国是胃癌大国,流行病学调查显示发生率约为33.14/10万[1]。胃癌好发于胃窦部[2]。根治性手术切除仍然是胃癌患者获得治愈的唯一途径。近年来腹腔镜胃癌手术得到了不断的发展和完善,但镜下解剖的复杂性及有别于传统开腹手术的视野和操作使手术难度增大,加上人们对腹腔镜手术能否达到与开腹手术相同的根治效果存有疑虑,也制约了腹腔镜胃癌手术的开展[3-4]。本院2011年12月-2013年12月期间为38例胃窦癌患者施行腹腔镜下远端胃癌根治术(Laparoscopy-assisted distal gastrectomy,LADG)。对该术式的可行性和价值进行探讨,现报道如下。
1 资料与方法
1.1 一般资料 选取本院2011年12月-2013年12月收治的76例胃窦癌患者,术前均经胃镜检查明确溃疡或肿物位置在胃窦部,胃镜取检:52例为腺癌,8例为印戒细胞癌,11例重度不典型增生,5例慢性溃疡。随机分为两组,研究组38例行腹腔镜下远端胃癌根治术;对照组38例采用传统开腹胃癌根治术。两组患者在年龄、性别、病理分期等方面比较差异无统计学意义(P>0.05),具有可比性,见表1。
1.2 入选标准 本研究经院伦理委员会批准,患者家属知情同意并在手术同意书上签字。入选标准:(1)胃窦癌诊断明确,或虽无病理,但胃镜高度可疑溃疡恶变;(2)术前检查无远处转移的依据;(3)CT检查提示肿瘤直径<6 cm,且胃周血管根部,腹膜无明显肿大融合的淋巴结,胃周器官无侵犯;(4)可耐受腹腔镜手术。
1.3 手术方式
1.3.1 研究组 (1)术前准备同传统开腹手术,气管插管全麻下,仰卧“人”字位,头高脚低15°,左侧操作时稍右倾,反之亦然,主刀在患者左侧,助手在右侧,扶镜手于两腿之间。CO2气腹压维持在13 mm Hg。戳孔位置:A点(观察孔):脐下3 cm;B点(主操作孔):左腹前线肋缘下1 cm;C点:脐水平线与左腹直肌外缘交点;D点:右锁骨中线肋缘下3 cm;E点:脐水平线与右腹直肌外缘交点。先行腹腔镜下探查,明确肿瘤位置和大小,38例患者病灶均在胃窦部,采用LADG。(2)胃周游离和D2淋巴清扫术,据日本最新版《胃癌处理规约》,胃窦癌D2淋巴结清扫范围为No.1、3、4sb、4d、5、6、7、8a、9、11p、12a[5]。14v 已不列入D2范围。贴横结肠离断大网膜,左至结肠脾曲,右至结肠肝曲,进入右下区域分离横结肠系膜前叶,将胃系膜和结肠系膜完全分离,系膜根部即可暴露胰头十二指肠、肠系膜上静脉,根部结扎切断胃网膜右静脉、动脉。清扫No.6(No.14v可清可不清)。向上追溯至胰颈,张紧胃左血管蒂,剥除胰腺被膜,清脾动脉近端的11p,逆向可顺序追溯至肝总动脉、腹腔干、胃左动脉,途中可结扎离断胃冠状静脉,清扫No.11p、7、9、8a,先向左清扫左下区域,分离结扎胃网膜左动静脉根部和1~2支胃短血管。清扫No.4sb、4d;至此胃体后壁可充分暴露,从左向右脉络化肝总动脉,完成No.8a清扫,转胃前操作,解剖肝固有动脉,根部结扎切断胃右动脉,完成No.8a、12a、5的清扫,近肝下缘离断肝胃韧带、胃小弯侧网膜、贲门右,清扫No.1、3。(3)胃切除和消化道重建,上腹正中切口5~6 cm,塑料膜保护切口,直视下切除标本,消化道重建首选毕Ⅰ式;肿物较大,毕Ⅰ重建困难选择Roux-en-Y或毕Ⅱ式。

表1 两组胃窦癌患者一般资料比较
1.3.2 对照组 采用传统开腹胃癌D2根治术。取上腹正中绕脐切口20~25 cm,术中探查、淋巴廓清、切除重建等内容与腹腔镜手术相同,手术操作顺序略有差异,采用逆向法,剥除胃结肠韧带,清扫No.6、(14v)、12a、5,先断十二指肠,再继续清扫No.8a、11p、7、9、4sb、4d、1、3,断胃并重建消化道。
1.4 观察指标 记录患者手术时间、术中出血量,测量切口长度、清除淋巴结数目、胃肠功能恢复时间、住院时间、并发症发生情况;所有患者均随访至2014年6月,跟踪复发情况和生存期。
1.5 统计学处理 应用SPSS 16.0统计软件进行数据分析,计量资料以(x-±s)表示,比较采用t检验,计数资料以率表示,比较采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较 研究组平均住院时间及平均胃肠功能恢复时间明显短于对照组(P<0.05);平均出血量明显少于对照组(P<0.05);平均切口长度短于对照组(P<0.05);平均手术时间、清除淋巴结数目两组无统计学差异(P>0.05)。见表2。
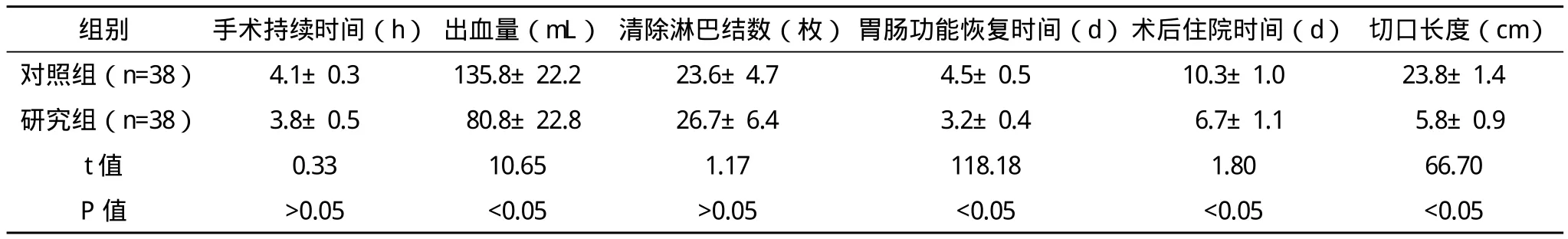
表2 两组手术相关指标比较(x-±s)
2.2 两组手术预后指标比较 两组均无手术死亡患者,所有患者均随访至2014年6月,研究组肝转移2例,对照组复发转移3例,死亡1例。研究组中转开腹2例(5.3%),术后并发症5例(13.2%),2例肺部感染,2例皮下气肿,1例腹腔感染。对照组并发症7例(18.4%),3例肺部感染,4例切口感染,其中1例合并反流性胃炎。两组手术并发症及复发转移均无统计学差异( 字2=0.872、0.190,P>0.05)。
3 讨论
LADG的适应证:腹腔镜辅助胃癌根治术自1994年日本Kitano等[6]首次报道,迄今已20年,国内外开展单位和报道例数逐渐增多[7]。手术适应证由早期胃癌逐渐扩展到较早期进展期胃癌,技术上日趋成熟,安全性和有效性在多个大型研究中心得到证实[8-9]。其微创的优势和代表未来胃癌外科发展方向越来越受到胃肠外科医生的关注和偏好。在亚洲,D2式被常规用于进展期胃癌的淋巴结廓清,但镜下解剖的复杂性和有别于传统开腹手术的视野和操作,导致D2淋巴结廓清的困难,这又是评价手术和判断预后的重要指标[10-11]。目前,比较一致的观点是:早期胃癌是腹腔镜手术的最佳适应证[12]。进展期仍然存在争议,对于分期超过T3N2者,不推荐腹腔镜胃癌根治术,因为镜下很难达到肿瘤根治手术的要求,研究组中2例Ⅲb期患者均需要中转开腹,原因分别是肝总动脉旁淋巴结的清扫困难和创面渗血。国情所限,胃癌,特别是占大多数的远端胃癌,就诊的患者多属进展期[2]。越来越多的研究表明,Ⅲa期适用腹腔镜手术[13]。有学者通过临床病理学发现,无淋巴结转移(N0)的以及局限于固有肌层的胃癌行LADG术后有良好的预后。最近日本和意大利有许多进展期胃癌LADG术后有着良好长期效果的报道。本次研究中Ⅲa患者44例,比例是57.9%,21例行LADG,从肿瘤学指标分析上看,并无明显差异性,部分手术相关指标优于开腹手术,所以,对大部分Ⅲa期远端胃癌患者,LADG是值得推荐的术式。
LADG的应用价值:LADG较开腹手术有微创优势,主要体现在术中出血少,辅助切口小,术后疼痛轻,由于胃肠无直接牵拉和暴露,术后胃肠功能恢复快,住院时间短等[14-15]。本次研究的结果也符合上述的特点,两组虽然在术后并发症上统计学无差异性,但研究组的肺部感染和切口感染的例数小于对照组。许威等[16]综述了国内外大型中心资料,认为腹腔镜技术以其术后疼痛轻、创伤小、胃肠功能恢复快、住院时间短、对机体免疫功能影响小等优势在胃癌的治疗中得到快速推广和应用。吴晖[17]报道38例腹腔镜胃癌根治术与开腹胃癌根治术,腔镜组综合生存质量、免疫及应激状态明显优于开腹组。
无论何种手术,都应以根治疾病、保证安全为前提,也即安全性和有效性。因此,腹腔镜胃癌根治术同样遵循与开腹手术相同的肿瘤学基本原则,即充分切除原发灶和周围受侵组织器官,保证足够的切缘,彻底淋巴结清扫,无瘤原则,在最重要的淋巴结清扫数目方面,本次研究组与对照组无统计学差异,与最新的国内报道相吻合[18]。本研究虽然近期效果满意,但缺乏远期数据支持,此前的一些研究显示,对于进展期胃癌患者,腹腔镜手术及开腹手术在长期疗效上亦无显著差异。Sato等[19]报道332例患者经过43个月的平均随访,开腹手术组Ⅱ期、Ⅲ期(JCGC 分期)患者术后 5 年无瘤生存率分别为 78.3%及 49.9%,而腹腔镜组术后 5 年无瘤生存率分别为81.5%、66.7%,两者间差距不存在统计学意义。可见,腹腔镜进展期胃癌根治术与开腹手术一样有较好的5年无瘤生存率。
LADG的不足:(1)早期手术时间延长;(2)规范化施行D2淋巴结廓清操作难度大于开腹手术;(3)医用耗材增加,是造成住院费用增加的主要原因。但患者住院时间缩短,切口感染等并发症减少,可以早期投入生产,带来隐形效益。
LADG开展需要克服的几个问题:技术难点集中在D2淋巴结清扫,特别是No.4sb、4d、5、8a,因为镜下解剖位置较深且毗邻脾脏、胃网膜左血管、胃右血管、肝总动脉,血管变异较大,术中容易出血渗血。笔者体会关键是以胰腺为中心,找准解剖平面,其次,采用No.6(No.14v)、11p、7、9、8a、4sb、4d、12a、5、1、3的淋巴结清扫手术路径可以更容易展开层面,降低手术难度,缩短手术时间,符合淋巴结的整块清扫。LADG手术时间普遍长于开腹手术,垃圾时间增多是重要因素,建立专业的腹腔镜胃手术培训基地和固定的手术团队,使手术操作规范化,团队配合无间也许是解决问题的方法。目前,腹腔镜手术的开展遍地开花,各地水平良莠不齐,缺乏统一的规范和标准,缺乏大宗病例的长期追踪研究也是亟待解决的问题。
综上所述,由于LADG的安全性及可行性,更由于其突出的微创优势,笔者认为LADG是今后早期乃至进展期远端胃癌治疗的可靠选择之一,值得临床推广应用。影响LADG开展主要还是规范D2淋巴结清扫所带来的技术难度及大众对此引发的肿瘤根治效果方面的疑虑,针对长期生存率的大样本前瞻性的随机对照研究,有助于验证LADG在肿瘤学意义上的安全性及有效性。
[1]邹文斌,李兆申.中国胃癌发病率及死亡率研究进展[J].中国实用内科杂志,2014,34(4):408-415.
[2]刘美红,贺海平,陈建思,等.广西肿瘤医院近10年胃癌临床流行病学分析[J].现代肿瘤医学,2013,21(12):2835-2838.
[3]余佩武.腹腔镜胃癌手术的进展和展望[J].中国普外基础与临床杂志,2011,18(2):105-109.
[4]李国新,陈韬.腹腔镜胃癌远端胃切除术后消化道重建术式选择[J/CD].中华普外科手术学杂志:电子版,2014,8(4):292-295.
[5]日本胃癌學會編.胃癌取扱い規約[M].第14版.東京:金原出版,2010:1-55.
[6] Kitano S,Iso Y,Moriyama M,et al.Laparoscopic-assisted Billroth I gastrectomy [J].Surg Laparosc Endosc,1994,4(2):146-148.
[7] Chen X Z,Li Y Y,Hu J K,et al.Spread and development of laparoscopic surgery for gastric tumors in mainland china:initial experiences[J].Hepatogastroenterology,2012,59(114):654-658.
[8] Kim H H,Han S U,Kim M C,et al.Prospective randomized controlled trail (phase Ⅲ) to comparing laparoscopic distal gastrectomy with open distal gastrectomy for gastric adenocarcinoma (KLASS 01)[J].J Korean Surg Soc,2013,84(2):123-130.
[9] Nam B H,Kim Y W,Reim D,et al.Laparoscopy assisted versus open distal gastrectomy with D2 lymph node dissection for advanced gastric cancer:design and rationale of a phase Ⅱ randomized controlled multicenter trial (COACT 1001)[J].J Gastric Cancer,2013,13(3):164-171.
[10]罗桂林,肖春明,李金龙.腹腔镜与传统开腹胃癌切除手术临床效果比较[J].中国医学创新,2012,9(11):17-18.
[11]王金林,黄石川,骆松辉,等.21例腹腔镜胃癌根治术临床应用分析[J].中外医学研究,2011,9(4):9-10.
[12]周雄.腹腔镜下胃癌根治术治疗早期胃癌的临床疗效比观察[J].中外医学研究,2014,12(36):34-35.
[13]权蕊良,赵旭辉,魏忠,等.腹腔镜手术与开腹手术治疗进展期胃癌的对比分析[J].医学综述,2014,20(21):3968-3970.
[14]阳普根.腹腔镜辅助胃癌根治术30例治疗分析[J].中国医学创新,2012,9(32):20-21.
[15]余高斌,金显峰.腹腔镜手术对胃癌患者术后应激反应的影响研究[J].中国医学创新,2014,11(29):60-62.
[16]许威,刘宏斌.腹腔镜胃癌根治术与开腹胃癌根治术对比研究的现状[J].医学综述,2013,19(6):1023-1025.
[17]吴晖.腹腔镜胃癌根治术对患者综合生存质量、免疫及应激状态的影响[J].海南医学院学报,2014,20(1):99-102.
[18]吴黎敏,张国烈,林庆凡,等.腹腔镜辅助胃癌D2根治术与开腹手术的病例对照研究[J/CD].中华临床医师杂志:电子版,2013,7(15):6833-6835.
[19] Sato H,Shimada M,Kurita N,et al.Comparison of long-term prognosis of laparoscopy-assisted gastrectomy and conventional open gastrectomy with special reference to D2 lymph node dissection[J].Surg Endosc,2012,26(8):2240-2246.

