肉桂对糖尿病大鼠海马突触可塑性的影响*
杨坦
糖尿病(diabetes mellitus,DM)和阿尔茨海默病(Alzheimer disease,AD)是临床上常见的慢性疾病[1-2]。阿尔茨海默病是以学习能力退化、记忆丧失和紊乱为特征的神经系统退行性病变,而糖尿病常出现广泛的并发症,包括外周和中枢神经系统损害[3-6]。阿尔茨海默病与糖尿病的关联受到越来越多的关注,据报道糖尿病患者患阿尔茨海默病的风险增高[7]。胰岛素失调导致脑内信号分子紊乱,伴随着出现认知障碍,但糖尿病学习记忆损伤的具体机制不明。海马是关联学习记忆功能以及神经系统重大疾病的重要结构,长时程增强(Long-term potentiation,LTP)一直被认为是海马参与学习记忆的基础方式[8]。肉桂(Cinnamomum cassia,CE)是临床中广泛应用的传统中药,具有补火助阳,引火归源,散寒止痛,活血通经的功效,神农本草经中将其誉为上品。近年来的研究发现肉桂具有抗糖尿病、抗氧化、抗炎的作用[9]。本文通过建立糖尿病模型,观察肉桂对糖尿病大鼠海马突触可塑性的影响,并探讨其潜在机制。现报道如下。
1 材料与方法
1.1 试剂与仪器 肉桂(产地:越南)购自河南省南阳市济康医药公司,粉碎机100目粉碎后备用;链脲菌素(streptozotocin,STZ)购于Sigma公司;BCA蛋白定量试剂盒(武汉博士德公司);N-甲基-D-天门冬氨酸受体2B亚型(NMDAR2B,NR2B)抗体及GAPDH抗体购自CST公司。江湾I-C型立体定向仪(第二军医大学器材处),RM6240B型多道生理信号采集处理系统(成都仪器厂),电泳仪及westernblot设备(Bio-Rad公司),不锈钢双极同芯电极(自制)。
1.2 实验动物处理方法 27只SD雄性大鼠,体重160~200 g,来自南阳医学高等专科学校实验动物中心。按随机数字表法将大鼠分为对照组、糖尿病组和肉桂组,每组9只。糖尿病组和肉桂组采用一次性腹腔注射STZ(65 mg/kg),注射用STZ配于0.1 mol/L柠檬酸缓冲液(pH 4.5),对照组注射同剂量的柠檬酸缓冲液。肉桂粉和生理盐水混合,肉桂组每天按照5 g/kg的剂量通过灌胃添加肉桂粉。28 d后开始断尾采血进行血糖测试,糖尿病组大鼠空腹血糖水平高于11 mmol/L,之后开始电生理实验,糖尿病组有2只大鼠在实验过程中死亡,死亡大鼠数据不列入统计。
1.3 海马CA1区细胞外电位记录 电生理测定的方法及参数同文献[10],刺激电极置于Schaffer侧支,记录电极在海马CA1区,单刺激诱导海马CA1区群体锋电位(Population spike,PS)。强直刺激诱发LTP。再给予单刺激2 h以上。记录强直刺激前后CA1区电位波形,用PS幅度作为评测指标,PS增幅=(强直刺激后PS幅度/强直刺激前PS幅度)×100%。
1.4 westernblot蛋白印迹检测 在电生理测定之后处死动物,取海马组织在裂解液中冰上裂解,离心机离心10 min(12 000 g,4 ℃),取上清液,通过BCA试剂盒进行蛋白定量测试,使单位样品蛋白总量保持一致,5%十二烷基硫酸钠聚丙烯酰胺(SDS)凝胶电泳,然后转至硝酸纤维素膜上,于含5%牛血清蛋白(BSA)TBS-T溶液中室温封闭2 h,含NR2B或GAPDH的抗体的TBS-T溶液(1∶1000)4 ℃孵化过夜,TBS-T溶液洗膜3次,每次10 min,碱性磷酸酶(AP)标记的山羊抗兔抗体中室温孵化1 h,重复洗膜3次,氯化硝基四氮唑兰(Nitroblue tetrazolium chloride,NBT)/5-溴-4-氯-3-吲哚基-磷酸盐(5-Bromo-4-Chloro-3-Indolyl Phosphate,BCIP)显色液显色,扫描的图像用Quantity one 1.0软件进行灰度值分析,NR2B相对蛋白水平用GAPDH做参照。
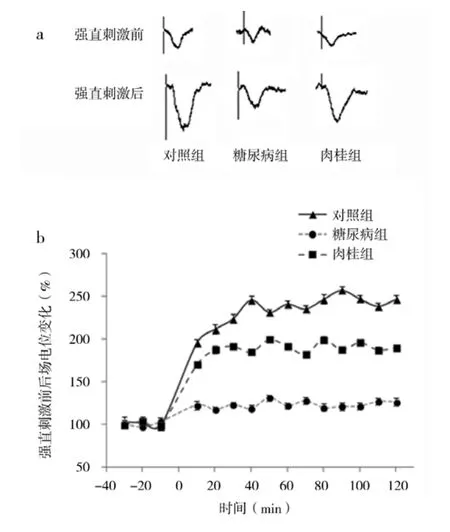
图1 各组强直刺激前后PS幅度变化注:a:各组强直刺激前后PS变化描记图;b:各组强直刺激前后场电位变化百分数,以强直刺激前30 min PS幅度平均值为100%,在横坐标上0时进行强直刺激
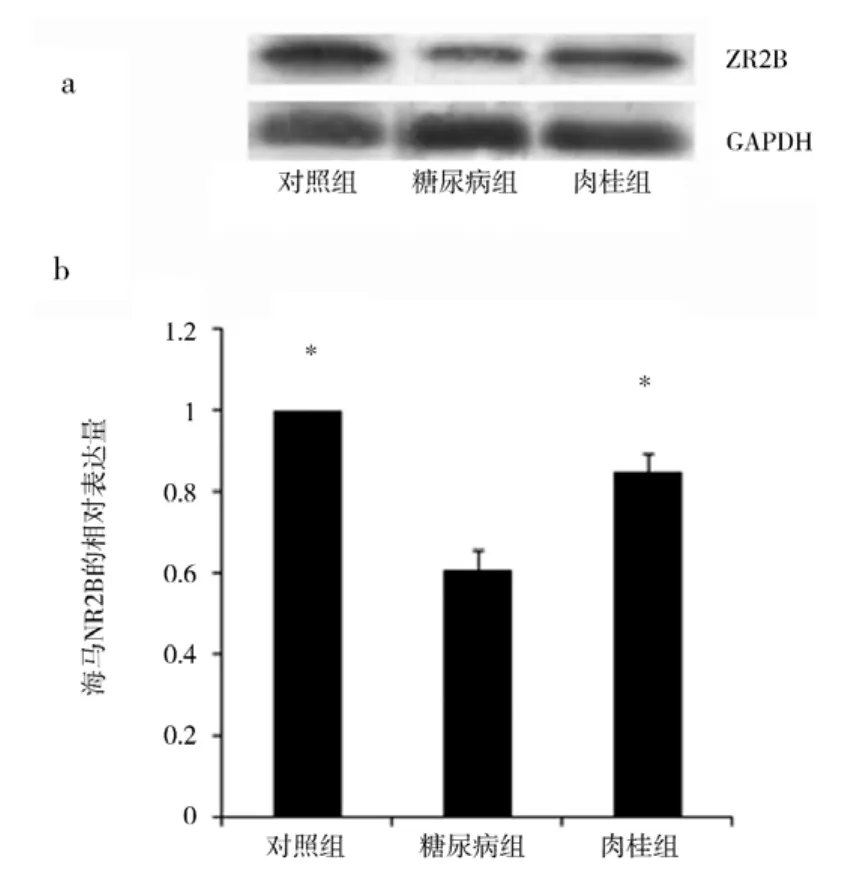
图2 各组海马脑组织中NR2B的表达注:a:NR2B在海马脑组织中的表达western-blot条带原始图例;b:westernblot方法测定NR2B表达量的比值,以对照组平均表达量为1。*与糖尿病组相比,P<0.05
1.5 统计学处理 统计学分析使用SPSS 19.0软件,Excel软件用于作图。所得数据均用(±s)表示,进行单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 海马脑电记录 单刺激Schaffer侧支纤维在25只大鼠海马CA1区均记录到幅度稳定的PS,平均幅度为(39.75±4.18)μV。对照组9只大鼠强直刺激后5 min开始观察到PS幅度增大至强直刺激前平均值的(195.46±3.87)%,最大增幅出现在强直刺激后90 min,为强直刺激前PS平均值的(257.15±3.64)%,这种突触传递效能的增强可维持2 h以上,即诱导出海马CA1区LTP。强直刺激前后PS幅值的差异有统计学意义(P<0.05)。糖尿病组7只大鼠强直刺激后PS平均增幅为(122.97±2.11)%,明显低于对照组的平均增幅(235.03±3.84)%(P<0.05),结果显示糖尿病大鼠海马CA1区的LTP明显抑制。肉桂组9只大鼠强直刺激后PS平均增幅为(188.83±3.02)%,明显高于糖尿病组(P<0.05),强直刺激前后海马PS变化见图1。
2.2 海马NR2B的表达 研究肉桂改变糖尿病大鼠突触可塑性变化的机制,实验用westernblot的方法检测海马组织中NR2B的表达,如图2所示,糖尿病组海马NR2B的表达量明显下降(P<0.05),平均相对表达量为对照组的60.54%。相对于糖尿病组,肉桂组NR2B的表达量明显升高(P<0.05),为对照组的84.77%。
3 讨论
糖尿病患者的学习记忆功能的下降受到越来越多的关注,以往大量研究表明学习记忆的关键部位在海马,而突触可塑性变化被认为是海马参与学习记忆的基本形式[11]。海马突触可塑性变化主要包括长时程增强和长时程抑制,自从发现LTP现象以来,由于其具有时程长和联合的特性,人们认为这种突触传递效能的增强是海马将短时记忆转化为长时记忆的生物学基础。研究表明,阻断海马LTP会导致空间学习记忆能力下降,而增强LTP具有促进记忆的功效[12]。晚时相LTP的产生需要脑内信号分子的介导,海马LTP现象大多与NMDA受体有关,NMDA受体由NR1、NR2和NR3亚基组成,在不同脑区亚基表达不同,成年动物海马CA1区表达主要为NR2B型亚基,NR2B基因敲除小鼠表现为突触可塑性和学习记忆功能的下降,而超表达NR2B基因则表现为突触可塑性和学习记忆能力的增强[13]。有报道称糖尿病大鼠的认知障碍与NMDA受体有关,应用NMDA受体激动剂可改善糖尿病大鼠的认知障碍[14]。本次实验中,糖尿病大鼠的海马CA1区LTP抑制的同时伴有脑内NR2B表达的减少,表明糖尿病导致的突触可塑性下降与其海马NR2B表达的抑制有关。
肉桂主要成分为桂皮醛(cinnamaldehyde),占52.92%~61.20%,传统医学认为肉桂具有补火助阳、温里散寒、祛风散寒、温阳行气、温经通脉等功效,近来的研究表明肉桂具有抗氧化、抗糖尿病的作用。有研究称,肉桂提取物可使糖耐量保持正常并增强机体对胰岛素的敏感性,体内实验和体外实验均表明肉桂有直接的抗糖尿病的作用[15]。有研究报道肉桂能提高脑组织超氧化物歧化酶活性及神经生长因子、脑源性神经生长因子的表达,降低丙二醛含量,改善慢性脑缺血大鼠的认知能力[16]。本次实验中,肉桂明显改善糖尿病大鼠的LTP的抑制现象,提高海马突触可塑性,有效改善糖尿病大鼠学习记忆功能的下降,同时,应用肉桂治疗后,糖尿病大鼠海马NR2B的表达增多。这一系列结果表明肉桂改善糖尿病大鼠学习记忆和突触可塑性与其上调海马NR2B的表达有关。
[1]李秀枝.糖尿病健康教育的进展[J].中国医学创新,2012,9(16):162-163.
[2]杨敏,柳洁.中国糖尿病防治现状[J].中国医学创新,2014,11(7):149-151.
[3] Querfurth H W,LaFerla F M.Alzheimer’s disease[J].N Engl J Med,2010,362(4):329–344.
[4]徐荷凤.中西医结合治疗糖尿病周围神经病变的疗效观察[J].中国医学创新,2013,10(7):110-111.
[5]张美彪,杨水冰,杨井金,等.丁咯地尔与丹参注射液对糖尿病周围神经病变疗效比较和安全性分析[J].中国医学创新,2012,9(17):19-21.
[6]彭祖江,曾芳馨,刘玉溥.甲钴胺联合前列地尔治疗35例糖尿病痛性神经病变的效果观察[J].中国医学创新,2013,10(9):28-29.
[7] Cholerton B,Baker L D,Craft S.Insulin resistance and pathological brain ageing[J].Diabetic Medicine,2011,28(12):1463–1475.
[8] Nunomura A,Perry G,Aliev G,et al.Oxidative damage is the earliest event in Alzheimer disease[J].Neuropathol Exp.Neurol,2001,60(8):759–767.
[9] Brahmachari S,Jana A,Pahan K.Sodium benzoate,a metabolite of cinnamon and a food additive,reduces microglial and astroglial inflammatory responses[J].J Immunol,2009,183(9):5917–5927.
[10]杨坦,刘萍,丁玉琴.铅暴露对大鼠学习记忆功能和海马CA1区LTP的影响[J].医学信息,2008,21(6):872-876.
[11] Gu L,Kleiber S,Schmid L,et al.Long-term in vivo imaging of dendritic spines in the hippocampus reveals structural plasticity[J].J Neurosci,2014,34(42):13 948-13 953.
[12] Lynch M A.Long-term potentiation and memory[J].Physiol Rev,2004,84(1):87-136.
[13] Sakimura K,Kutsuwada T,Ito I,et al.Reduced hippocampal LTP and spatial learning in mice lacking NMDA receptor epsilon 1 subunit[J].Nature,1995,373(6510):151-155.
[14] Grzeda E,Wiśniewska R J.Differentiations of the effect of NMDA on the spatial learning of rats with 4 and 12 week diabetes mellitus[J].Acta Neurobiol Exp (Wars),2008,68(3):398-406.
[15] Verspohl E J,Bauer K,Neddermann E.Antidiabetic effcet of Cinnamomum cassia and Cinnamomum zeylanicum in vivo and invitro[J].Phytother Res,2005,19(3):203-206.
[16]张文风.肉桂对慢性脑缺血大鼠氧化应激及神经因子表达的影响[J].中医杂志,2010,51(7):645-647.

