应用多重PCR检测烟草黑胫病菌、根黑腐病菌、猝倒病菌及立枯病菌
刘萍花, 方敦煌, 吴祖建
(1.福建农林大学植物病毒研究所,福建 福州 350002;2.云南省烟草农业科学研究院,云南 玉溪 653100)
应用多重PCR检测烟草黑胫病菌、根黑腐病菌、猝倒病菌及立枯病菌
刘萍花1, 方敦煌2, 吴祖建1
(1.福建农林大学植物病毒研究所,福建 福州 350002;2.云南省烟草农业科学研究院,云南 玉溪 653100)
通过筛选特异性引物,优化多重PCR体系中的Mg2+、dNTP Mixture、TaqDNA聚合酶浓度,退火温度等反应条件,建立了多重PCR同时检测4种病菌(烟草黑胫病菌、根黑腐病菌、猝倒病菌和立枯病菌)的技术体系,得到265、364、400和541 bp共4条特异性条带,对应的病菌分别为猝倒病菌、黑胫病菌、根黑腐病菌、立枯病菌.该检测体系的灵敏度可达10-2ng·μL-1基因组DNA.
烟草; 烟草黑胫病菌; 根黑腐病菌; 猝倒病菌; 立枯病菌; 多重PCR
烟草是重要的经济作物之一,随着该产业的发展,烟草病害危害逐年加重.其中,烟草黑胫病、根黑腐病、猝倒病和立枯病等是烟草上最主要的土传病害,这些病菌相互作用,复合侵染,加剧了对烟叶产量和质量的影响[1].对于烟草病菌的检测,传统方法主要采用对典型症状的病样进行分离、鉴定,其耗时长,灵敏度低,易受人为及环境等诸多因素的干扰[2].因此,烟草生产上迫切需要一种能在发病初期或土壤中进行快速诊断的技术.
多重PCR(polymerase chain reaction)是在普通PCR基础上加以改进,在一个PCR 反应体系中加入多对特异性引物,针对多个DNA 模板或同一模板的不同区域扩增多个目的片段的技术[3],已应用于基因诊断和病原微生物的诊断和鉴定.谢燕婷等[4]建立了猪伪狂犬病毒、猪圆环病毒2型与猪细小病毒的多重PCR检测体系;郑轩等[5]应用多重PCR技术实现了对5种烟草病毒病的检测;张丽芳等[6]应用多重PCR技术建立了烟草青枯病、黑胫病及猝倒病3种病菌的同步检测.但有关烟草黑胫病、根黑腐病、猝倒病和立枯病等病菌的多重PCR检测尚未见报道.为此,本研究通过筛选合适的引物,优化多重PCR反应体系的条件参数,建立一套同时检测烟草黑胫病菌(hytophthoranicotianae)、根黑腐病菌(Thielavioisbasicola)、猝倒病菌(Pythiumphanidermatum)和立枯病菌(Rhizoctoniasolani)的多重PCR反应体系,为烟草病菌的监测、病害的诊断和防控提供依据.
1 材料与方法
1.1 材料
1.1.1 供试菌株 供试的烟草黑胫病菌、根黑腐病菌、猝倒病菌和立枯病菌菌株均由云南省烟草农业科学研究院实验室分离保存.
1.1.2 病株样本 采集云南省玉溪市植烟区病株疑似样本20份.
1.2 菌丝体的收集及基因组DNA的提取
将供试烟草黑胫病菌和猝倒病菌的菌株移至OA固体培养基平板上,根黑腐病菌和立枯病菌的菌株移至PDA平板上,28 ℃黑暗培养3 d后在菌落边缘切取小菌落块,然后将根黑腐病菌和立枯病菌的菌株移至PDB培养基中,其他菌株移至番茄汁液体培养基中,28 ℃、180 r·min-1振荡培养7 d,过滤收集菌丝.所有供试菌株基因组DNA均采用真菌基因组DNA快速抽提试剂盒(购自上海生工生物工程有限公司)提取.
1.3 引物的设计与筛选
根据立枯丝核菌的保守区(GenBank登录号为JQ313811.1),应用Primer 5.0引物设计软件设计一对特异性引物RsF/RsR,根黑腐病菌采用特异性引物TBF/TBR[7]、烟草黑胫病菌和猝倒病菌采用张丽芳等[6]设计的特异性引物.引物由宝生物工程(大连)有限公司(TaKaRa)合成,引物序列见表1.

表1 用于多重PCR扩增的特异性引物
1.4 多重PCR检测方法的建立及条件优化
1.4.1 单项PCR检测 分别以4种供试病原菌的DNA为模板,用相应的引物进行单项PCR扩增.PCR反应体系(25 μL):TaKaRa LaTaq酶(5 U·μL-1) 0.2 μL,10×LA PCR Buffer Ⅱ (Mg2+Free) 2.5 μL,MgCl2(25 mmol·L-1) 2.5 μL,dNTP Mixture (2.5 mmol·L-1) 4.0 μL,上、下游引物(20 μmol·L-1)各0.5 μL,DNA模板1.0 μL,添加ddH2O至25 μL.反应条件:94 ℃预变性4 min,94 ℃变性40 s,59 ℃退火40 s,72 ℃延伸45 s,30 个循环,最后72 ℃延伸7 min.取10 μL PCR产物经1.5%琼脂糖凝胶电泳分析比较.
1.4.2 多重PCR反应条件的优化 根据多次重复试验和经验,以及查阅文献[8]发现,影响多重PCR反应结果的因素主要为退火温度,以及dNTP Mixure、Mg2+和TaqDNA聚合酶浓度等.因此,本试验将主要对这些反应条件进行优化,进而确定多重PCR扩增的最佳反应体系和程序.
(1)Mg2+(25 mmol·L-1)添加量:在其他条件不变的情况下,将25 μL体系中Mg2+的添加量分别设2.0、2.5、3.0、3.5、4.0、4.5 μL等6个处理.
(2)dNTP Mixture(2.5 mmol·L-1)添加量:在其他条件不变的情况下,将25 μL体系中dNTPs的添加量分别设2.5、3.0、3.5、4.0、4.5、5.0 μL等6个处理.
(3)LaTaq酶(5 U·μL-1)添加量:在其他条件不变的情况下,将25 μL体系中LaTaq酶的添加量分别设0.20、0.25、0.30、0.35、0.40、0.45 μL等6个处理.
(4)退火温度:在多重PCR反应体系中,将退火温度按照1 ℃梯度设定为53、54、55、56、57、58、59、60、61、62、63、64 ℃.
1.4.3 多重PCR反应特异性检测 以烟草黑胫病菌、根黑腐病菌、猝倒病菌和立枯病菌的基因组DNA随机等量组合作为模板,用优化后的反应体系进行扩增,验证多重PCR反应的特异性.
1.4.4 多重PCR反应灵敏度检测 经超微量分光光度计测定烟草黑胫病菌、猝倒病菌、根黑腐病菌和立枯病菌的DNA模板浓度,从初始浓度开始依次按100-105梯度进行倍比稀释.按照已经优化的多重PCR条件进行扩增,测定多重PCR的灵敏度.
1.5 多重PCR检测方法的初步应用
在烤烟生长期的6-7月,从玉溪植烟区采集疑似病株样本,用自来水洗净染病根茎部,取病健交界处组织,切成4 mm2小块,用70%酒精消毒30 s后,取其200-300 mg按Ezup柱式植物基因组DNA抽提试剂盒(购自上海生工生物工程有限公司)的方法提取样品DNA.利用同样的方法提取健康组织样品中的DNA.以提取的健康组织样品DNA为模板,烟草黑胫病、猝倒病、根黑腐病和立枯病病原物DNA为阳性对照,无菌水DNA为阴性对照,采用建立的多重PCR反应体系进行电泳鉴定.
2 结果与分析
2.1 单项PCR电泳检测结果
以烟草黑胫病菌、猝倒病菌、根黑腐病菌和立枯病菌DNA作为模板,经PCR扩增分别得到265、364、400和541 bp的特异性条带(图1).
2.2 多重PCR检测方法的建立及条件优化结果
2.2.1 最适Mg2+(25 mmol·L-1)添加量的选择 在四重PCR体系中,当Mg2+添加量为2.0-4.5 μL时均可扩增出4条条带,其中添加量为4.0 μL时,4条目的条带均较为清晰(图2).因此,本试验最终选择4.0 μL作为最适Mg2+添加量.
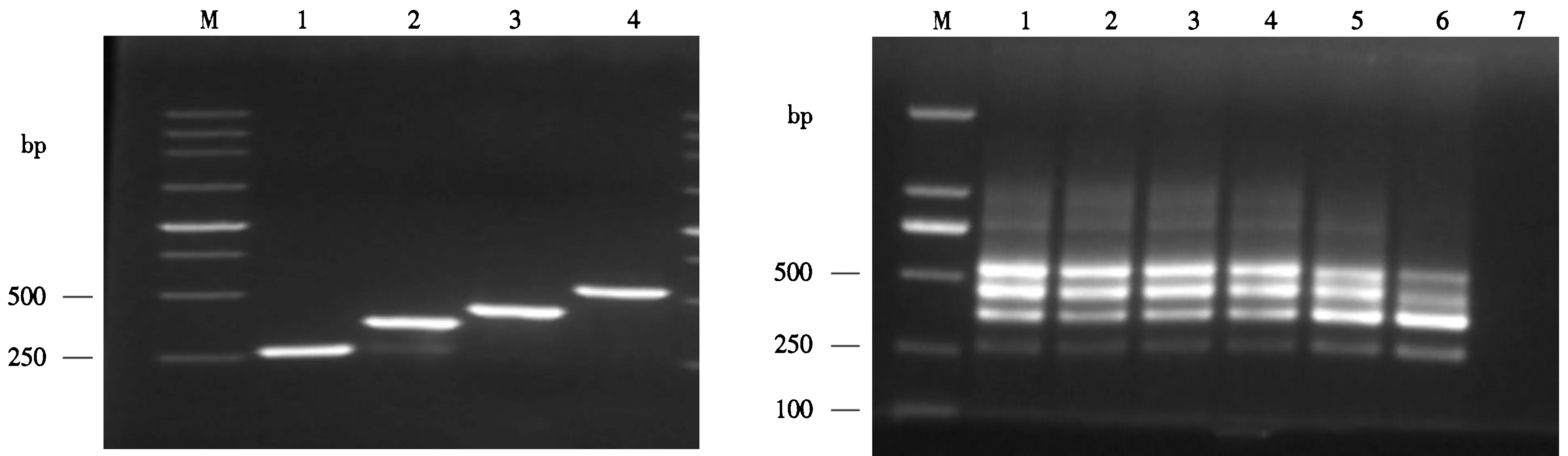
M.250 bp DNA Marker;1.猝倒病菌;2.黑胫病菌;3.根黑腐病菌;4.立枯病菌.
2.2.2 最适dNTP Mixture(2.5 mmol·L-1)添加量的选择 如图3所示,当dNTP Mixture添加量为4.0、4.5、5.0 μL时,均能扩增出清晰的4条特异性条带,而当dNTP Mixture添加量小于4.0 μL时,只能扩增出部分条带.综合各因素考虑,本试验将4.5 μL确定为最适dNTP Mixture添加量.
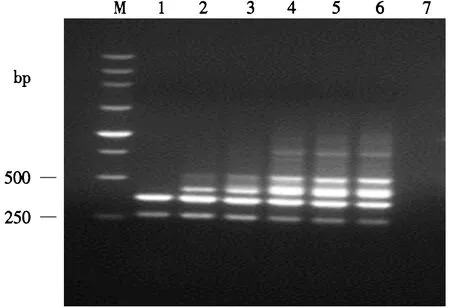
M.250 bp DNA Marker;1-6.dNTPs添加量分别为2.5、3.0、3.5、4.0、4.5、5.0 μL;7.阴性对照.
2.2.3 最适LaTaq酶(5 U·μL-1)添加量的选择 如图4所示,当LaTaq酶的添加量为0.20-0.45 μL时,均能扩增出4条清晰的特异性条带.其中,当LaTaq酶添加量为0.20 μL时,就有非常清晰的4条目的条带,并且拖尾现象较弱.因此,本试验将0.20 μL确定为最适LaTaq酶添加量.

M.250 bp DNA Marker;1-6.La Taq酶的添加量分别为0.20、0.25、0.30、0.35、0.40、0.45 μL;7.阴性对照.
2.2.4 最适退火温度的选择 从图5可以看出,1-12泳道均出现了4条目的条带,说明在53-64 ℃下均能进行PCR反应.但当退火温度为56 ℃时,4条目的条带较为均一,所以本试验将其定为最适退火温度.
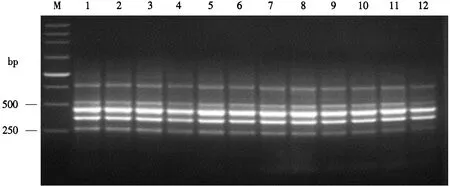
M.250 bp DNA Marker;1-12分别为53、54、55、56、57、58、59、60、61、62、63、64 ℃.
2.2.5 多重PCR反应的特异性和灵敏度 如图6所示,该多重PCR检测体系具有较好的稳定性,说明其反应特异性较强.此外,本研究测得烟草黑胫病菌、猝倒病菌、根黑腐病菌和立枯病菌DNA模板的浓度分别为227、179、190和254 ng·μL-1.倍比稀释扩增结果如图7所示,同时检测4种病菌的灵敏度可达到10-2ng·μL-1基因组DNA.
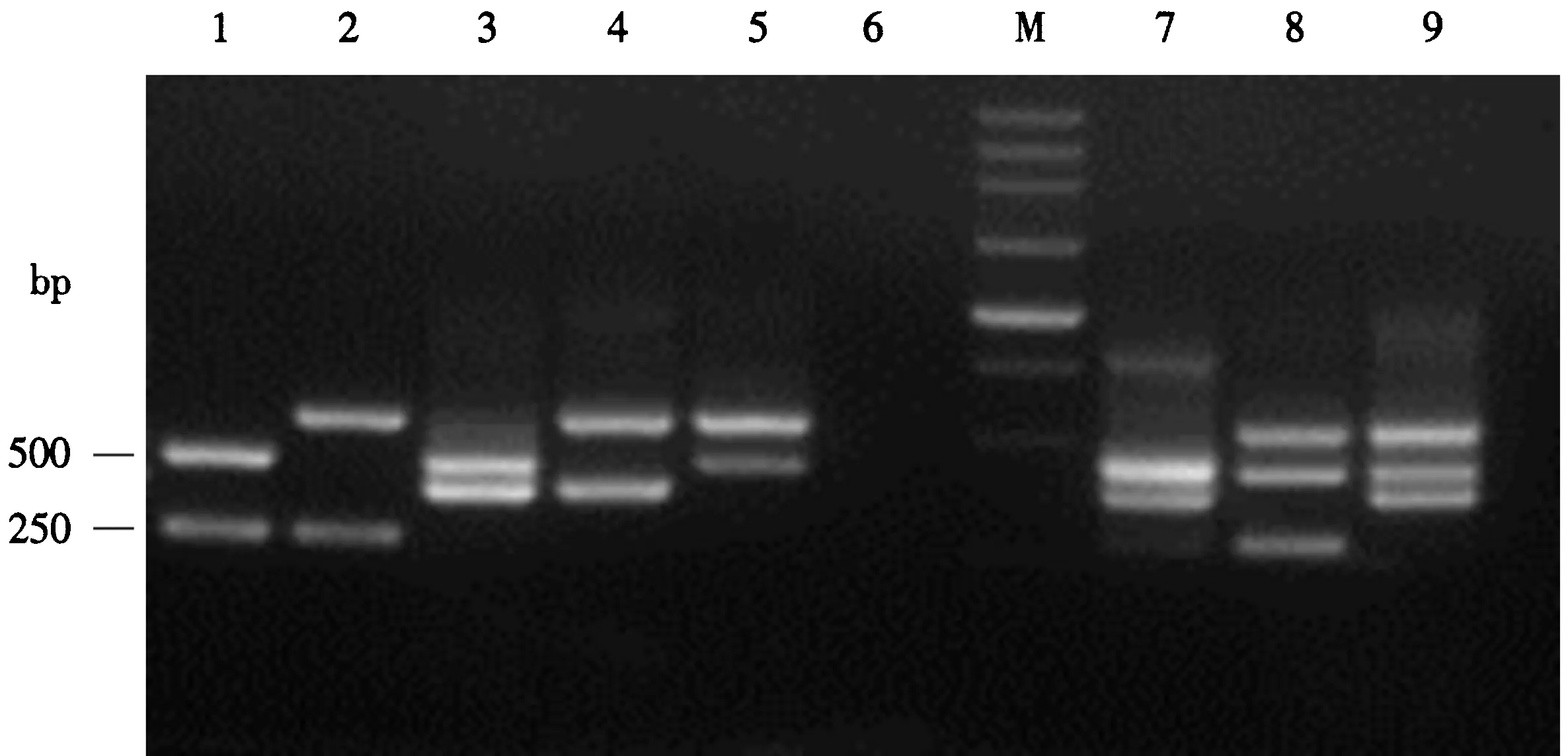
M.250 bp DNA Marker;1.猝倒病菌和根黑腐病菌;2.猝倒病菌和立枯病菌;3、7.黑胫病菌和根黑腐病菌;4.黑胫病菌和立枯病菌;
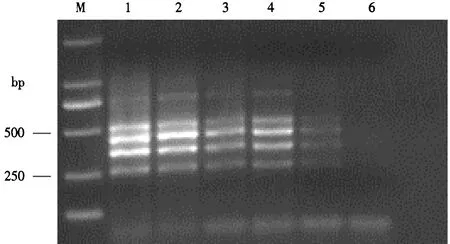
M.DL2000 DNA Marker;1-6.模板依次稀释100-105倍后的扩增结果.
2.3 多重PCR检测方法的初步应用
取样测定结果表明,4个阳性对照均呈现相应的特异性条带;阴性对照、健康组织样品均无扩增;20个疑似病株样品中有16个扩增出364 bp的特异条带,2个扩增出400 bp的特异条带,1个扩增出265 bp的特异条带,1个扩增出364和400 bp的特异条带.这些结果表明,所采集的疑似病株样本中以烟草黑胫病为主,根黑腐病、猝倒病偶见,极个别存在烟草黑胫病、根黑腐病复合侵染现象,未见立枯病.
3 讨论
多重PCR具有检测时间短、试验成本低以及快速、高通量等优点,广泛应用于病菌的检测.但是,多重PCR要求在同一反应体系中进行多个位点的特异性扩增,因而技术难度较大.在多重PCR反应体系中,引物至关重要,合适的引物既能增加多重PCR的特异性,又能增加其敏感性[9].真菌的rDNA-ITS序列是中度重复序列,广泛分布于基因组,国内外已有利用真菌rDNA-ITS区域在科、属、种水平上的差异,设计特异性引物,进行植物病害诊断和病菌检测的报道[10-11].本研究中检测引物的设计也是基于此.
灵敏度是评价多重PCR反应的重要指标之一.本试验通过对多重PCR反应条件的优化,同时检测烟草黑胫病菌、猝倒病菌、根黑腐病菌和立枯病菌的灵敏度可达10-2ng·μL-1基因组DNA.
[1] 陈瑞泰,朱贤朝.全国16个主产烟省(区)烟草侵染性病害调研报告[J].中国烟草,1997(4):1-7.
[2] 王楠,王剑,尹丹韩,等.三重PCR检测草莓灰霉病菌、炭疽病菌和黄萎病菌[J].中国农业科学,2010,43(21):4392-4400.[3] 陈明洁,方倜,柯涛,等.多重PCR——一种高效快速的分子生物学技术[J].武汉理工大学学报,2005,27(10):33-36.
[4] 谢燕婷,郑敏,石磊,等.多重PCR快速诊断猪伪狂犬病毒、猪圆环病毒2型与猪细小病毒方法的建立[J].福建农林大学学报:自然科学版,2014,43(1):61-64.
[5] 郑轩,成巨龙,赵震,等.五种烟草病毒TMV、CMV、TEV、PVY及TVBMV的多重RT-PCR同步检测[J].植物病理学报,2011,41(2):146-153.
[6] 张丽芳,陈海如,方敦煌,等.烟草青枯病、黑胫病和猝倒病的多重PCR检测[J].华北农学报,2013,28(增刊):22-26.
[7] 赵永强.烟草根黑腐病菌的分子检测与室内药剂筛选[D].泰安:山东农业大学,2009.
[8] 黄银花,胡晓湘,高宇,等.影响多重PCR扩增效果的因素[J].遗传,2003,25(1):65-68.
[9] 洪志,颜其贵,郭万柱,等.多重PCR技术在动物疫病诊断中的应用[J].中国动物检疫,2007,24(1):45-48.
[10] LI S, HARTMAN G L. Molecular detection ofFusariumsolanif. sp.glycinesin soybean roots and soil[J]. Plant Pathology, 2003,52(1):74-83.
[11] 曾晓葳,骆勇,周益林,等.基于小麦白粉病菌rDNA-ITS序列的PCR分子检测[J].植物病理学报,2008,38(2):211-214.
(责任编辑:杨郁霞)
Simultaneous detection ofPhytophthoranicotianae,Thielavioisbasicola,PythiumaphanidermatumandRhizoctoniasolaniinfected tobacco by multiplex PCR
LIU Ping-hua1, FANG Dun-huang2, WU Zu-jian1
(1.Institute of Plant Virology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China;2.Yunnan Academy of Tobacco Agricultural Sciences, Kunming, Yunnan 653100, China)
Four pairs of specific primers were designed according to rDNA-ITS of the four pathogensPhytophthoranicotianae(Pn),Thielavioisbasicola(Tb),Pythiumaphanidermatum(Pa) andRhizoctoniasolani(Rs). Specific fragments of 265 bp (Pa), 364 bp (Pn), 400 bp (Tb) and 541 bp (Rs) were successfully amplified by the multiplex PCR system based on the optimization of the concentration of Mg2+, dNTP Mixture,TaqDNA polymerase, and the annealing temperature. The detection sensitivity of four pathogens was nearly 10-2ng·μL-1DNA.
tobacco;Phytophthoranicotianae;Thielavioisbasicola;Pythiumaphanidermatum;Rhizoctoniasolani; multiplex PCR
2014-09-25
2014-12-22
中国烟草总公司云南省公司科技计划项目(2012YN05).
刘萍花(1990-),女,硕士研究生.研究方向:烟草真菌病害.通讯作者方敦煌(1967-),男,副研究员,博士.研究方向:烟草病害及其防治.Email:fdhkm@sina.com.
S435.72
A
1671-5470(2015)04-0345-05
10.13323/j.cnki.j.fafu(nat.sci.).2015.04.002

