基于米根霉代谢轮廓研究的能荷物质分析方法的建立
史纯珍,张红漫,李 霜,黄 和
(1.北京工商大学 食品学院,环境科学与工程系,北京100048;2.南京工业大学 生命与制药工程学院,江苏 南京210000)
1 引言
富马酸又名反丁烯二酸、延胡索酸,是一种重要化工原料,被广泛用于食品、化工、医药等领域。作为一种四碳平台化合物,可进一步合成多种高价值衍生物。米根霉是发酵产富马酸的高产菌株,本文利用HPLCUV建立了米根霉胞内6种能荷物质的检测方法,为研究米根霉产富马酸胞内代谢途径提供方法平台。
ATP、NADH、NAD为微生物代谢过程中时刻处于变化的物质,同时也是对生理活性影响较大的代谢产物,能荷物质的含量水平是微生物生理代谢中的重要考察依据[1~3]。因此是验证提取方法的高效性及稳定性的最佳内标物[4~6]。通过考察样品制备过程中胞内不稳定化合物的回收率,可以作为判断样品制备方法优劣的可靠标准。对三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)、烟酰胺腺嘌呤二核苷酸(NAD)、烟酰胺腺嘌呤二核苷酸(NADH)和环磷酸腺苷(cAMP)这6种能荷物质建立检测方法。
2 实验部分
2.1 仪器与试剂
HPLC 戴安系列(P680HPLC Pump System,Chromeleon工作站,紫外检测器 (UV))(美国戴安公司);Eppendorf 5804R台式冷冻离心机(Eppendorf公司);循环水式多用真空泵(郑州长城科工贸有限公司);KH2200DB型数控超声波清洗器(中国昆山禾创超声仪器有限公司);PHS-3C型精密pH值计(中国上海雷磁仪器厂);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);Centrifuge 580R 低温离心机(Eppendorf);MDF-U32V超低温冰箱-80℃(SANYO)。
2.2 色谱分离条件
色谱柱:Sepax HP-C18column(4.6×250mm)反相色谱柱。流动相:以A0.6%磷酸水溶液(三乙胺调pH值到6.6);B甲醇,作为流动相,梯度洗脱;室温25℃,流速1.0mL/min,紫外检测器(检测波长254nm)。
2.3 方法学考察
2.3.1 标品混合溶液的配置
分别准确称取一定量的色谱纯ATP、ADP、AMP、NAD、NADH和cAMP,用超纯水配置成浓度均为1g/L的标准混合溶液,逐级稀释为0.5g/L、0.1g/L、0.05g/L、0.01g/L、5mg/L、1mg/L、0.5mg/L、0.1mg/L、0.05mg/L的浓度。
2.3.2 精密度实验
日内精密度:从同一个摇瓶中取2个平行样品,经过处理后,将2个样品溶液分别检测6次。日间精密度:从同一个摇瓶中取2个平行样品,经过处理后,将2个样品分别连续3d每一天进样一次。样品溶液不用时需保存在-20℃下。
2.3.3 回收率实验
准确配置50mg/L、5mg/L、0.5mg/L三个浓度的混合标准溶液,分别加入样品溶液中,测定5种物质的回收率。
3 结果与讨论
3.1 初始分离条件的选择
ATP、ADP、AMP、NAD、NADH 和cAMP属于低聚核苷酸,为离子样品,检测低聚核苷酸最常用最简便的方法是使用高效液相色谱法[7]。本文使用反相高效液相色谱法,由于低聚核苷酸在反相色谱柱上的保留较小,因此需要加入离子对试剂使其保留增强,测定低聚核苷酸常用的离子对试剂是三乙胺[8],质子化的三乙胺作为有效的离子对试剂能够将电离的低聚核苷酸很牢固的结合在填料柱上。加入离子对试剂后,离子样品的分离选择性发生了很大变化,最大保留出现在高pH值区(样品完全解离),又由于色谱柱的固定相长时间在碱性环境中不稳定,因此,pH选择在中性条件下。流动相中的有机相常用的为甲醇和乙腈,甲醇毒性较小,因此选用甲醇作为有机相。
3.2 流动相中H3PO4摩尔浓度的条件优化
在初始的分离条件下,流动相的水相分别配置含有H3PO4浓度为0.2%、0.4%、0.6%、0.8%、1.0%的溶液,然后加入三乙胺使pH值达到6.6。随着流动相中H3PO4浓度的增加,6种物质在色谱柱上的保留增强,保留时间延长,且在H3PO4浓度为0.6%的时候,6种物质之间的分离度最大,且达到基线分离(R>1.5),因此选择H3PO4浓度为0.6%。出峰顺序分别为NAD,AMP,ADP,ATP,cAMP,NADH。
图1为在此优化条件下,对6种标准物质进行分离的液相色谱图。由图1A可以看出6种物质在30min内全部实现基线分离。图1B为实际样品的分离图谱,除AMP与ADP以外,其余4种物质也都实现了基线分离,并且AMP与ADP的峰形不影响峰面积的积分。因此,用离子对色谱法检测分离6种物质的最佳检测条件是:Sepax HP-C18column(4.6×250mm)反向色谱柱,A0.6%磷酸水溶液(三乙胺调pH 值到6.6);B甲醇作为流动相,10%B保持洗脱10min,然后以3%B/min速度增至25%,室温,流速1.0mL/min,紫外检测器(波长254nm)。
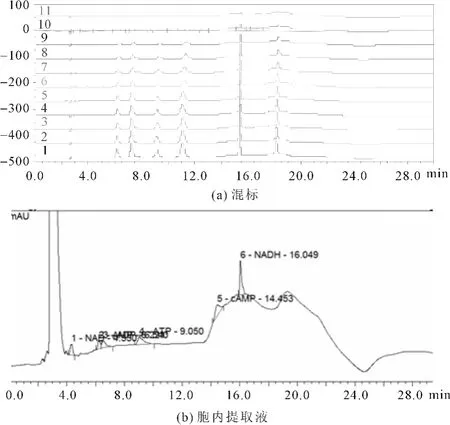
图1 6种能荷物质混合物的分离图谱
3.3 外标工作曲线的线性
在标品与样品进样量相同的情况下,用外标法定量。准确吸取不同浓度的ATP,ADP,AMP,NADH,NAD,cAMP混合标准溶液20μL分别进样,测定其峰面积,以峰面积A对浓度C(g/L)作图得到标准曲线,得到6种物质的线性回归方程、相关系数以及检测限和定量限见表1。
从表1中可以看出,6种物质在该检测条件下可以得到较好的线性,相关系数在0.9978~0.9995之间。检测限(S/N﹥3)低于0.2166mg/L,检测灵敏度较高,可用于快速检测。
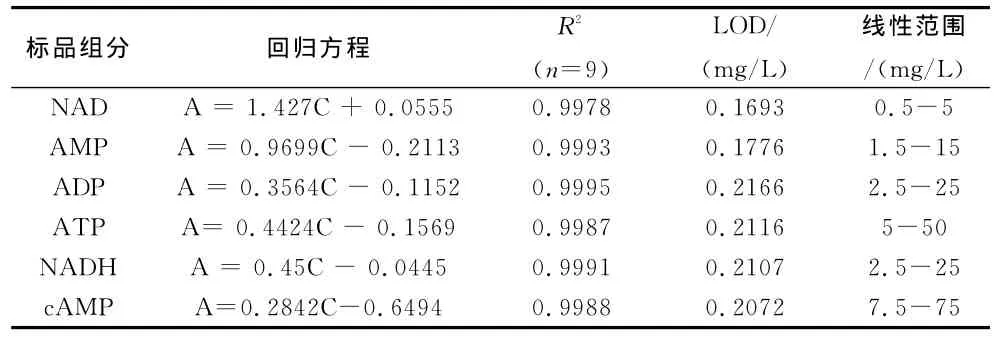
表1 标准曲线的线性参数
3.4 方法的回收率和重复性试验
用实际样品(胞内提取液)进行检测,根据上述方法对检测方法的精密度和准确度进行的实验。实验结果见表2。

表2 重复性试验结果
由表2可知,6种物质的精确度都满足实验要求。NADH的日内精密度较小,为10.36%,这可能是由于其本身不稳定,易分解,还有一个原因,是因为NADH相较于其他五种物质而言,本身的响应值较小(峰面积较小),因此精密度较小,但是该精密度也可以满足实验要求。
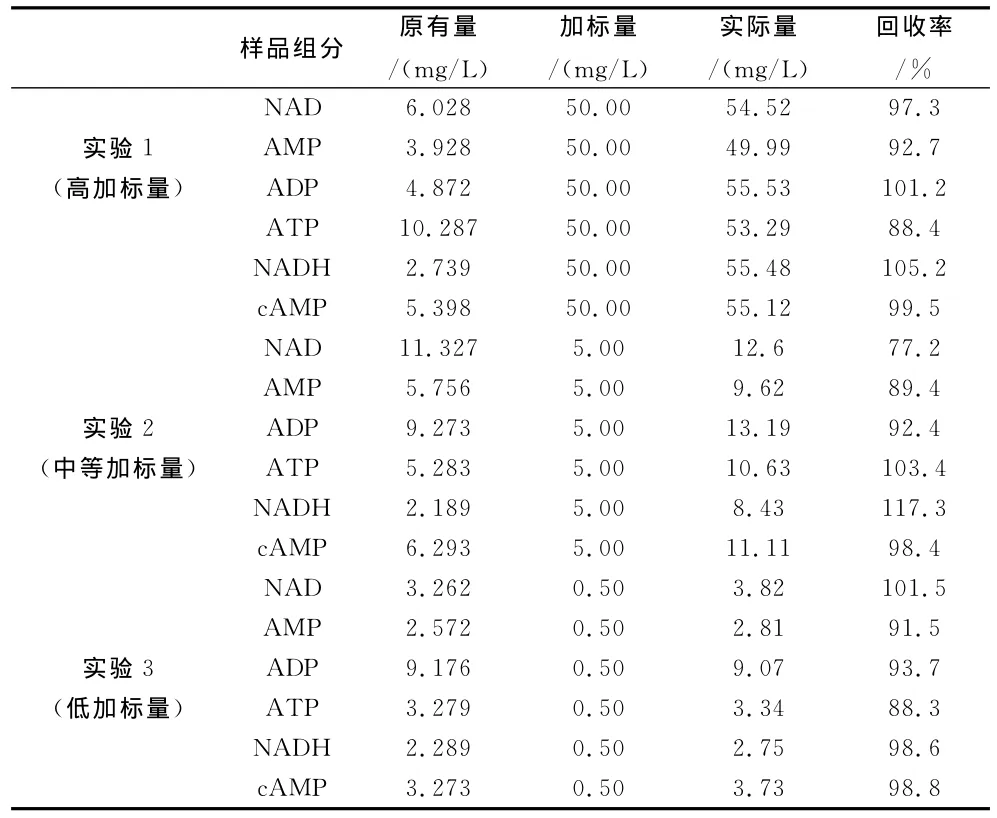
表3 回收率测定结果
由表3中回收率的实验结果可知,回收率在77.2%~105.2%,因此该检测方法的准确度较高。
3.5 米根霉发酵液样品中各物质的定量分析结果
取米根霉发酵第72h的发酵液,取3个平行样,在上述分离条件下进行色谱分析,结果见表4。
从实验结果中看,该方法能够准确的测定米根霉胞内提取液中各物质的含量。
4 结语
(1)采用离子对液相色谱的方法,可以准确检测米根霉胞内提取液中 ATP,ADP,AMP,NADH,NAD,cAMP的含量。该方法的最优检测条件是:Sepax HP-C18column(4.6×250mm)反相色谱柱,以 A0.6%磷酸水溶液(三乙胺调pH到6.6);B甲醇,作为流动相,梯度洗脱;室温(25℃),流速1.0mL/min,紫外检测器(检测波长254nm)。

表4 不同批次间的样品检测结果
(2)本方法具有干扰小、灵敏度高、分析速度快等优点,该方法的建立,为研究后续的淬火和提取方法提供了可靠的依据,对代谢组学的整体研究具有重要意义。
[1]H Link,B Anselment,D Weuster-Botz.Leakage of adenylates during cold methanol/glycerol quenching of Escherichia coli[J].Metabolomics,2008(4):240~247.
[2]C A Sellick,R Hansen,A R Maqsood.Effective Quenching processes for physiologically valid metabolite profiling of suspension cultured mammalian cells[J].Anal Chem,2009(81):174~183.
[3]M Faijes,A E Mars,E J Smid.Comparison of quenching and extraction methodologies for metabolome analysis of Lactobacillus plantarum[J].Microb Cell Fact,2007(6):1~8.
[4]R M Mashego,M W van Gulik,L J Vinke.Critical evaluation of sampling techniques for residual glucose determination in carbon-limited chemostat culture of Saccharomyces cerevisiae[J].Biotechnol Bioeng,2003,83(4):395~399.
[5]C Wittmann,J O Kr?mer,P Kiefer.Impact of the cold shock phenomenon on quantification of intracellular metabolites in bacteria[J].Anal Biochem,2004(327):135~139.
[6]S G Villas-B?as,J H Pedersen,M kesson.Global metabolite analysis of yeast:evaluation of sample preparation methods[J].Yeast,2005(22):1155~1169.
[7]M Ganzera,P Vrabl,E Wörle.Determination of adenine and pyridine nucleotides in glucose-limited chemostat cultures of Penicillium simplicissimum by one-step ethanol extraction and ionpairing liquid chromatography[J].Anal Chem,2006(359):132~140.
[8]M G Volonté,G Yulna,P Quiroga.Development of an HPLC method for determinationof metabolic compounds in myocardial tissue[J].J Pharm Biomed Anal,2004(35):647~653.

