外源氮素形态对紫花苜蓿不同生育期根系特性的影响
刘晓静,叶芳,张晓玲
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室/中美草地,畜牧业可持续发展研究中心,甘肃 兰州 730070)
外源氮素形态对紫花苜蓿不同生育期根系特性的影响
刘晓静1,2,叶芳1,2,张晓玲1,2
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室/中美草地,畜牧业可持续发展研究中心,甘肃 兰州 730070)
在完全营养液的条件下,采用砂培法,研究了3种外源氮素形态配比(NO3--N,NH4+-N以及NO3--N∶NH4+-N为 1∶1)和3个氮素水平(0,105,210 mg/L)对“甘农3号”紫花苜蓿整个生育期根系特性的影响。结果表明,不同形态氮素处理下紫花苜蓿的根系生物量、根表面积、根体积、根系活力、根瘤数、根瘤重和固氮酶活性均显著高于CK,NO3--N和NH4+-N混合培养下效果最好,NH4+-N培养下次之,NO3--N培养下最低,但对根系平均直径的影响并不大。随着氮素水平的增加,各形态配比下紫花苜蓿的根系生物量、根表面积、根体积、根系活力、根瘤数、根瘤重和固氮酶活性均呈增加的变化趋势,各指标在NO3--N+NH4+-N的浓度为210 mg/L时,达到最大值。整个生育期,各处理下紫花苜蓿的根系生物量、根表面积、根系活力、根瘤数、根瘤重和固氮酶活性均在苗期、现蕾期、盛花期差异比较明显,结荚期和鼓粒期差异不显著,各指标之间均有不同程度的相关性。
紫花苜蓿;NO3--N;NH4+-N;生育期;根系特性
作为重要豆科牧草,紫花苜蓿(Medicagosativa)可以与根瘤菌有效共生进行生物固氮,从而为植株提供氮素,但根瘤的形成受生态环境与土壤肥力的影响较大[1],自然条件恶劣或维持高水平生产时,仅靠生物固氮远不能满足其氮素需求,还必须施用氮肥。对大豆(Glycinemax)研究已证实,大豆与根瘤共生固氮所固定的氮素约占大豆一生需氮量的50%~60%[2]。在紫花苜蓿生产实践中发现,施氮是保证其高产优质的必要条件,尤其如“甘农”系列等高产紫花苜蓿品种,肥料报酬率高,施氮对其增产效果显著[3],主要是由于外源氮的有效补充,充分满足了高产紫花苜蓿品种对氮素的较高要求,同时促进了其根系等器官的良好生长[4]。根系的形态特征和生理生化反应与植物氮素的利用效率极为相关[5-6],其发育程度与植株生物量关系密切[7],紫花苜蓿根系的生长状况直接决定着其产草量[8]。
根系利用的主要氮素形式是NO3--N和NH4+-N,氮素形态不同,对植物生理代谢过程影响不同。研究表明,NO3--N可以促进拟南芥根系的长度生长以及表面积增大和密度的增加[9],NH4+-N也能促进植物侧根和根毛的生长。与单一的NO3--N或NH4+-N比,将NO3--N和NH4+-N以适度比例混合施用可促进绝大多数旱作作物的生长,目前关于外源氮素形态对植物根系影响的研究主要集中于玉米(Zeamays)[10]、水稻(Oryzasativa)[11]、大豆[12]等作物,孙敏等[13]研究表明,NH4+-N处理下小麦(Triticumaestivum)的根体积、根系生物量、根系活力均大于NO3--N 处理。宋海星等[14]对大豆(Glycinemax)的研究表明,NH4+-N对根瘤固氮的抑制作用明显低于NO3--N,但不同形态氮素对紫花苜蓿影响的研究鲜有报道,另外,对豆科作物不同生育期需氮规律的研究也较少,且均集中在对大豆的研究上。甘银波等[15]研究表明,根瘤形成初期是大豆营养生长阶段的最佳施肥时间,而开花期是大豆生殖生长阶段的最佳施肥时间。何建国等[16]研究发现,在不同的时期增施氮肥对大豆产量的影响不同。针对紫花苜蓿不同生育期需氮规律的研究尚未见报道,适时适量的施氮可使紫花苜蓿生产效益最大化,降低生产成本,并可避免不合理施肥对环境的影响,是紫花苜蓿生产实践中养分管理亟待解决的瓶颈问题。因此,本研究开展不同外源氮素形态及水平对紫花苜蓿各生育期根系生长的影响及各根系指标间的相关性,以期为生产实践中苜蓿的养分管理提供理论依据。
1 材料与方法
1.1 试验材料
供试紫花苜蓿品种:“甘农3号”紫花苜蓿(M.sativaCV. Gannong No.3),由甘肃农业大学草业学院提供。
1.2 试验方法
经蒸馏水清洗并灭菌后的粗砂装入直径16 cm、高20 cm 的花盆,每盆装砂10 kg,浇透水,选取颗粒饱满的灭菌种子[17],于2013年4月25日播种,每日喷洒蒸馏水至对生真叶完全展开,浇入营养液,播种14 d后进行间苗,每盆保苗50株,置于塑料防雨棚内。
1.3 试验设计
试验设3种外源氮素形态:NO3--N,NH4+-N和混合态氮(NO3--N和NH4+-N按1∶1比例混合);根据前期试验结果[8]设3个氮素水平:0,105,210 mg/L(以纯氮计,最高浓度为霍格兰营养液中氮素的浓度,低氮为其倍数),共7个处理,分别以0、NO3--105、NO3--210、NH4+-105、NH4+-210、NO3-+NH4+-105、NO3-+NH4+-210表示,每处理重复15次,共105个处理,完全随机排列。以Fahraeus无氮植物营养液结合Ca(NO3)2和(NH4)2SO4配制所需氮素浓度[18],调节pH值为7。处理营养液均每7 d更换1次,每次每盆加入500 mL;每次更换营养液前用蒸馏水淋洗盆栽以防止砂培中盐分积累。紫花苜蓿生长至3片复叶时,每盆接种新培养的苜蓿根瘤菌液50 mL(中华根瘤菌12531)。分别在苗期、现蕾期、盛花期、结荚期、鼓粒期测定紫花苜蓿的根系生物量、根体积、根表面积、根系活力、根瘤数和固氮酶活性等指标。
1.4 测定指标和方法
根系生物量:用滤纸吸干地下部水分,放入烘箱105℃下杀青15 min,而后于65~75℃烘干至恒重,每个处理重复6次。根表面积、根平均直径:测定时将各处理的根系用清水洗净,采用台式扫描仪 (EPSON Experssion)和WinRHIZO 根系分析系统软件 (Regent Instruments, Inc., Quebec, Canada) 进行数据采集,每个处理重复6次。
根体积:用体积排水法测定,每个处理重复6次。根系活力:采用氯化三苯基四氮唑(TTC)法测定[19],用根系还原力表示各处理下根系活力的差异。每个处理重复6次。根瘤数:统计单株根瘤数,每处理取10株。根瘤重:将每个单株上摘下的根瘤在电子天平上称其鲜重,每个处理重复10次。
固氮酶活性:采用乙炔还原法测定[20]。测定仪器为GC-7890F气相色谱仪,柱温180℃,进样器150℃,FID检测器170℃。气体压力:N2为0.3 MPa,H2为0.08 MPa,空气为0.15 MPa。C2H4水平(μmol/g·h)=h×x(样品峰面积)×C(标准C2H4水平,μmol/mL)/hs(标准C2H4峰面积)×24.9×t(C2H2反应时间,h)×m(瘤重,g),每个处理重复3 次。
1.5 数据处理
采用 Excel 2007和 SPSS 17.0 专业统计分析软件进行数据分析和差异显著性比较。
2 结果与分析
2.1 外源氮素形态对紫花苜蓿不同生育期根系生物量的影响
由图1可知,不同氮素形态处理下,紫花苜蓿的根系生物量随着生育期的推进呈逐渐增加的趋势,在结荚期达到峰值,而后随着根系的衰老,根系生物量也明显减少。但各生育时期各施氮处理根系生物量均与CK(无氮)有显著的差异(P<0.05),说明施氮能明显促进紫花苜蓿的根系生长。苗期,紫花苜蓿根系生物量表现为:NO3--N和NH4+-N混合培养下最大,NH4+-N培养下次之,NO3--N培养下最低,各氮素形态间差异显著(P<0.05),但同一氮素形态下除了混合态两个水平间差异显著,其余差异均不显著。说明苗期施混合态氮肥有利于苜蓿根系生物量快速增长。结荚期和鼓粒期,虽然根系生物量的变化趋势与苗期相同,但各处理间差异均不显著。NO3--N+NH4+-N的浓度为210 mg/L时,紫花苜蓿的根系生物量达到最大值,苗期,现蕾期,盛花期显著高于其他处理,结荚期和鼓粒期与其他处理差异不显著,各个时期较NH4+-210分别增加了62.5%,35.89%,30.00%,15.32%,11.11%;较NO3--210分别增加了96.67%,82.76%,71.69%,41.58%,41.30%,由此可见,混合态氮比NO3--N和NH4+-N更能有利于紫花苜蓿地下生物量的积累。整个生育期,从苗期到结荚期,紫花苜蓿的根系生物量增加比较明显。
从图2可以看出,氮素形态对紫花苜蓿苗期根系总量影响很大,随着氮素水平的增加,根系量明显增加,在不同形态处理下,可以看出硝铵态混合效果最好。另外,从图2中也可以明显看出,随着氮素水平的增加,各处理下紫花苜蓿的侧根数也逐渐增大,氮素形态对侧根数的影响表现为:NO3--N和NH4+-N混合培养下最大,NH4+-N培养下次之,NO3--N培养下最低,各形态间有明显的差异。由此可见,混合态氮可以明显地增加紫花苜蓿的侧根数,进而使其根系生物量也增加。
2.2 外源氮素形态对紫花苜蓿不同生育期根系表面积的影响
“甘农3号”紫花苜蓿不同生长期根系表面积见图3,不同施氮水平对紫花苜蓿根系表面积影响显著,随着施氮量的增加,紫花苜蓿的根系表面积逐渐增加,均显著高于不施氮处理(P<0.05)。但现蕾期和盛花期,NO3--N处理下根系表面积随着施氮量的增加逐渐减小,各水平之间差异不显著。从氮素形态来看,同一氮素水平下,前4个时期,不同氮素形态处理下紫花苜蓿的根系表面积表现为:NO3--N+NH4+-N>NH4+-N>NO3--N,NO3-+NH4+-210处理下紫花苜蓿的根系表面积最大,显著高于其他处理(P<0.05),说明NO3--N和NH4+-N混合使用比单一NO3--N和NH4+-N更能促进根系表面积的增加,从而有利于植物从土壤中吸收更多的水分及矿质元素来维持自身的生长与代谢。
从不同生育期来看,氮素形态对紫花苜蓿根系表面积的影响也很大。氮素浓度为105 mg/L时,苗期,混合态氮和NH4+-N根系表面积显著大于NO3--N;现蕾期和盛花期,混合态氮根系表面积显著大于NO3--N和NH4+-N;鼓粒期,NO3--N根系表面积显著大于NH4+-N。结荚期和鼓粒期,各氮素形态处理下紫花苜蓿的根系表面积差异均显著,其余时期差异均不显著;氮素浓度为210 mg/L时,则苗期,现蕾期和盛花期,各氮素形态处理下的根系表面积差异均显著,结荚期和鼓粒期差异不显著。整个生育期,混合态氮处理下紫花苜蓿的根系表面积最大,苗期,现蕾期,盛花期和结荚期,NH4+-N处理下紫花苜蓿的根系表面积均高于NO3--N处理,鼓粒期,NO3--N处理下紫花苜蓿的根系表面积高于NH4+-N。

图1 氮素形态对紫花苜蓿不同生育期根系生物量的影响Fig.1 Effects of nitrogen forms on the underground biomass of alfalfa at different growth stages不同小写字母表示差异显著(P<0.05),下同。The different small letters mean the significant differences at P<0.05, the same below.
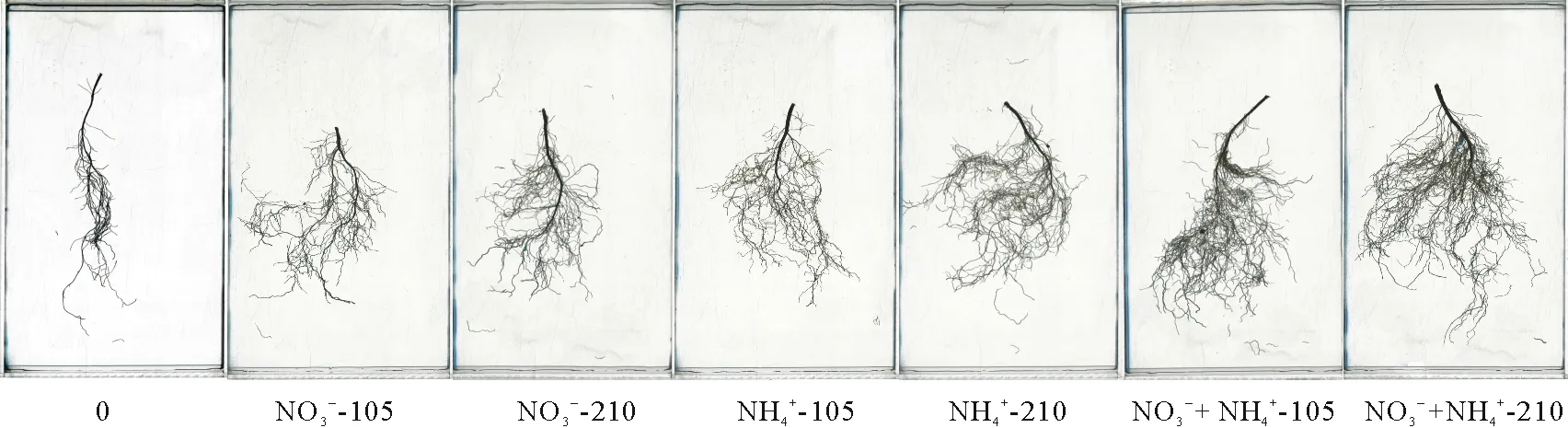
图2 苗期紫花苜蓿根系扫描图片Fig.2 Seedling root scanning images of alfalfa
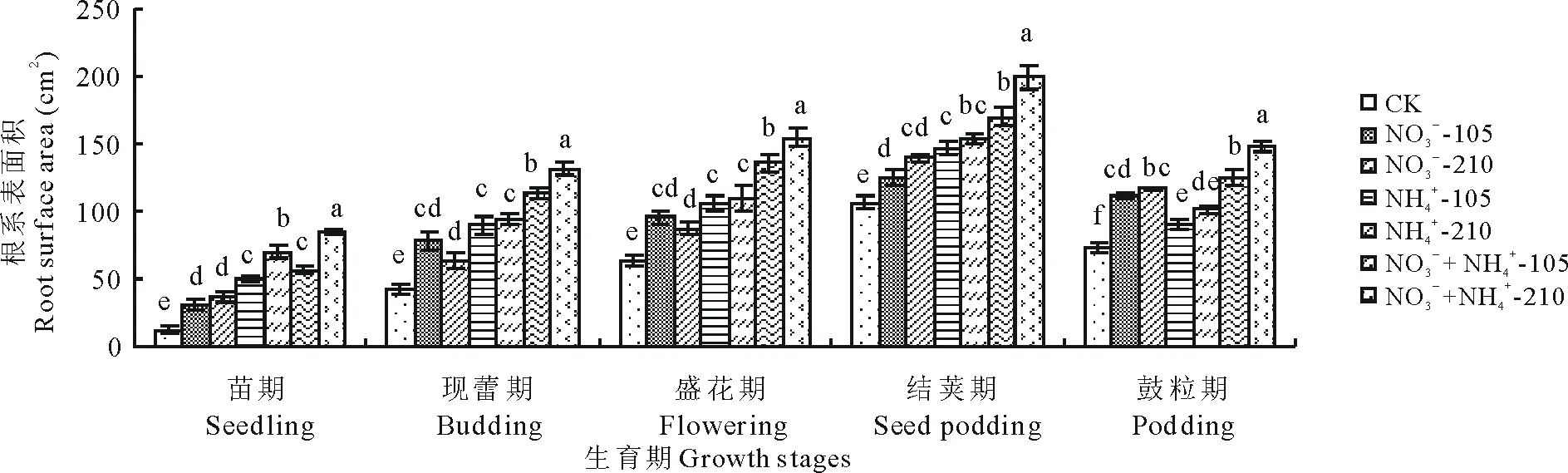
图3 氮素形态对紫花苜蓿不同生育期根系表面积的影响Fig.3 Effects of nitrogen forms on the root surface area of alfalfa at different growth stages
2.3 外源氮素形态对紫花苜蓿不同生育期根平均直径的影响
不同氮素形态对紫花苜蓿根系平均直径的影响见图4,虽然紫花苜蓿的根系平均直径随着氮素水平的增加而呈增大的趋势,但各水平间差异均不显著(P>0.05)。不同形态氮素处理下,紫花苜蓿的根平均直径从苗期到鼓粒期均是NO3--N和NH4+-N混合培养下最大,NH4+-N培养下次之,NO3--N培养下的最低,各时期间差异不明显。在苗期和盛花期,混合态氮处理下根平均直径显著高于CK,单一氮源与CK相比差异不显著。由此可见,氮素对紫花苜蓿根系平均直径的影响并不大。

图4 氮素形态对紫花苜蓿不同生育期根平均直径的影响Fig.4 Effects of nitrogen forms on the average root diameter of alfalfa at different growth stages
2.4 外源氮素形态对紫花苜蓿不同生育期根体积的影响
根系体积越大,植物与土壤的接触面积就越大,越有利于植物大范围吸收土壤水分、养分和微量元素[21]。由图5可见,不同氮素形态处理下,紫花苜蓿的根体积均随着生育时期的推进呈先迅速增加然后趋于稳定的变化趋势,这与根系生物量,根系表面积的变化情况基本相似。苗期,现蕾期和盛花期,紫花苜蓿的根体积均随着氮素水平的增加呈增大的变化趋势,各氮素形态处理下紫花苜蓿的根体积表现为:NO3--N和NH4+-N混合培养下最大,NH4+-N培养下次之,NO3--N培养下最低。NO3--N+NH4+-N的浓度为210 mg/L时,紫花苜蓿的根体积取得最大值。但结荚期,紫花苜蓿的根体积随着氮素水平的增加呈减小的变化趋势,同一形态的两个水平差异不显著,说明在苜蓿生长后期施氮会使根系生长减缓。

图5 氮素形态对紫花苜蓿不同生育期根体积的影响Fig.5 Effects of nitrogen forms on the root volume of alfalfa at different growth stages
2.5 外源氮素形态对紫花苜蓿不同生育期根系活力的影响
氮素形态对紫花苜蓿根系活力的影响见图6。有氮处理下紫花苜蓿的根系活力与对照相比均达到显著水平(P<0.05),盛花期和结荚期随着氮素水平的增加呈增大的变化趋势。苗期,在同一氮素水平下,不同氮素形态处理下紫花苜蓿根系活力的大小变化趋势为:NO3--N+NH4+-N>NH4+-N>NO3--N,各处理间差异显著(P<0.05)。混合态氮和NO3--N两个水平间差异也显著(P<0.05),NO3--N+NH4+-N的浓度为105 mg/L时,紫花苜蓿根系活力取得最大值。现蕾期,NO3--105处理下的根系活力高于NO3--210处理,且差异显著。鼓粒期,NO3--105处理下的紫花苜蓿根系活力最大。整个生育期,紫花苜蓿的根系活力总体表现为NO3--N和NH4+-N混合培养下最大,且随着生育期的推进呈增大的趋势,结荚期取得最大值,之后明显下降。

图6 氮素形态对紫花苜蓿不同生育期根系活力的影响Fig.6 Effects of nitrogen forms on the root activity of alfalfa at different growth stages
2.6 外源氮素形态对紫花苜蓿不同生育期根瘤数的影响
结果表明(图7),各氮素形态处理下紫花苜蓿的根瘤数显著大于CK(P<0.05),且随施氮量的增加,根瘤数目逐渐增加。相同氮素水平下,苗期,现蕾期和盛花期,不同氮素形态对紫花苜蓿根瘤数目的影响表现为:NO3--N和NH4+-N混合培养下最大,NH4+-N培养下次之,NO3--N培养下的最低,各氮素形态处理间差异显著(P<0.05),结荚期和鼓粒期则表现为:NO3--N和NH4+-N混合培养下最大,NO3--N培养下次之,NH4+-N培养下的最低。说明在苜蓿生长后期NH4+-N不利于根瘤的形成。整个生育期,紫花苜蓿根瘤数的变化趋势为:前期小,盛花期最大,之后又逐渐减小,且NH4+-N培养下减小的最快。NO3--N+NH4+-N的浓度为210 mg/L时,紫花苜蓿的根瘤数最大。

图7 氮素形态对紫花苜蓿不同生育期根瘤数的影响Fig.7 Effects of nitrogen forms on root nodule number of alfalfa at different growth stages
2.7 外源氮素形态对紫花苜蓿不同生育期根瘤重的影响
由图8可以明显看出,氮素形态对紫花苜蓿根瘤重有显著的影响。随着生育期的推进紫花苜蓿的根瘤重呈增大的趋势,在结荚期取得最大值,然后迅速降低。苗期和现蕾期,不同氮素形态处理下紫花苜蓿的根瘤重表现为:NO3--N和NH4+-N混合培养下最好,NH4+-N培养下次之,NO3--N培养下最低,且随着氮素水平的增加呈增加的变化趋势。盛花期,NO3-+NH4+-105处理下的根瘤重高于NO3-+NH4+-210处理,但差异不显著。结荚期,NO3--N和NH4+-N处理下的根瘤重在氮素浓度为105 mg/L显著高于氮素浓度为210 mg/L,说明根瘤本身生长需要一定量的氮素营养,但在生长后期氮素过量会抑制根瘤的生长。鼓粒期,在设定的氮素水平范围内,NO3--N处理下紫花苜蓿的根瘤重高于NH4+-N处理,但差异不显著。整个生育期,除盛花期,其余时期均在NO3-+NH4+的浓度为210 mg/L时,紫花苜蓿的根瘤重取得最大值。
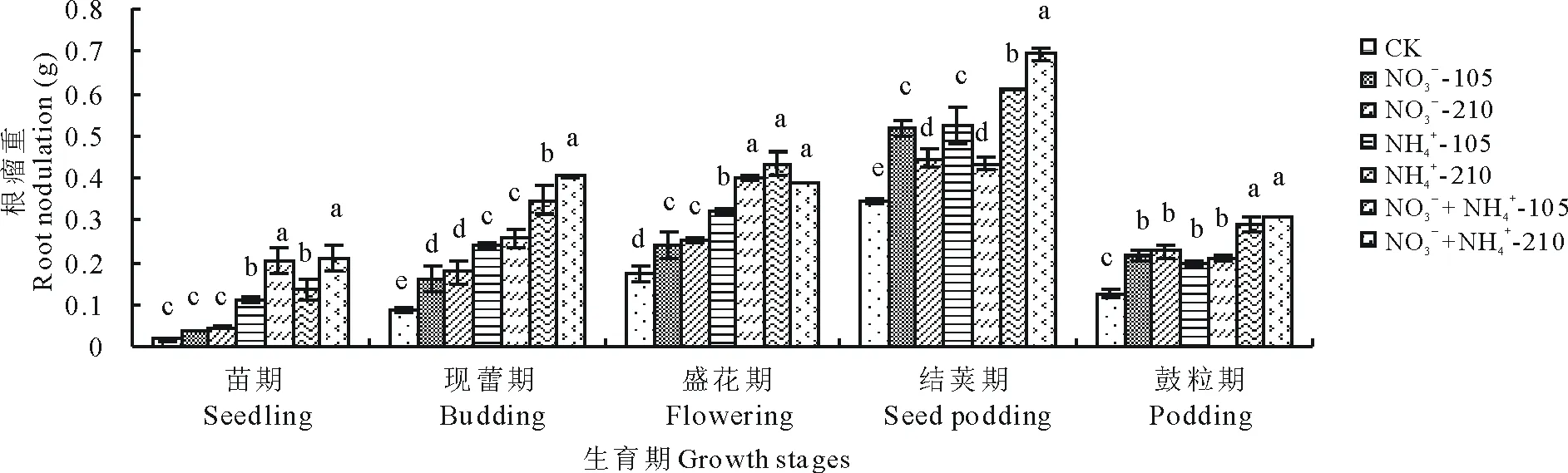
图8 氮素形态对紫花苜蓿不同生育期根瘤重的影响Fig.8 Effects of nitrogen forms on root nodulation of alfalfa at different growth stages
2.8 外源氮素形态对紫花苜蓿不同生育期固氮酶活性的影响
紫花苜蓿的固氮酶活性见图9,现蕾期和盛花期,氮素浓度为210 mg/L时紫花苜蓿的固氮酶活性高于氮素浓度为105 mg/L,均显著高于不施氮处理。同一氮素水平下,苗期,盛花期和结荚期,紫花苜蓿的固氮酶活性表现为:NO3--N和NH4+-N混合培养下最大,NH4+-N培养下次之,NO3--N培养下最低。整个生育期,各处理下紫花苜蓿的固氮酶活性均随着生育期的推进呈先增大后减小的变化趋势,在结荚期取得最大值。氮素浓度为105 mg/L时,各处理下紫花苜蓿的固氮酶活性在各时期均表现为:NO3--N和NH4+-N混合培养下最大,NH4+-N培养下次之,NO3--N培养下最低。氮素浓度为210 mg/L时,现蕾期和鼓粒期,各处理下紫花苜蓿的固氮酶活性表现为:NO3--N和NH4+-N混合培养下最大,NO3--N培养下次之,NH4+-N培养下最低,各氮素形态间差异显著(P<0.05),其余时期均为NH4+-N培养下的固氮酶活性好于NO3--N培养。现蕾期、盛花期和鼓粒期,NO3-+NH4+-210处理下紫花苜蓿的固氮酶活性最高,苗期和结荚期,NO3-+NH4+-105处理下紫花苜蓿的固氮酶活性最高。
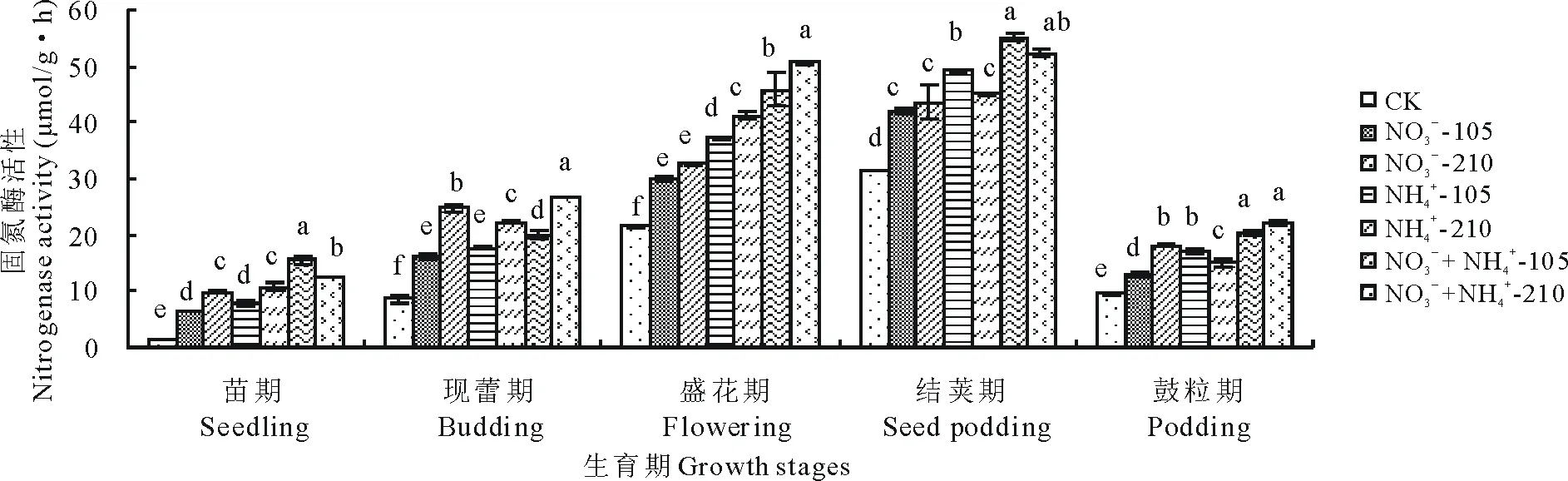
图9 氮素形态对紫花苜蓿不同生育期固氮酶活性的影响Fig.9 Effects of nitrogen forms on nitrogenase activity of alfalfa at different growth stages

时期Time项目Itemx1x2x3x4x5x6x7x8苗期Seedlingx11.0000.920**0.984**0.984**0.977**0.992**0.856**0.880**x21.0000.863**0.961**0.952**0.916**0.969**0.774*x31.0000.943**0.935**0.981**0.816*0.866**x41.0000.997**0.981**0.903**0.888**x51.0000.979**0.901**0.898**x61.0000.879**0.902**x71.0000.716*x81.000现蕾期Buddingx11.0000.967**0.972**0.953**0.986**0.965**0.988**0.782*x21.0000.954**0.867**0.971**0.936**0.976**0.676*x31.0000.897**0.961**0.969**0.985**0.724*x41.0000.945**0.926**0.912**0.923**x51.0000.983**0.977**0.801*x61.0000.957**0.796*x71.0000.721*x81.000盛花期Floweringx11.0000.983**0.995**0.953**0.977**0.971**0.904**0.992**x21.0000.972**0.952**0.979**0.940**0.872**0.974**x31.0000.965**0.982**0.985**0.904**0.996**x41.0000.979**0.952**0.850**0.965**x51.0000.976**0.918**0.991**x61.0000.937**0.990**x71.0000.935**x81.000结荚期Seedpoddingx11.0000.963**0.974**0.916**0.954**0.729*0.824*0.932**x21.0000.954**0.878**0.890**0.795*0.859**0.874**x31.0000.888**0.902**0.699*0.758*0.866**x41.0000.854**0.750*0.904**0.955**x51.0000.796*0.792*0.929**x61.0000.863**0.785*x71.0000.861**x81.000鼓粒期Poddingx11.0000.722*0.979**0.977**0.931**0.708*0.860**0.842**x21.0000.797*0.814*0.751*0.985**0.957**0.847**x31.0000.967**0.910**0.775*0.920**0.920**x41.0000.967**0.815*0.908**0.877**x51.0000.776*0.860**0.876**x61.0000.950**0.841**x71.0000.937**x81.000
注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01);x1:根系生物量;x2:根系表面积;x3:根平均直径;x4:根体积;x5:根系活力;x6:根瘤数;x7:根瘤重;x8:固氮酶活性。
Note:*indicates significant correlations(P<0.05),**indicates significant correlations(P<0.01);x1:Underground biomass;x2:Root surface area;x3:Average root diameter;x4:Root volume;x5:Root activity;x6: Root nodule number;x7:Root nodulation;x8:Nitrogenase activity.
2.9 不同时期各指标的相关分析
对不同生育期的各指标进行相关性分析,结果如表1所示,苗期,根瘤重与根平均直径,根表面积与固氮酶活性,根瘤重与固氮酶活性均呈显著正相关关系(P<0.05),相关系数都达到了70.0%以上,其余各指标之间均呈极显著正相关关系(P<0.01),相关系数都达到了85.0%以上。现蕾期,固氮酶活性与根系生物量、根表面积、根平均直径、根系活力、根瘤数、根瘤重均呈显著正相关关系(P<0.05),其余各指标间均呈极显著正相关关系(P<0.01)。盛花期,各指标之间均呈极显著正相关关系(P<0.01),相关系数都达到了85.0%以上。结荚期,根瘤数与根系生物量、根系表面积、根体积、根平均直径、根系活力,根瘤重与根系生物量、根表面积、根系活力、固氮酶活性之间均呈显著正相关关系(P<0.05),相关系数都达到了70.0%以上,其余各指标间均呈极显著正相关关系(P<0.01)。鼓粒期,根系生物量与根系表面积、根体积、根系活力、根平均直径、根瘤数,根瘤数与根平均直径、根体积、根系活力均呈显著正相关关系(P<0.05),其余各指标间均呈极显著正相关关系(P<0.01)。
3 讨论与结论
从本研究结果发现,在本试验的氮素浓度下,紫花苜蓿的根系生物量、根系表面积、根系活力、根瘤数、根瘤重均高于CK, NO3--N和NH4+-N混合培养下表现最优,NH4+N培养下次之,NO3--N培养下最低,本课题组在前期对紫花苜蓿的研究中也发现NH4+-N培养下苗期生长优于NO3--N培养[4],说明虽然NO3--N和NH4+-N均能促进根系的生长,但NH4+-N处理下根系生长好于NO3--N,二者以一定的比例混合使用更有利于根系的生长以及根表面积的增加,张辰明等[22]的研究中发现,NO3--N和NH4+-N混合使用最有利于水稻根系的生长。Saravitz等[23]研究表明,在等氮量的情况下,与单独供应NH4+-N相比,等比例供应NO3--N和NH4+-N使大豆在10 d内的累积吸收增加了1倍,NH4+的吸收是NO3-吸收的两倍。
增施氮肥能明显增加紫花苜蓿的鲜干草产量及营养品质[24],而紫花苜蓿产草量的决定因素之一是根系的生长发育状况,所以施氮直接影响紫花苜蓿的根系生长。在本研究中无论是NO3--N、NH4+-N还是混合态氮作用下,紫花苜蓿的根系特性都呈现出随着氮素浓度的增加,根系生物量,根表面积,根体积,根系活力均增大的趋势。在NO3-+NH4+的浓度为210 mg/L时,各指标均达到最大值,说明施用一定量的氮肥对紫花苜蓿的根系生长发育有促进作用,进而提高苜蓿的产量。紫花苜蓿等豆科植物施用适量的“起爆氮”,能显著促进植物的前期生长。王树起等[25]对大豆的研究也证实了这一点。
就氮素吸收过程而言,决定吸氮量的另一个因素是生育期。本研究发现,各处理下紫花苜蓿的根系各指标均随着生育期的推进呈先增加后减小的单峰变化趋势。在整个生育期中,苗期施氮处理的根系生物量、根瘤数和根瘤重与对照相比增幅最显著,且与氮素浓度正相关,说明苗期是紫花苜蓿整个生育期的氮营养关键期,此时紫花苜蓿根瘤尚未形成或不具备固氮能力,因此,需要大量补充外源氮;并且,苗期施氮可以很好地促进紫花苜蓿的根系发育,使根系生物量增加,一方面可提高紫花苜蓿根系的营养吸收能力,另一方面,可为根瘤菌侵染和结瘤提供充分的物质条件。此外,现蕾期和盛花期的氮素养分管理也不容忽视,因为本研究结果表明,紫花苜蓿的根系生物量,根体积、根瘤数和固氮酶活性从苗期到现蕾期,现蕾期到盛花期的增幅最大,说明紫花苜蓿苗期到盛花期是氮营养吸收旺盛期,此时及时补充外源氮素,氮肥效率高,可促进紫花苜蓿产量和品质的形成。王丹英和汪自强[26]、何建国等[16]关于大豆最佳氮肥施用时期的研究也认为,大豆营养生长阶段的最佳追肥时间应为苗期、现蕾期和盛花期。从本试验看,紫花苜蓿从盛花期到结荚期,各处理下各根系指标基本趋于稳定的变化趋势,紫花苜蓿从营养生长进入生殖生长,植株已经定型,生长不如现蕾期和盛花期旺盛,但仍需要氮素来维持紫花苜蓿生殖生长,促进籽粒的发育,所以应该适量施氮。从结荚期到鼓粒期,紫花苜蓿的根瘤数、根瘤重和固氮酶活性开始急速下降,可能是生长后期外源氮过多会抑制根瘤的生长,董守坤等[27]在大豆的研究中也得出了同样的结论。从相关性分析上可以看出,苗期,现蕾期和盛花期,紫花苜蓿的各指标间均呈显著正相关关系,这恰恰反映了在以上3个时期各指标对紫花苜蓿的根系生长和生物量的积累有明显的促进作用,他们之间密切联系、彼此影响;也说明在生长前期施肥最能促进紫花苜蓿的生长,甘银波等[15]对大豆的研究也得出了相似的结论。
本研究还发现,在NH4+-N营养条件下随着生育的推进,从结荚期到鼓粒期,紫花苜蓿的根系活力、根瘤数和根瘤重下降最快,NH4+-N培养下紫花苜蓿的根瘤数显著低于NO3--N培养。Li等[28]在水稻的研究中也发现随着培养时间的增长,大量的NH4+-N来不及利用和转移,根系中NH4+-N浓度过大,对水稻的根系生长起到抑制作用,根尖数增加明显变小,根系变短变粗,根表面呈暗棕色等症状。贾彦博等[29]研究也表明供应过量NH4+-N则对根系有一定毒害作用,会抑制根系的生长发育,降低根系生物量。
综上所述,NO3--N和NH4+-N均能促进紫花苜蓿各时期根系生长,但二者混合使用效果最佳,当NO3--N+NH4+-N的浓度为210 mg/L时,紫花苜蓿根系生长最好。紫花苜蓿整个生育期中,外源氮素供应的适宜时期为苗期、现蕾期和盛花期,此时施氮,肥料报酬率高,且可有效促进紫花苜蓿的生长。
[1] Fan F, Zhang Q G, Zhang Y L,etal. Fertilization effects on alfalfa nodule. Bulletin of Agricultural Science and Technology, 2006, (7): 96-98. [2] Yan J, Han X Z, Wang S Y,etal. Effect of different forms nitrogen on nodule growth and nitrogen fixation in Soybean. Soybean Science, 2009, 28(4): 674-677.
[3] Liu X J, Liu Y N. Effects of different N levels on productivity and quality of alfalfa varieties. Acta Agrestia Sinica, 2013, 7(4): 702-707.
[4] Liu X J, Kuai J L, Li W Q,etal. Effects of NH4+-N and NO3--N on root growth, nodulation and nitrogen-fixation of alfalfa. Journal of Gansu Agricultural University, 2011, 46(5): 106-110.
[5] Heidi T, Heuberger J, Kling G,etal. Contribution of N uptake and morphological root characteristics to N efficiency in tropical maize cultivars. Crop Production, 2002, 29: 958-963.
[6] Xu G W, Li S, Zhao Y F,etal. Effects of straw returning and nitrogen fertilizer application on root secretion and nitrogen utilization of rice. Acta Prataculturae Sinica, 2014, 23(2): 140-146.
[7] Peng L Q, Li X Y, Qi X,etal. The relationship of root traits with persistence and biomass in 10 alfalfa varieties. Acta Prataculturae Sinica, 2014, 23(2): 147-153.
[8] Kuai J L, Liu X J, Li W Q. Effects of different nitrogen levels on the growth characteristics of alfalfa inoculated with rhizobium. Grassland and Turf, 2010, 31(3): 56-59.
[9] Linkohr B I, Williamson L C, Fitter A H,etal. Nitrate and phosphate availability and distribution have different effects on root system architecture ofArabidopsis. The Plant Journal, 2002, 29(6): 751-760.
[10] Chen P, Feng K, Wang X L,etal. Effects of pH on uptake of different forms of nitrogen by young core. Journal of Yangzhou University (Agricultural and Life Sciences Edition), 2003, 24(3): 46-50.
[11] Yang X E, Sun X. Different varieties of NH4+-N and NO3--N absorption kinetics. Chinese Journal of Soil Science, 1991, 22(5): 222-224.
[12] Qiao Y F, Miao S J, Han X Z. Effects of nitrogen forms on the root morphology and proton extrusion in soybean. Soybean Science, 2006, (3): 265-269.
[13] Sun M, Guo W S, Sun T F,etal. Effects of nitrogen forms on root characteristics in wheat. Journal of Yangzhou University (Agricultural and Life Sciences Edition), 2007, 28(1): 54-57.
[14] Song H X, Shen S L, Ma S Y,etal. Effects of NH4+-N and NO3--N on the nitrogen fixation of soybean nodules. Soybean Science, 1997, 16(4): 283-286.
[15] Gan Y B, Tu X W, Tian R J. Study on optimum timing of nitrogen application on soybean. Soybean Science, 1998, 17(4): 287-291.
[16] He J G, Yan H, Jia J C,etal. Effect of nitrogen management on growth and yield of soybean. Soybean Bulletin, 1990, (10): 11-15.
[17] Zhang Q, Zhang L, Wei S Q,etal. Effects of Ca2+on acid tolerance ofMedicagosativaandRhizobiummeliloti. Chinese Journal of Applied Ecology, 2007, 18(6): 1231-1236.
[18] Sun J G, Zhang Y C, Xu J,etal. Isolation and biological characteristic investigation on efficient nitrogen-fixing bacilli. Scientia Agricultura Sinica, 2009, 42(6): 2043-2051.
[19] Wang F, Liu B, Zhu J W. Effect of magnesium (Mg) on root activity, chlorophyll content and permeability of soybean. Journal of Agro-Environment Science, 2004, 23(2): 235-259.
[20] Yao T, Zhang D G, Hu Z Z. Associative nitrogen-fixing bacteria in the rhizosphere ofAvenasativain an alpine region I Isolation an identification. Acta Prataculturae Sinica, 2004, 13(2): 106-111.
[21] Nan L L, Shi S L, Zhang J H. Study on root system development ability of different root-type alfalfa. Acta Prataculturae Sinica, 2014, 23(2): 117-124.
[22] Zhang C M, Xu Y H, Zhao H J. Effects of different nitrogen forms on nitrogen uptake and root growth of rice at the seedling stage. Journal of Nanjing Agricultural University, 2011, 34(3): 72-76.
[23] Saravitz C H, Chaillou S, Mussel J,etal. Influence of nitrate on uptake of ammonium by niteogen-depleted soybean: is the dffect located in roots or shoot. Journal of Experimental Botany, 1994, 280(45): 1575-1584.
[24] Liu Y N, Liu X J, Zhang X L,etal. Effect of clipping and fertilization on production performance of different alfalfa varieties. Grassland and Turf, 2013, 33(3): 69-73.
[25] Wang S Q, Han X Z, Qiao Y F. Root morphology and nitrogen accumulation in soybean (GlycinemaxL.) under different nitrogen application levels. Chinese Journal of Eco-Agriculture, 2009, 17(6): 1069-1073.
[26] Wang D Y, Wang Z Q. Effect of planting date, plant density and nitrogen application rate on yield and quality of vegetable soybean. Journal of Zhejiang University (Agricultural and Life Sciences Edition), 2001, 27(1): 69-72.
[27] Dong S K, Liu L J, Sun C Z,etal. Effects of nitrogen levels on nodule growth of soybean using15N tracing method. Plant Nutrition and Fertilizer Science, 2011, 17(4): 985-988.
[28] Li B Z, Xin W J, Sun S B,etal. Physiological and molecular responses of nitrogen starved rice plants to re-supply of different nitrogen sources. Plant and Soil, 2006, 287(1-2): 145-159.
[29] Jia Y B, Yang X E, Liu J X. Morphological and physiological adaptation of plant root to nutrient defficit and elemental toxicity stress. Chinese Journal of Soil Science, 2005, 36(4): 610-616.
参考文献:
[1] 范富, 张庆国, 张永亮, 等. 施肥对紫花苜蓿根瘤的影响. 农业科技通报, 2006, (7): 96-98.
[2] 严君, 韩晓增, 王守宇, 等. 不同形态氮对大豆根瘤生长及固氮的影响. 大豆科学, 2009, 28(4): 674-677.
[3] 刘晓静, 刘艳楠. 供氮水平对不同紫花苜蓿产量及品质的影响. 草地学报, 2013, 7(4): 702-707.
[4] 刘晓静, 蒯佳林, 李文卿, 等. 硝态氮与铵态氮对紫花苜蓿根系生长及结瘤固氮的影响. 甘肃农业大学学报, 2011, 46(5): 106-110.
[6] 徐国伟, 李帅, 赵永芳, 等. 秸秆还田与施氮对水稻根系分泌物及氮素利用的影响研究. 草业学报, 2014, 23(2): 140-146.
[7] 彭岚清, 李欣勇, 齐晓, 等. 紫花苜蓿品种根部特性与持久性和生物量的关系. 草业学报, 2014, 23(2): 147-153
[8] 蒯佳林, 刘晓静, 李文卿. 不同氮素水平对接种根瘤菌紫花苜蓿生长特性的影响. 草原与草坪, 2010, 31(3): 56-59.
[10] 陈平, 封克, 汪晓丽, 等. 营养液pH对玉米幼苗吸收不同形态氮素的影响. 扬州大学学报(农业与生命科学版), 2003, 24(3): 46-50.
[11] 杨肖娥, 孙羲. 不同水稻品种NH4+-N和NO3--N吸收的动力学. 土壤通报, 1991, 22(5): 222-224.
[12] 乔云发, 苗淑杰, 韩晓增. 氮素形态对大豆根系形态性状及释放H+的影响. 大豆科学, 2006, (3): 265-269.
[13] 孙敏, 郭文善, 孙陶芳, 等. 氮素形态对小麦根系特性影响的初步研究. 扬州大学学报: 农业与生命科学版, 2007, 28(1): 54-57.
[14] 宋海星, 申斯乐, 马淑英, 等. 硝态氮和氨态氮对大豆根瘤固氮的影响. 大豆科学, 1997, 16(4): 283-286.
[15] 甘银波, 涂学文, 田任久. 大豆的最佳氮肥施用时期研究. 大豆科学, 1998, 17(4): 287-291.
[16] 何建国, 严华, 贾金川, 等. 不同氮肥管理对大豆生长及产量的影响. 大豆通报, 1990, (10): 11-15.
[17] 张琴, 张磊, 魏世清, 等. 钙离子对紫花苜蓿及苜蓿根瘤菌耐酸能力的影响. 应用生态学报, 2007, 18(6): 1231-1236.
[18] 孙建光, 张燕春, 徐晶, 等. 高效固氮芽孢杆菌筛选及其生物学特性. 中国农业科学, 2009, 42(6): 2043-2051.
[19] 王芳, 刘鹏, 朱靖文. 镁对大豆根系活力叶绿素含量和膜透性的影响. 农业环境科学学报, 2004, 23(2): 235-259.
[20] 姚拓, 张德罡, 胡自治. 高寒地区燕麦根际联合固氮菌研究Ⅰ: 固氮菌分离及鉴定. 草业学报, 2004, 13(2): 106-111.
[21] 南丽丽, 师尚礼, 张建华. 不同根型苜蓿根系发育能力研究. 草业学报, 2014, 23(2): 117-124.
[22] 张辰明, 徐烨红, 赵海娟. 不同氮形态对水稻苗期氮素吸收和根系生长的影响. 南京农业大学学报, 2011, 34(3): 72-76.
[24] 刘艳楠, 刘晓静, 张晓磊, 等. 施肥与刈割对不同紫花苜蓿品种生产性能的影响. 草原与草坪, 2013, 33(3): 69-73.
[25] 王树起, 韩晓增, 乔云发. 施氮对大豆根系形态和氮素吸收积累的影响. 中国生态农业学报, 2009, 17(6): 1069-1073.
[26] 王丹英, 汪自强. 播期、密度、氮肥用量对菜用大豆产量和品质的效应. 浙江大学学报(农业与生命科学版), 2001, 27(1): 69-72.
[27] 董守坤, 刘丽君, 孙聪姝, 等. 利用15N标记研究氮素水平对大豆根瘤生长的影响. 植物营养与肥料学报, 2011, 17(4): 985-988.
[29] 贾彦博, 杨肖娥, 刘建祥. 植物根系对养分缺乏和毒害的适应及其与养分吸收效率的关系. 土壤通报, 2005, 36(4): 610-616.
Effects of exogenous nitrogen forms on root characteristics of alfalfa at different growth stages
LIU Xiao-Jing1,2, YE Fang1,2, ZHANG Xiao-Ling1,2
1.CollegeofGrasslandScience,GansuAgriculturalUniversity,Lanzhou730070,China; 2.KeyLaboratoryofGrasslandEcosystemofMinistryofEducation/Sino-U.S.CentersforGrazingLandEcosystemSustainability,Lanzhou730070,China
This paper reports research on the effect of exogenous nitrogen on the root characteristics of “Gannong No. 3” Alfalfa at different growth stages. Samples were cultivated for the whole growth period using the sand culture method under the condition of complete nutrient solution. Three exogenous nitrogen forms (nitrate nitrogen, ammonium nitrogen and nitrate nitrogen) were investigated; with the ammonium nitrogen solution at 1∶1 and the others are three solution levels (CK, 105, 210 mg/L). Results showed that under different forms of nitrogen treatment, the root biomass, root surface area, root volume, root activity, root nodule number, nodule weight, and nitrogenase activity of alfalfa are significantly higher than that of CK. With increasing nitrogen levels, there were increases in the proportions of alfalfa root biomass, root surface area, root volume, root activity, root nodule number, nodule weight and nitrogenase activity. The effects are in the following order: NO3--N and NH4+-N mixed culture the highest, followed by NH4+-N and with NO3--N the lowest. The impact on root average diameter was not large. The maximum values were reached by NO3-+NH4+with a concentration of 210 mg/L. In terms of the whole growth stage, root biomass, root surface area, root activity, root nodule number, nodule weight and nitrogenase activity were significantly different during the seedling, budding and flowering stages. However, differences during seed podding and podding were not significant.
Alfalfa (Medicagosativa); nitrate nitrogen; ammonium nitrogen; growing; root characteristics
10.11686/cyxb2014269
http://cyxb.lzu.edu.cn
2014-06-09;改回日期:2014-09-12
国家自然科学基金(31460622),草业生态系统教育部重点实验室(甘肃农业大学)项目(CYZS-2011012)和甘肃省财政厅项目资助。
刘晓静(1968-),女,甘肃酒泉人,博士,教授。 E-mail:liuxj@gsau.edu.cn
刘晓静, 叶芳, 张晓玲. 外源氮素形态对紫花苜蓿不同生育期根系特性的影响. 草业学报, 2015, 24(6): 53-63.
Liu X J, Ye F, Zhang X L. Effects of exogenous nitrogen forms on root characteristics of alfalfa at different growth stages. Acta Prataculturae Sinica, 2015, 24(6): 53-63.

