热习服对中长跑运动员湿热环境下运动体液调节激素及Hsp70 的影响
吴卫兵 王人卫 李国强 许弟群
1 上海体育学院运动科学学院(上海200438)
2 上海体育学院竞技体育学校
高温高湿环境条件下, 运动机体承受着高温和运动的双重刺激,机体的体温调节系统、心血管系统和神经内分泌系统等受到极大的影响, 表现出机体的核心温度、心率和体液调节激素等指标发生明显变化[1-5]。就体液调节激素而言,目前研究最多的体液调节激素包括醛固酮、精氨酸加压素、心钠素和去甲肾上腺素等[6,7],高温高湿环境运动过程中这些体液调节激素对维持机体的水盐代谢平衡发挥着积极的作用, 但其内在作用机制尚未完全清楚, 这些激素体液调节的相互关系还未见更多的报道。同时,热习服作为提高机体高温高湿环境运动能力的一种有效手段, 国内目前还是以动物实验研究为主[8,9],不能更好地用于指导高温高湿环境下运动员热习服的实践应用。 本研究以中长跑运动员为实验对象, 观察热习服运动员和未热习服运动员一次热负荷运动前后体液调节激素和热休克蛋白(Hsp70)的变化, 探讨高温高湿环境下运动机体体液调节激素的作用机理, 为提高运动员高温高湿的训练效果和热习服应用提供实验依据和实践指导。
1对象与方法
1.1 实验对象
实验对象为上海体育学院附属竞技体育学校中长跑男性运动员16 人,均为国家二级运动员,随机分为对照(HC)组8 人和热习服(HA)组8 人,基本情况见表1。 实验前向受试对象说明实验的目的和流程,以及实验过程中可能存在的风险, 并与实验对象签订知情同意书。 同时, 对实验对象进行医学检查和健康问卷调查,以及体质测试与评估,排除实验对象的健康隐患。研究实验设计得到上海市营养学会医学伦理委员会医学伦理论证([伦审]2013-001)。

表1 实验对象基本情况
1.2 实验设计
正式实验前1 周, 对实验对象进行最大摄氧量测试(以便为实验对象制定运动强度)。 利用运动心肺功能 仪 (K4b2,Cosmed,Italy) 和 可 调 式 功 率 自 行 车(Ergoselect 100,Ergoline,Germany), 采 用 每 口 气(Breath by Breath)采集法进行最大摄氧量测试。
实验设计安排:热习服组经过10 天热习服,热习服结束24 h 后进行一次热负荷测试,对照组不进行热习服,直接进行一次热负荷测试;热负荷测试的运动强度为个体70% VO2max。 具体安排如表2。

表2 实验设计安排
正式实验前3 天, 实验对象来到实验室熟悉实验环境及整个实验流程。正式实验时,实验对象提前1 小时到达实验室,并要求空腹2 小时以上、保持良好的水合状态,热负荷运动前排空大小便,为避免生理节律的影响,热负荷运动时间统一为上午9:30~11:30,整个实验安排在冬季,室外温度低于20℃。两组实验对象整个实验期间其它体育活动量相一致, 实验期间禁止任何药物和烟酒刺激品。
热负荷运动过程中, 实验对象出现下列情况之一则终止运动:(1)伴有明显的头痛、头晕、恶心、呕吐等自觉症状;(2)心率超过个人最高心率;(3)身体已经到达力竭状态。
1.3 热习服方案
于环境温度为33℃、 湿度为80%RH 的环境舱内进行为期10 天(d)的热习服运动,第1d 环境舱内自由活动暴露60 min,第2 d 至第10 d 每天先热身5 min,然后以40%VO2max 强度蹬踏功率自行车(Ergoselect 100,Ergoline,Germany) 运动3 次15 min, 次间休息5 min,功率自行车蹬踏速度要求55 rpm 左右(踏频屏闪指示灯显示绿色)。 热习服选择40%VO2max 运动强度是基于对热应激与运动应激的考虑, 参考相关文献报道[10,11],对于有良好训练的运动员,中等强度(大约50%VO2max)下运动对人体主要产生热适应,不能充分引起运动适应。
热习服实验地点为上海体育学院运动环境实验室, 环境舱由美国Submital A&S 公司建造, 规格长×宽×高为4.88 m × 3.06 m × 3.70 m, 温度可控范围-40℃至100℃,湿度可控范围1%~95%RH,通过温湿度调控器可以设定热习服过程中环境舱的温度和湿度。环境舱四周封闭,顶部有日光灯照明,环境舱门装有透明玻璃,舱壁有温度和湿度传感器探头,感应环境舱内的温度和湿度变化,通风换气由管道与外界连接,工作状态下环境舱空气流量为1830CFM,噪音70dB。
1.4 指标测试
1.4.1 核心温度、心率和出汗率测试
核心温度(Core Temperature,Tc)测试:让实验对象俯卧露出臀部,将体温计(Crw11,上海华辰,中国)甩至35 ℃以下, 将涂有凡士林的体温计水银端轻轻插入肛门内约3~4 cm,扶住体温计,5 min 后取出读数。
心率(Heart Rate,HR)测试:运动实验过程中佩带Polar 心率表(Rcx5,Polar electro, Finland),通过功率自行车全程接收监测实验对象的心率变化。
出汗率(Sweat Rate,SR)为每小时每平方米单位体表面积皮肤丢失的汗液公斤重量(kg/m2/h),其中出汗量由运动前后裸重之差值计算,人体体表面积(m2)计算参考胡咏梅针对中国男性制定的公式[12],S男= 0.0057 ×身高(cm) + 0.0121 × 体重(kg) + 0.0882。
1.4.2 血常规、血清激素和Hsp70 测试
肘静脉取血,1 ml 注入肝素钠抗凝管测试血常规,3 ml 注入促凝管, 静置1~2 小时,3000 转/分离心10 min, 取上清液分装后置于-70 ℃保存待测血清激素和Hsp70。
血常规测试: 使用全自动血液分析仪 (XS-500i,Sysmex,Japan)测试血常规,获得红细胞压积(Hct)数值。
血清激素和Hsp70 测试:醛固酮(ALD)、精氨酸加压 素(AVP)、心 钠 素(ANP)、去 甲 肾 上 腺 素(NE)和Hsp70 采用双抗体两步夹心酶联免疫吸附法(ELISA)检测,试剂盒由美国R&D 公司提供,仪器使用芬兰雷博MK3 型酶标仪,严格按说明书操作。
1.5 数据统计分析
采用SPSS15.0 统计软件进行数据统计处理分析,各指标数值结果均以均数±标准差(±s)表示。 HA 组和HC 组组间数据比较采用独立样本t 检验(Independent-Sample T Test),HA 组或HC 组组内数据比较采用配对样本t 检验(Paired-Samples T Test),以P<0.05 为差异具有显著性, 以P <0.01 为差异具有非常显著性。
2结果
2.1 热习服过程中心率、核心温度和出汗率变化
由图1 可见, 由于第1 天只是热暴露,HR、Tc 和SR 水平均为最低;从热习服的第2 天开始,热习服组HR 水平呈现进行性下降变化, 第2、6 和10 天HR 分别 为127.00 ± 13.08 b/min、124.43 ± 11.44 b/min、123.00 ± 9.63 b/min;Tc 和SR 水平呈现波动变化,其中Tc 表现出较为明显的下降趋势,SR 表现与Tc 变化趋于一致, 第2 天的Tc 和SR 分别为38.36 ± 0.32 ℃、0.62 ± 0.21 kg/m2/h,第6 天的Tc 和SR 分别为38.19 ±0.24 ℃、0.61 ± 0.32 kg/m2/h, 第10 天的Tc 和SR 分别为38.08 ± 0.17 ℃、0.53 ± 0.20 kg/m2/h。 整个热习服期间,第1 天到第2 天HR、Tc 和SR 变化幅度最大,表现为水平迅速上升。

图1 热习服组10 天热习服过程中心率、核心温度和出汗率
2.2 热负荷运动前后核心温度、心率、出汗率和红细胞压积变化
由表3 可见,HA 组和HC 组运 动前Tc 和HR 均无显著性差异(P > 0.05)。与运动前相比,HC 组运动后Tc 非常显著性升高(P < 0.01)、HR 非常显著性升高(P< 0.01),HA 组运动后Tc 非常显著性升高(P < 0.01)、HR 非常显著性升高(P < 0.01)。HA 组和HC 组运动后SR 无显著性差异(P > 0.05)。 总体看来,HA 组运动后Tc 和HR 水平低于HC 组、SR 水平高于HC 组,但两组间无显著性差异。 与运动前相比,HA 组和HC 组运动后红细胞压积(Hct)均非常显著性升高(P < 0.01),但两组间无显著性差异。
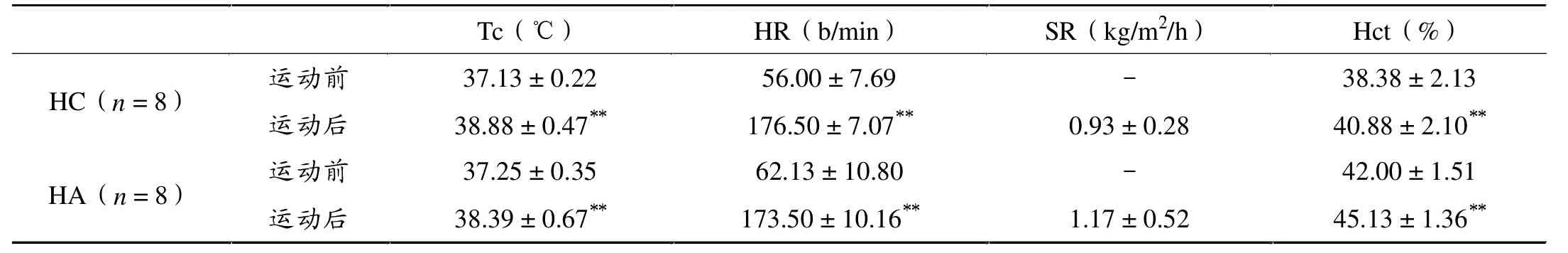
表3 热负荷运动前后Tc、HR、SR 和Hct
2.3 热负荷运动前后血清激素变化
由表4 可见,HA 组和HC 组运动前ALD、AVP、ANP 和NE 均无显著性差异 (P > 0.05)。 与运动前相比,HC 组运动后ALD 非常显著性升高 (P < 0.01)、AVP 显著性升高 (P < 0.05)、ANP 显著性降低 (P <0.05)、NE 非常显著性升高(P < 0.01)。 与运动前相比,HA 组运动后ALD 非常显著性升高(P < 0.01)、AVP 显著性升高(P < 0.05)、ANP 显著性降低(P < 0.05)、NE非常显著性升高(P < 0.01)。运动后ALD、AVP、ANP 和NE 水平在两组间未见显著性差异(P > 0.05)。

表4 热负荷运动前后ALD、AVP、ANP 和NE
2.4 热负荷运动前后血清Hsp70 变化
由表5 可见,HA 组和HC 组运动前Hsp70 无显著性差异(P > 0.05)。 与运动前相比,HC 组运动后Hsp70非常显著性升高(P < 0.01),HA 组运动后Hsp70 非常显著性升高(P < 0.01)。 HA 组和HC 组运动后Hsp70无显著性差异(P > 0.05)。

表5 热负荷运动前后Hsp70
3讨论
心率、核心温度、出汗率是评价机体热习服及其习服程度的重要生理学指标[13-15]。 从本研究热习服组10天热习服过程中心率、 核心温度和出汗率实验结果来看,随着10 天热习服的进程,实验对象的心率、核心温度和出汗率出现一个规律性的适应变化,从热适应第2天开始,心率呈现进行性下降变化,核心温度虽然在热习服过程中发生上下波动, 但整体表现出明显的下降趋势。表明热习服组经过10 天热习服后已经一定程度上产生热习服。
同样,心率、核心温度、出汗率也是机体热调节反应的生理学指标, 本研究对照组和热习服组经过一次热负荷运动后,心率和核心温度显著性升高,出汗率明显增加。两组之间各指标差异无统计学意义,但总体看来, 热习服组热负荷运动后的心率和核心温度低于对照组、出汗率高于对照组,热习服组运动前后核心温度平均变化值和心率平均变化值也均小于对照组。 研究结果表明, 热习服一定程度上降低了机体对热负荷运动应激的生理热调节反应, 提高了机体热环境运动的能力。
体液调节激素包括ALD、AVP 和ANP 等, 对维持机体的水盐代谢平衡起着重要的作用[6,8]。 本研究热负荷运动后,实验对象的ALD 显著性升高。 在高温高湿环境下,运动机体首先出现一系列的生理应激反应,表现为体温升高、 刺激下丘脑发汗中枢促进汗腺大量分泌汗液; 大量汗液的丢失会导致机体有效循环血量减少,肾动脉压下降,引起肾素分泌和血管紧张素II 浓度升高,刺激肾上腺皮质球状带分泌ALD。 ALD 水平的升高进一步促进肾小管对Na+和水重吸收,降低汗液中Na+浓度,起到保Na+排K+的作用。
本研究热负荷运动后,实验对象的AVP 显著性升高。 实验结果与Kenefick 等[6]研究报道相一致。AVP 受血容量和血浆渗透压变化的影响, 从红细胞压积实验结果来看,热负荷运动后红细胞压积明显升高,说明了机体可能由于大量出汗而导致机体血容量下降。 高温高湿运动中机体血容量减少, 可刺激容量感受器使传入冲动经迷走神经传入中枢,促进下丘脑-神经垂体释放AVP;同时,随着血浆容量的减少,伴随着血浆渗透压升高, 可刺激机体下丘脑渗透压感受器,渗透压感受器受刺激后引起神经垂体释放AVP, 促进机体对水的重吸收。 对于对AVP 的影响,血容量变化起着先导的作用, 血容量变化会导致血浆渗透压的改变从而进一步反射性影响AVP 释放。
同时, 本研究也发现, 热负荷运动后实验对象的ANP 明显减低、NE 明显升高。 ANP 分泌受心房的机械牵张和糖皮质类固醇、内皮素等体液物质的影响,具有明显的促进NaCl 和水排出作用。 研究结果与Amorim等[16,17]研究报道相一致,ANP 对机体体液调节是通过抑制下丘脑-神经垂体释放AVP 和抑制AVP 增强肾集合管水通透性来实现,此外ANP 还能够抑制肾上腺皮质球状带细胞分泌ALD 来进行机体体液调节。 热负荷运动过程中, 机体应激性地使NE 与心肌细胞膜上受体进一步结合,通过增加心率、增强心肌收缩力,有效调节高温高湿环境运动机体血流流向体表, 提高机体的排汗能力。
综合热负荷运动后体液调节激素的变化, 表现为ALD、AVP、NE 显著升高和ANP 显著降低,表明热负荷运动使机体体液激素发生显著性的变化以适应机体热应激反应, 提示热习服增强了机体应对热应激的体液调节能力。 实验结果进一步提示ALD、AVP 和ANP 在机体体液调节中相互作用和相互影响, 共同调节和维护机体的水盐代谢和平衡。
热休克蛋白是目前研究报道较多的一种细胞保护蛋白,高温、运动和损伤等因素均可诱导其表达,表达的强弱与机体承受负荷大小、 组织细胞损害程度有关[7,9]。已有的研究表明, 运动能够诱导热休克蛋白70 在血液、肝脏、心脏、骨骼肌表达增多,提高机体对运动的耐受性,抵抗运动对机体的损害[7,9,18]。目前,有关运动诱导热休克蛋白表达的机制还未完全清楚, 有学者认为运动过程中体温升高可能对热休克蛋白的表达起一定的作用。 从本研究的实验结果来看,热负荷运动后对照组和热习服组热休克蛋白70 水平均非常显著性升高,但组间未见显著性差异, 表明高温和运动诱导了热休克蛋白70 大量表达,但有关热习服与非热习服对机体热休克蛋白的不同影响还有待进一步研究。
4总结
体液调节激素对维护热负荷运动过程中的机体水盐代谢和平衡发挥着重要作用; 热习服一定程度上降低了机体对热负荷运动应激的生理生化热调节反应,提高了机体适应运动热环境的能力。
[1] Hasegawa H, Takatori T, Komura T, et al. Combined effects of pre-cooling and water ingestion on thermoregulation and physical capacity during exercise in a hot environment. J Sports Sci,2006, 24(1):3-9.
[2] Mundel T, King J, Collacott E, et al. Drink temperature influences fluid intake and endurance capacity in men during exercise in a hot, dry environment. Exp Physiol,2006, 91(5):925-933.
[3] Lee JKW, Shirreffs SM. The influence of drink temperature on thermoregulatory responses during prolonged exercise in a moderate environment. J Sports Sci,2007, 25(9): 975-985.
[4] 赵杰修,冯连世. 高温高湿环境与运动性疲劳. 中国运动医学杂志,2008,27(2):238-242.
[5] 洪长青,严翊,谢敏豪. 热应激与运动. 北京体育大学学报,2004,27(4):496-498.
[6] Kenefick RW,Maresh CM,Armstrong LE,et al. Rehydration with fluid of varying tonicities: effects on fluid regulatory hormones and exercise performance in the heat. J Appl Physiol,2007,102: 1899-1905.
[7] 崔书强,赖丽丽,赵杰修,等. 不同湿度高温环境下急性大强度运动应激前后人体血浆游离HSP72 浓度变化. 中国运动医学杂志,2013,32(1):20-23.
[8] 董柔,封文平,曾凡星,等. 热习服对高温力竭运动大鼠体液调节激素及下丘脑抗利尿激素合成的影响. 中国运动医学杂志,2012,31(11):983-987.
[9] 李爱萍,崔书强,徐金成,等. 高温环境下急性力竭运动对大鼠心肌HSP70 及血浆心钠素的影响. 中国运动医学杂志,2010,29(2):188-191.
[10] Lorenzo S,Minson CT. Heat acclimation improves cutaneous vascular function and sweating in trained cyclists. J Appl Physiol,2010,109: 1736-1743.
[11] Sandstrom ME,Siegler JC,Lovell RJ,et al. The effect of 15 consecutive days of heat–exercise acclimation on heat shock protein 70. Cell Stress Chaperones,2008,13:169-175.
[12] 胡咏梅,武晓洛,胡志红,等. 关于中国人体表面积公式的研究. 生理学报,1999,(1):45-48.
[13] Lorenzo S,Halliwill JR,Sawka MN,et al. Heat acclimation improves exercise performance . J Appl Physiol,2010,109:1140-1147.
[14] Garrett A,Creasy R,Rehrer N,et al. Effectiveness of shortterm heat acclimation for highly trained athletes [J]. Eur J Appl Phys,2012,112(5):1827-1837.
[15] 吴卫兵,王人卫,许弟群. 中长跑运动员10 天热适应过程中机体热调节反应及HSP70 变化. 体育科学,2013,33(9):46-51.
[16] Amorim FT, Yamada PM, Robergs RA, et al. Palm cooling does not reduce heat strain during exercise in a hot, dry environment. Appl Physiol Nutr Metab,2010, 35(4): 480-489.
[17] Lynn BM,Minson CT,Halliwill JR. Fluid replacement and heat stress during exercise alter post -exercise cardiac haemodynamics in endurance exercise -trained men. J Physiol,2012,587(14): 3605-3617.
[18] Yamada PM,Amorim Ft,Moseley P,et al. Effect of heat acclimation on heat shock protein 72 and interleukin-10 in humans. J Appl Physiol,2007,103:1196-1204.

