游泳运动对生长期大鼠棕色脂肪重量及PGC-1α的影响
白胜超 安楠 尚画雨 赵晓琴
1 北京体育大学运动人体科学学院(北京100084)
2 国家体育总局运动医学研究所
儿童青少年时期新陈代谢旺盛,是生长发育的重要阶段,也是棕色脂肪含量及其活性变化最大的阶段[1]。新生儿体内棕色脂肪含量最多, 之后随着年龄的增长逐渐减少[2],近几年有学者运用计算机断层扫描(Emission computed tomography)技术发现,成年人中也存在着活性较高的棕色脂肪[3],关于棕色脂肪的研究也因此逐渐引起了较多学者的兴趣。
完全激活的棕色脂肪产热能力是肌肉的几倍[4],50g棕色脂肪的能量消耗约为基础代谢的20%[5], 而棕色脂肪的这种产热能力一般受PGC-1α的控制[6]。 以往研究表明,运动使骨骼肌消耗大量能量,以及促使骨骼肌中PGC-1α的高表达已成为运动防治代谢性肥胖疾病的重要理论基础,然而从棕色脂肪及其PGC-1α的角度出发进行相关研究的报道较少。 为了解运动训练对生长期大鼠棕色脂肪的影响, 本实验选用生长发育中的大鼠进行8周游泳训练,分析其肩胛部位棕色脂肪重量变化及PGC-1α的表达情况,为进一步探究其作用机理提供实验依据, 同时对于防治儿童青少年肥胖也具有一定指导意义。
1 材料与方法
1.1 实验对象与分组
新生SPF级健康雄性SD大鼠128只, 购于北京华阜康生物科技股份有限公司, 许可证编号:SCXK (京)2009-0007。随机分为对照组(Control,C组)64只和运动组(Exercise,E组)64只,各组再分为1 w~8 w 8个亚组。于国家体育总局体育科学研究所动物饲养房中分笼饲养,前3周进行哺乳喂养,之后按照国家标准啮齿类动物饲料进行饲养,自由进食、饮水,母鼠正常饲养。参照苏丽[7]、Ohno[8]、Pilegaard[9]等的游泳运动模型,在预实验的基础上进行调整,制定出适合本实验的游泳方案,具体为:对照组正常状态下生长,运动组无负重游泳(属于中等运动强度[9]),水深60 cm,水温33 ± 2℃,室温25± 2℃,新生大鼠进行适应性游泳1周,出生后1~5天,每天游泳10组,每次6 s,组间休息10 s,第6天休息,第7天开始进行持续8周的正式实验。 周一到周五进行游泳训练,周六休息,周日除需取材的大鼠外其余正常训练。第1周前3天每天游泳12组,每次10 s,组间休息10 s;第4~6天每天游泳10组,每次30 s,组间休息10 s。 第2周第1天游泳10组,每次1 min,组间休息30 s;第2~3天每天游泳5组,每次3 min,组间休息1 min;第4~6天每天游泳3组,每次10 min,组间休息1 min。 第3周每天连续游泳30 min,之后4~8周,每天连续运动1 h。实验期间由于操作不当和感染等原因导致运动第8周组大鼠死亡2只,而其余各组均为8只,故C和E组最终进入统计的有效样本量分别为64只和62只。
1.2 标本采集
于正式实验第1~8周的每周日分批取材,除第8周E组取材6只、C组取材8只,其余每周C和E组各取8只。 每次称量体重, 仔细分离取出大鼠肩胛处完整的棕色脂肪后立即在电子天平上进行称重并记录, 锡纸包裹后进行标记,投入液氮,转入-80℃冰箱保存待用。
1.3 Real time-PCR 方法测定棕色脂肪中PGC-1α mRNA表达
引物的设计为:5’-TCAGTCCTCACTGGTGGACA,TGCTTCGTCGTCAAAAACAG-3’), 以β-actin 作 为 内参。
使用RNAisoTMPlus(宝生物工程有限公司)提取棕色脂肪组织RNA,PrimeScriptTMRT reagent Kit (宝生物工程有限公司) 进行cDNA的合成,37℃,15min(RT);85℃,5 s。
7500 Real Time PCR仪器进行检测, 体系:2.5 μL PCR缓冲液(10×),3 μL MgCl2溶液(25 mmol/L)3 units Taq聚合酶,0.5 μL SYBR Green(20×),加入计算量的cDNA,3 μL dNTP溶液, 上游和下游引物均为0.5 μL(20 μM),最后用ddH2O调至25 μL,反应条件包括:95℃20s 1cycle,60℃20 s,72℃20 s,87℃10 s,40 cycles。 结果使用仪器相对应的PCR软件进行分析,2-△△Ct的计算方法进行相对定量分析。
1.4 Western blot 测定棕色脂肪PGC-1α的蛋白表达
取棕色脂肪组织加RIPA裂解液(北京普利莱基因技术公司)和蛋白酶抑制剂(Roche公司)等冰上进行匀浆,按照BCA(Pierce公司)说明书进行蛋白浓度测定。根据测定的浓度和上样的蛋白量为30 μg来计算体积,并调整每一个样品的浓度为统一值,100℃煮沸10 min,-80℃保存备用。
用8%的丙烯酰胺凝胶电泳分离出目的蛋白PGC-1α和内参蛋白β-actin,丽春红预染,配置5%的BSA进行4℃封闭过夜,用5%的BSA稀释一抗(PGC-1α兔抗大鼠多克隆抗体,CST公司)浓度为1∶500,室温摇床孵育6 h,内参β-actin(Santa Cruz公司)浓度为1∶3000,室温孵育2 h。 TBST洗膜一抗为10 min×3,二抗(辣根酶标记山羊抗兔IgG,北京中杉金桥生物技术有限公司)室温孵育2 h,TBST洗膜为15 min×3,洗膜后进入暗室曝光,加入发光液反应2 min后,暗盒中曝光到Kodak胶片上,显影、定影。 用生物电泳图像分析软件进行拍照,Image J分析条带的灰度值,蛋白的计算方法为:目的蛋白灰度值/内参蛋白灰度值, 对照蛋白灰度值/内参蛋白灰度值,其比值为对应的实际表达数值。
1.5 统计学分析
采用Spss19.0统计软件, 实验结果用平均值±标准差表示,相同周龄下的运动组和对照组进行独立样本t检验,差异显著性标准为P<0.05,差异非常显著性标准为P<0.01,相关性分析采用Pearson相关系数分析法。
2 结果
2.1 生长期大鼠体重和棕色脂肪重量
通过对大鼠体重的统计分析,结果显示(表1),在总体趋势上E组略低于C组, 且在同一周龄下两组大鼠体重在第5~8周呈现显著性差异(P<0.05)。 提示,游泳运动具有降低生长期大鼠体重的作用。

表1 生长期大鼠体重变化(g,n=6~8)
通过对棕色脂肪重量的统计分析, 结果显示 (表2),C组随着周龄的增长逐渐增加,但从第6周开始呈现出下降趋势;E组随着周龄的增长前5周逐渐增加,与同期C组相比差异均无统计学意义 (P>0.05),6~8周逐渐趋于稳定且显著高于同期C组(P<0.05)。 提示,游泳运动对生长期大鼠棕色脂肪重量有影响。

表2 各组棕色脂肪重量变化(mg,n=6~8)
通过计算大鼠棕色脂肪重量和体重的比值, 进行棕色脂肪相对重量分析,结果显示(图1),随着周龄的增加,大鼠棕色脂肪的相对重量逐渐下降,同一周龄比较,E组高于C组,且在5~8周具有显著性差异(P<0.05,P<0.01)。 提示,游泳运动在一定程度上可以减缓棕色脂肪相对重量下降的趋势。
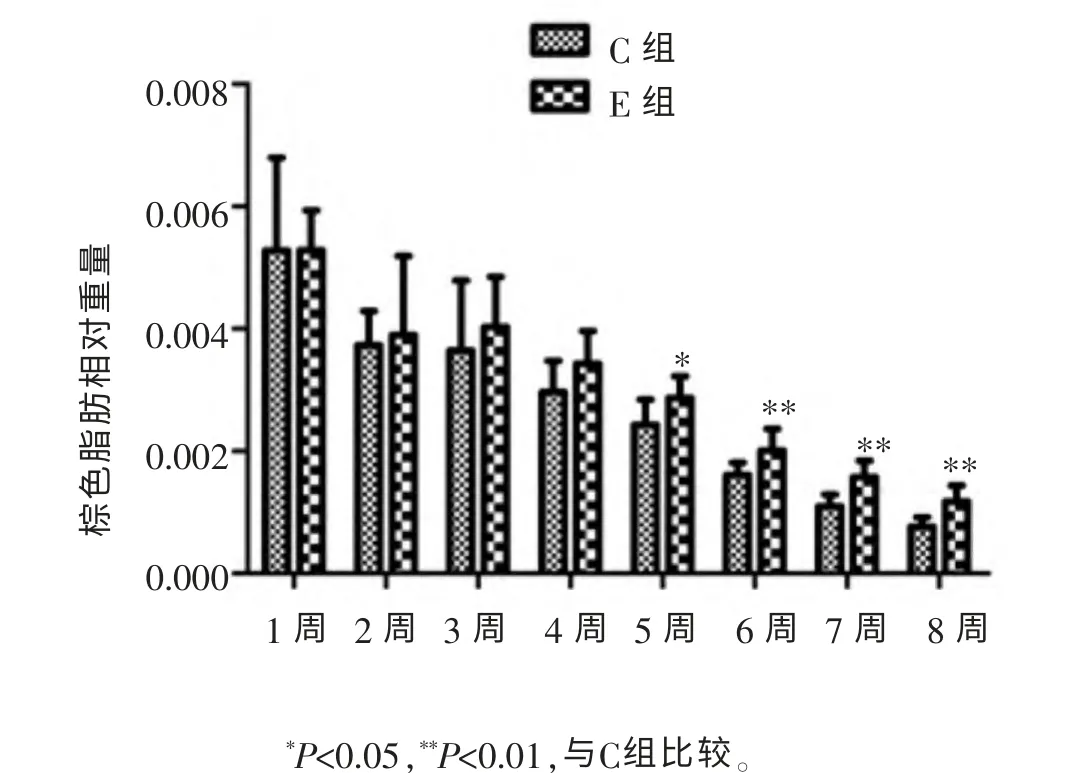
图1 各组棕色脂肪相对重量变化
2.2 棕色脂肪中的PGC-1α表达
由图2可知,棕色脂肪中的PGC-1α mRNA在C组中表达较少,而在E组中表达较多,两组相比具有显著性差异(P<0.01)。 此外在E组7~8周中的表达略有下降趋势。 提示, 游泳运动可以促进棕色脂肪中PGC-1α mRNA的表达。
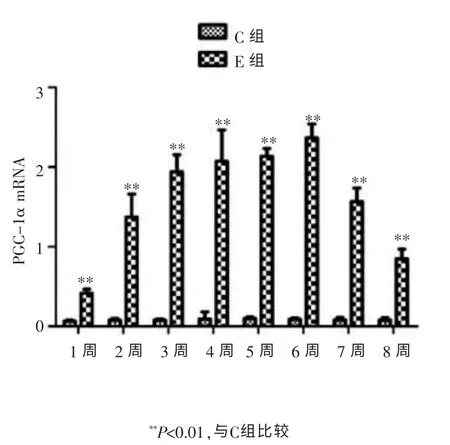
图2 各组棕色脂肪组织PGC-1α mRNA水平变化
通过检测PGC-1α蛋白的表达量,结果显示(图3),在C组中表达较少,而在E组中表达较多,两组相比差异具有统计学意义(P<0.05)。 另外PGC-1α在E组7~8周中的表达略有下降趋势。 提示,游泳运动可以促进棕色脂肪中PGC-1α蛋白的表达。
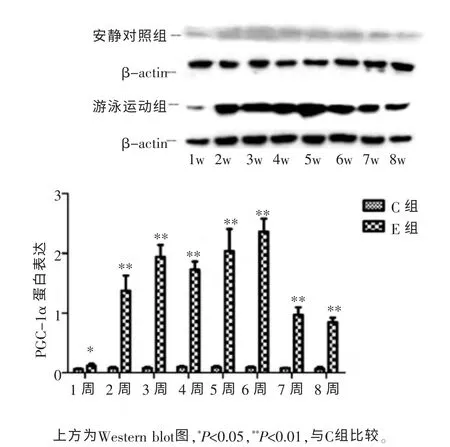
图3 各组PGC-1α蛋白表达变化
2.3 棕色脂肪重量和棕色脂肪中PGC-1α蛋白表达量的相关性
分别对C组和E组的棕色脂肪重量与PGC-1α蛋白表达量进行相关性分析,结果显示(图4,图5),C组(r=0.369,n=62,P<0.01)和E组(r=0.37,n=61,P<0.01)均表现出低度的正相关关系, 提示棕色脂肪重量变化可能与PGC-1α蛋白表达量相关。
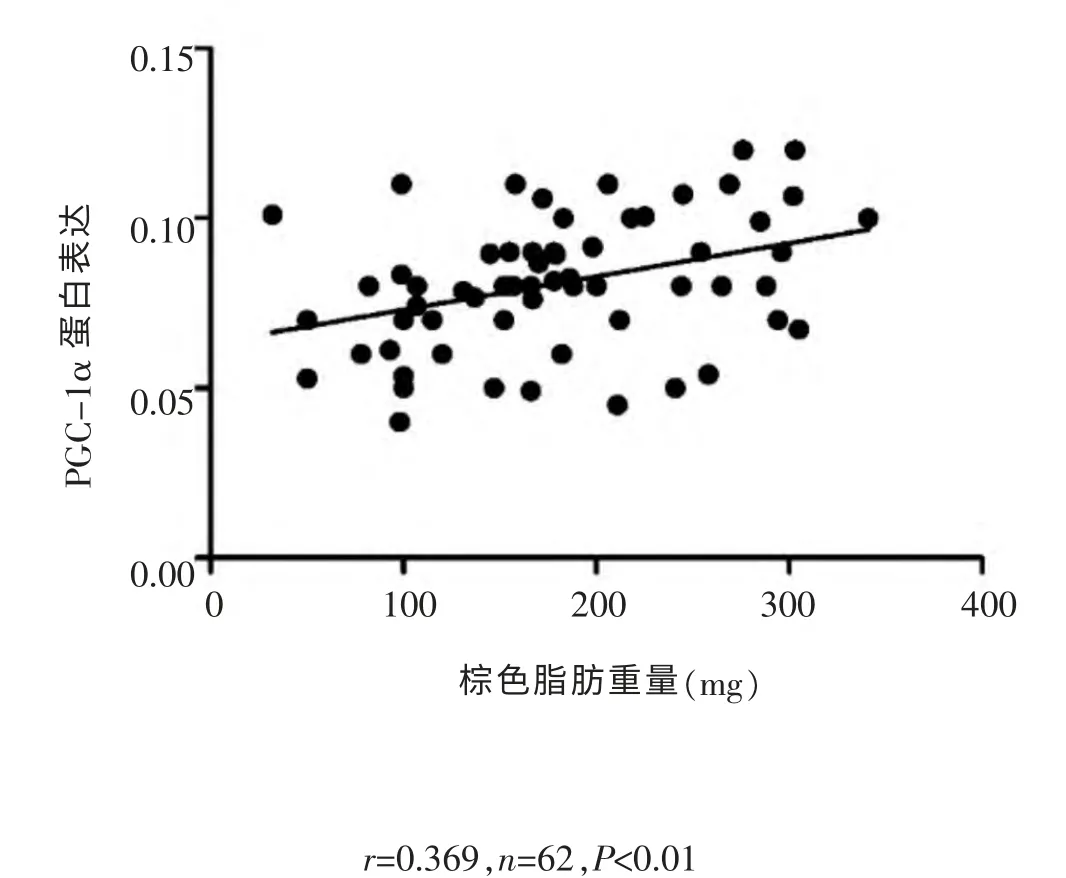
图4 C组棕色脂肪重量与PGC-1α蛋白表达相关性分析
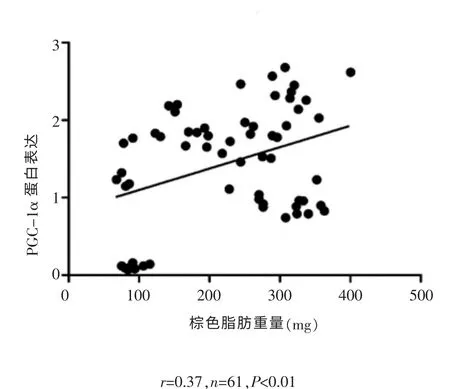
图5 E组棕色脂肪重量与PGC-1α蛋白表达相关性分析
3 讨论
3.1 游泳运动对生长期大鼠体重和棕色脂肪重量的影响
较多人体和动物实验研究均表明, 游泳运动可有效降低体重, 在本实验模型中也同样发现游泳运动能够降低生长期大鼠的体重。
Arnold等[10]研究发现,运动对大鼠棕色脂肪并未起到明显作用。Larue-Achagiotis等[11]对大鼠进行20天踏车训练,结果发现,运动组棕色脂肪重量不仅没有增加,反而低于对照组。 Yamashita等[12]将4周龄大鼠随机分为运动组和对照组, 其中运动组跑台跑速为25~27 m/min,坡度8°、每天1.5 h、持续9周,结果发现,其棕色脂肪量小于对照组。Ohno等[8]将大鼠分为游泳组、寒冷组、对照组后进行10周训练, 结果发现游泳组和寒冷组棕色脂肪重量均增加。
以往这些相关实验所得出的结论并不一致, 其原因可能是运动对棕色脂肪影响的实验方案目前并没有相对经典的模型可循, 因此会受到干预方法、 实验环境、实验对象以及取材手法不一致等方面的影响;再加之一些研究的年代也相对久远, 受当时实验条件的限制较大,因而得出的实验结果差异很大,使得该方面的研究难以得出统一结论。
本实验与以往大多实验不同之处在于选取的实验对象是刚出生的大鼠,由于其处在生长发育阶段,新陈代谢更为旺盛,运动对其棕色脂肪的刺激会更大一些。
本实验结果中棕色脂肪重量在对照组表现为先增加后减少,属于正常生长发育的结果,而在运动组中先增加后基本维持不变, 说明游泳运动有抑制棕色脂肪重量减少的作用。 关于运动停止后大鼠棕色脂肪的变化情况,还有待于今后更进一步探究。
3.2 游泳运动对棕色脂肪中PGC-1α的影响
适应性产热是指在一定因素的刺激下, 机体产生的能量以热能形式进行散失的一种生理过程, 以此来适应外界的变化,在棕色脂肪和骨骼肌中发生较多。棕色脂肪中含有呈多室脂滴形态的三酰甘油, 通过棕色脂肪上的细胞线粒体将化学能转化为热能, 实现适应性产热[13]。
在棕色脂肪的适应性产热过程中, 机体基于外界环境的变化会在细胞水平上对线粒体的代谢进行调节,而这种调节主要受过氧化物酶体增殖活化受体γ辅助 活 化 因 子1α (peroxisome proliferator -activated receptor-γcoactivator1α,PGC-1α)的控制[6]。 PGC-1α为PGC-1蛋白家族的成员之一, 是线粒体生物合成和氧化代谢的启动因子,其受较多因素的影响,如寒冷、运动、禁食等均可诱导其表达。
关于运动对PGC-1α的影响,以往研究多集中在骨骼肌方面,骨骼肌作为重要的运动器官,运动干预可以对其PGC-1α产生明显影响。 目前,许多动物和人体实验均表明,运动训练可以促使骨骼肌中PGC-1α的表达升高。Terada等[14]对SD大鼠分组进行高强度和低强度运动训练, 结果发现大鼠骨骼肌中PGC-1α表达明显增加。 McGee等[15]对7名受试者进行60min的蹬车运动,结果同样发现运动能够使PGC-1α表达增加。 Pilegaard等[16]对7名男性受试者进行4周运动训练,结果发现运动可以诱导人股外侧肌PGC-1α的转录和mRNA的含量产生短暂增加,并发现运动能激活骨骼肌中PGC-1α调节新陈代谢的基因。 然而,运动是否也会对棕色脂肪中PGC-1α产生相似的影响,目前相关研究较少。 Slocum等[17]对雄性DIO大鼠进行运动和饮食限制干预,结果发现两种干预均能使棕色脂肪中PGC-1α的表达升高。 由此可见,运动能促使骨骼肌和棕色脂肪中的PGC-1α高表达,但是否存有一定的联系以及机理是否相同,还有待进一步研究验证。
本实验研究结果与Slocum[17]等报道相似。本研究发现,PGC-1α mRNA和蛋白的表达具有相似的变化趋势:在对照组中均表达较低,这可能与大鼠所处环境几乎无变化,所需要的适应性产热较低有关;在运动组中均表达较高,且与对照组相比呈现显著性差异。提示游泳运动可以促进PGC-1α高表达,并使其维持在较高水平,导致适应性产热增加,以此来适应运动状态,这对于降低体重具有重要意义。 另外,棕色脂肪中PGC-1α水平也受环境变化的影响, 尤其是寒冷刺激和饮食变化[18],我们推测大鼠对游泳训练环境的逐渐适应可能也会导致PGC-1α水平发生变化,这些都还有待于进一步研究。
3.3 棕色脂肪重量和棕色脂肪中PGC-1α蛋白表达量的相关性分析
鉴于游泳运动对棕色脂肪重量及PGC-1α蛋白表达的影响研究, 我们推测两者之间可能具有一定的关系,故进行相关性分析。 本实验结果表明,对照组和运动组大鼠均呈低度的正相关,且相关系数基本相同,这说明棕色脂肪的重量和PGC-1α蛋白表达之间存在着一定程度的联系,但具体的关系尚待探究。
4 总结
游泳运动能抑制生长期后期大鼠棕色脂肪重量的下降,并促进PGC-1α高表达,导致适应性产热增多,这可能是游泳运动导致生长期大鼠体重降低的原因之一。
[1] Dietz WH. Periods of risk in childhood for the development of adult obesity-what do we need to learn?[J]. J Nutr,1997,127(9):1884-6.
[2] Nedergaard J,Bengtsson T,Cannon B. Unexpected evidence for active brown adipose tissue in adult humans [J]. Am J Physiol Endocrinol Metab,2007,293(2):E444-52.
[3] Frontini A,Cinti S. Distribution and development of brown adipocytes in the murine and human adipose organ [J]. Cell Metab,2010,11(4):253-6.
[4] Rothwell NJ,Stock MJ. Luxuskonsumption,diet -induced thermogenesis and brown fat:the case in favour [J]. Clin Sci(Lond),1983,64(1):19-23.
[5] Adams SH. Uncoupling protein homologs:emerging views of physiological function[J]. J Nutr,2000,130(4):711-4.
[6] Jeninga EH,Schoonjans K,Auwerx J. Reversible acetylation of PGC -1:connecting energy sensors and effectors to guarantee metabolic flexibility [J]. Oncogene,2010,29(33):4617-24.
[7] 苏丽,姜宁,张癑,等. 有氧运动对C57BL/6小鼠骨骼肌PGC-1α表达和肌纤维类型影响的研究 [J]. 体育科学,2008,4(28):43-7.
[8] Ohno H,Kizaki T,Ohishi S,et al. Effects of swimming training on the lysosomal enzyme system in brown adipose tissue of rats:an analogy between swimming exercise and cold acclimation[J]. Acta Physiol Scand,1995,155(3):333-4.
[9] Pilegaard H,Juel C,Wibrand F. Lactate transport studied in sarcolemmal giant vesicles from rats:effect of training [J]. Am J Physiol,1993,264(2 Pt 1):E156-60.
[10] Arnold J,Richard D. Unaltered regulatory thermogenic response to dietary signals in exercise- trained rats [J]. Am J Physiol,1987,252(3 Pt 2):617-23.
[11] Larue-Achagiotis C,Rieth N,Goubern M,et al. Exercisetraining reduces BAT thermogenesis in rats[J]. Physiol Behav,1995,57(5):1013-7.
[12] Yamashita H,Yamamoto M,Sato Y,et al. Effect of running training on uncoupling protein mRNA expression in rat brown adipose tissue[J]. Int J Biometeorol,1993,37(1):61-4.
[13] Trayhurn P. Endocrine and signalling role of adipose tissue:new perspectives on fat [J]. Acta Physiol Scand,2005,184(4):285-93.
[14] Terada S,Kawanaka K,Goto M,et al. Effects of high ‐intensity intermittent swimming on PGC ‐ 1α protein expression in rat skeletal muscle [J]. Acta Physiol Scand,2005,184(1):59-65.
[15] McGee SL,Hargreaves M. Exercise and myocyte enhancer factor 2 regulation in human skeletal muscle [J]. Diabetes,2004,53(5):1208-14.
[16] Pilegaard H,Saltin B,Neufer PD. Exercise induces transient transcriptional activation of the PGC ‐1α gene in human skeletal muscle[J]. J Physiol,2003,546(Pt 3):851-8.
[17] Slocum N,Durrant JR,Bailey D,et al. Responses of brown adipose tissue to diet -induced obesity,exercise,dietary restriction and ephedrine treatment [J]. Exp Toxicol Pathol,2013,65(5):549-57.
[18] Leone TC,Lehman JJ,Finck BN,et al. PGC-1α deficiency causes multi-system energy metabolic derangements:muscle dysfunction,abnormal weight control and hepatic steatosis[J].PLoS Biol,2005,3(4):101.

