内源性硫化氢对急性非结石性胆囊炎NF-κB的保护作用
高守为,余保平,杨 斌,潘陈为,胡桂英,张 丽
(1.武汉大学人民医院消化内科,湖北 武汉 430060;2.黑龙江省康复医院,黑龙江 哈尔滨 150000)
内源性硫化氢对急性非结石性胆囊炎NF-κB的保护作用
高守为1,2,余保平1,杨 斌1,潘陈为1,胡桂英1,张 丽1
(1.武汉大学人民医院消化内科,湖北 武汉 430060;2.黑龙江省康复医院,黑龙江 哈尔滨 150000)
目的 探讨急性非结石性胆囊炎(AAC)中NF-κB的表达及内源性硫化氢的保护作用。方法采用胆总管结扎(BDL)方法构建AAC动物模型;40只成年豚鼠被随机分为正常组(normal组)、假手术对照组(sham组)、BDL-48 h组(BD-48 h组)和炔丙基甘氨酸(PAG)+BDL-48 h组(PAG组),每组10只。造模48 h后收集各组胆囊组织及动物血清。HE染色评价胆囊炎症并测定各组胆囊组织胱硫醚γ-裂解酶(CSE)活性;全自动生化分析仪检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和胆红素(Bilirubin)水平;免疫组织化学法和Western blot法分别检测各组胆囊组织中CSE、NF-κB p65的表达。结果PAG组炎症评分均明显高于BDL-48 h组、normal组和sham组,差异均有统计学意义(P<0.05);与normal组和sham组比较,BDL-48 h组和PAG组豚鼠血清ALT、AST、Bilirubin水平及胆囊组织CSE活性均明显增高(P<0.05),其中,PAG组CSE活性明显低于BDL-48 h组,差异有统计学意义(P<0.05);免疫组织化学法和Western blot法显示,PAG组胆囊的NF-κB p65蛋白水平均明显高于BDL-48 h组、normal组和sham组,差异均有统计学意义(P<0.05)。结论NF-κB的活化参与了急性非结石性胆囊炎的病理过程,内源性硫化氢可能通过抑制NF-κB的表达,从而减轻胆囊的炎症程度。
急性非结石性胆囊炎;NF-κB;内源性硫化氢
NF-κB(Nuclear factor-κB)广泛存在于体内各种细胞,调节着众多与炎症反应有关的细胞因子及炎症介质的基因转录。在急性非结石胆囊炎(Acute acalculous cholecystisis,AAC)中,NF-κB被激活,其异常表达与AAC的发生、发展密切相关[1]。我们前期研究发现[2],硫化氢(Hydrogen sulfide,H2S)对AAC的炎症起抑制作用,但其具体作用机制尚未明确。本研究在前期研究的基础上进一步探讨内源性H2S对AAC中NF-κB的保护作用。
1 材料与方法
1.1 材料 健康成年豚鼠40只,雄性,体质量250~350 g,由武汉大学人民医院动物中心提供。饲养环境为清洁级,室温20℃~25℃,湿度40%~60%。CSE活性检测相关试剂及PAG均购于美国Sigma公司;CSE多克隆抗体、GAPDH单克隆抗体及β-actin抗体购于美国Santa Cruz公司;NF-kappaB抗体购自Cell Singaling公司;羊抗兔二抗、Western blot相关试剂分别由北京中杉金桥公司、碧云天生物技术公司提供。
1.2 方法 动物随机分为正常组(normal组)、假手术对照组(sham组)、胆总管结扎48 h组(BDL-48 h组)和PAG+胆总管结扎48 h组(PAG组),每组10只。
1.2.1 模型构建 参照文献[3]:3%戊巴比妥钠(50 mg/kg)腹腔注射,麻醉后将动物固定。腹部备皮,0.5%聚维酮碘溶液消毒。无菌手术刀于剑突下沿腹中线切口,游离胆总管,在胆道进入十二指肠入口处,采用3~0线结扎胆总管,动作轻柔,对胆囊不进行任何操作。依次缝合肌层、皮肤,消毒伤口并包扎。假手术组不结扎胆总管,其他操作与上述相同;PAG组动物在术前30 min腹腔注射PAG(50 mg/kg),余操作与模型组一致。以上手术步骤均遵循无菌操作原则。待动物清醒后,分别将其转移到笼内(可自由进食水)。48 h后收集各组动物胆囊标本。
1.2.2 HE染色 取新鲜胆囊标本,4%多聚甲醛液固定,石蜡包埋、切片。行苏木素-伊红(HE)染色,光镜下观察。胆囊炎症评分参照文献[3],采用独立双盲法。
1.2.3 血清ALT、AST、Bilirubin测定 动物麻醉后打开胸腔,心脏采血3 ml,快速注入促凝管,轻轻颠倒混合,室温静止30 min,4 000 r/min离心10 min后分离血清,500 μl分装,-80℃冰箱保存,采用全自动生化分析系统(ADVIA2400,德国)检测。
1.2.4 胆囊组织CSE活性测定 参照文献[4],准备含有中央小室的锥形瓶。外室反应体系包括0.7 ml的磷酸钾缓冲液、L-半胱氨酸、5'-磷酸吡多醛和0.3 ml的胆囊组织匀浆。中央小室内置入2.0 cm×2.5 cm滤纸,并加入1%醋酸锌0.5 ml。锥形瓶内充入氮气后密封,37℃摇床孵育90 min后加50%三氯醋酸终止反应。将中央小室内容物(滤纸和塑料管)移入到含3.6 ml蒸馏水的试管中,依次加入对氨基二甲基苯二胺盐酸盐0.5 ml、三氯化铁0.4 ml。室温静置20 min后,分光光度计(波长为665 nm)测量吸光度,每孔测3次,取平均值。然后根据NaHS标准曲线计算溶液中H2S含量。
1.2.5 Western blot法检测胆囊组织NF-κB、CSE蛋白含量 分别提取各组胆囊组织的细胞核蛋白、总蛋白,BCA法测定其蛋白浓度。取等量蛋白质进行SDS-PAGE和电转移至NC膜。先后行一抗(NF-κB p65或CSE)、二抗孵育。洗膜后在化学发光成像仪中曝光;利用凝胶成像分析系统测得各目标带的光密度值。NF-κB p65相对表达量=目的蛋白条带光密度值/β-actin条带光密度值;CSE相对表达量=目的蛋白条带光密度值/GAPDH条带光密度值。
1.2.6 免疫组化法检测胆囊组织NF-κB p65、CSE蛋白表达 胆囊组织经固定、石蜡包埋后,常规脱蜡至水和抗原修复。按说明书操作,分别加一抗NF-κBp65、CSE,4℃孵育过夜、隔日加二抗(羊抗兔IgG)孵育20 min,二氨基联苯胺(DAB)显色。然后复染、脱水、透明、封片。结果判断:采用独立双盲法,NF-κBp65以细胞核出现棕黄色或棕褐色细颗粒状着色为阳性细胞,CSE以细胞质出现棕黄色片状或颗粒状物为阳性。分别在400倍显微镜下,每张切片随机选10个视野,数500个细胞,计算阳性率。
1.3 统计学方法 应用SPSS13.0统计软件对数据进行分析,所有实验数据用均数±标准差(±s)表示,各组比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HE染色及组织病理炎症评分 normal组与sham组炎症评分比较差异无统计学意义[(1.34± 0.22)分 vs(1.62±0.19)分,P>0.05]。BDL-48 h组[(5.46±0.27)分]和PAG组[(8.67±0.32)分]炎症评分较normal组和sham组明显增高,差异均有统计学意义(P<0.05),其中PAG组炎症评分明显高于BDL-48 h组(P<0.05)。
2.2 各组豚鼠血清ALT、AST、Bilirubin水平 PAG组和BDL-48 h组豚鼠血清ALT、AST、Bilirubin水平均明显高于normal组和sham组,差异均有统计学意义(P<0.05),见表1。而BDL-48 h组与PAG组比较,差异均无统计学意义(P>0.05)。
表1 各组豚鼠血生化指标(±s)
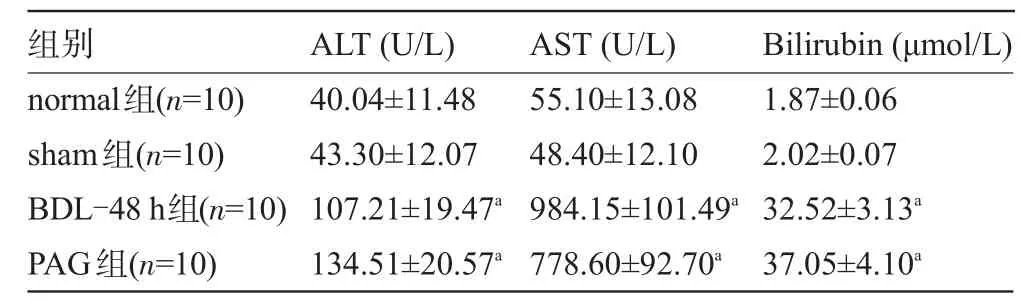
表1 各组豚鼠血生化指标(±s)
注:与normal组、sham组比较,aP<0.05。
normal组(n=10) sham组(n=10) BDL-48 h组(n=10) PAG组(n=10) 40.04±11.48 43.30±12.07 107.21±19.47a134.51±20.57a55.10±13.08 48.40±12.10 984.15±101.49a778.60±92.70a1.87±0.06 2.02±0.07 32.52±3.13a37.05±4.10a
2.3 各组胆囊组织中CSE活性的变化 BDL-48 h组和PAG组胆囊CSE活性均显著高于normal组和sham组,差异均有统计学意义(P<0.05)。其中,PAG组胆囊CSE活性较BDL-48 h组明显降低,差异有统计学意义(P<0.05),见表2。
表2 各组豚鼠胆囊组织CSE活性和NF-κB p65、CSE蛋白表达(±s)
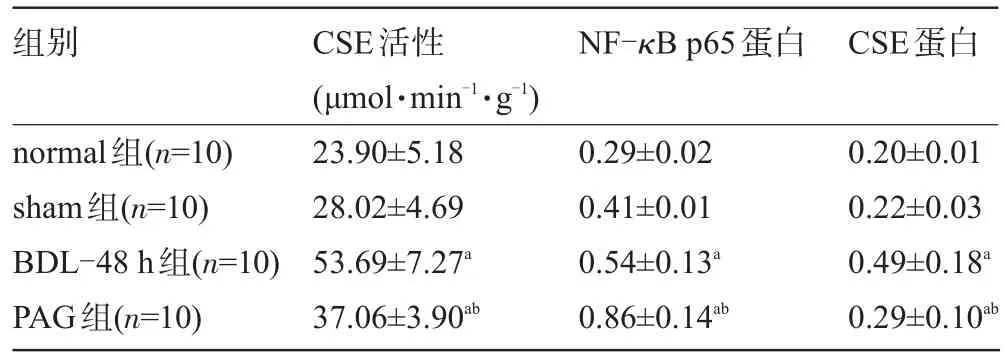
表2 各组豚鼠胆囊组织CSE活性和NF-κB p65、CSE蛋白表达(±s)
注:与normal组、sham组比较,aP<0.05;与CBDL-48 h组比较,bP<0.05。
组别NF-κB p65蛋白CSE蛋白normal组(n=10) sham组(n=10) BDL-48 h组(n=10) PAG组(n=10) 0.20±0.01 0.22±0.03 0.49±0.18a0.29±0.10abCSE活性(μmol·min-1·g-1) 23.90±5.18 28.02±4.69 53.69±7.27a37.06±3.90ab0.29±0.02 0.41±0.01 0.54±0.13a0.86±0.14ab
2.4 各组胆囊组织中NF-κB、CSE蛋白含量变化 与normal组、sham组相比较,BDL-48 h组和PAG组胆囊的NF-κB p65、CSE蛋白水平均明显增高(P<0.05),其中,PAG组NF-κB p65蛋白水平明显高于BDL-48 h组,而CSE蛋白水平明显低于BDL-48 h组(P<0.05),见表2和图1。

图1 Western blot检测各组鼠胆囊组织NF-κB p65、CSE蛋白表达
2.5 各组胆囊组织中NF-κB、CSE蛋白的表达水平 BDL-48 h组和PAG组NF-κB p65阳性染色细胞明显(定位于细胞核),阳性细胞百分率较normal组、sham组明显升高(P<0.05),且PAG组NF-κB p65蛋白阳性率明显高于BDL-48 h组(P<0.05),见表3和图2。CSE蛋白主要定位于胞质和胞膜;与normal组、sham组相比,BDL-48 h组和PAG组的CSE免疫阳性细胞百分率显著升高(P<0.05),而PAG组CSE蛋白阳性率较BDL-48 h组明显降低(P<0.05),见表3和图3。
表3 各组豚鼠胆囊组织NF-κB p65核表达阳性细胞和CSE胞浆表达阳性细胞百分率(±s)
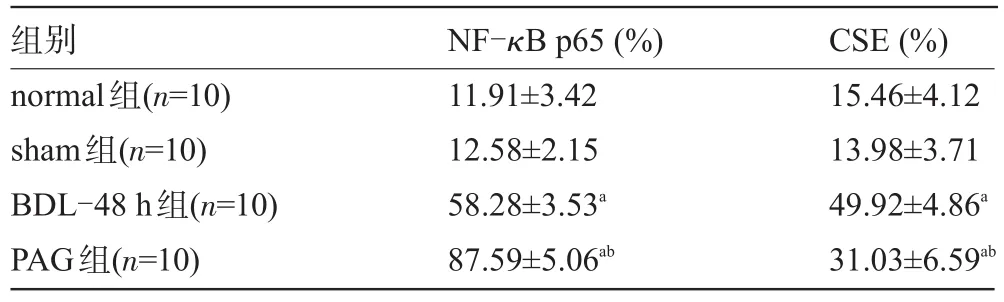
表3 各组豚鼠胆囊组织NF-κB p65核表达阳性细胞和CSE胞浆表达阳性细胞百分率(±s)
注:与normal组、sham组比较,aP<0.05;与BDL-48 h组比较,bP<0.05。
组别normal组(n=10) sham组(n=10) BDL-48 h组(n=10) PAG组(n=10) NF-κB p65(%) 11.91±3.42 12.58±2.15 58.28±3.53a87.59±5.06abCSE(%) 15.46±4.12 13.98±3.71 49.92±4.86a31.03±6.59ab
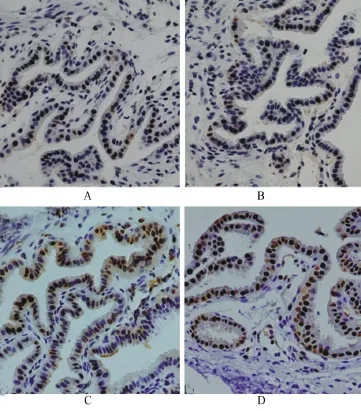
图2 各组豚鼠胆囊组织NF-κB p65阳性细胞(×400)
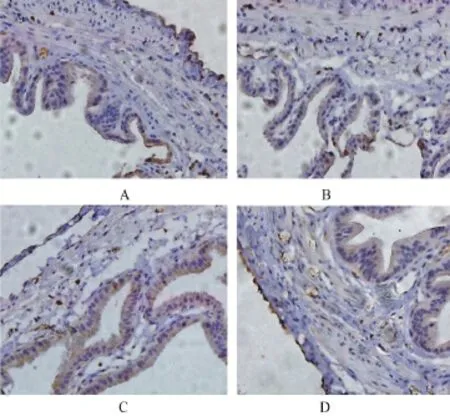
图3 各组豚鼠胆囊组织CSE阳性细胞(×200)
3 讨论
H2S是继一氧化氮(NO)和一氧化碳(CO)之后的第三种具有生物学效应的气体信号分子,广泛参与了包括消化系统在内的多种疾病的病理生理过程。内源性H2S是通过胱硫醚β-合成酶(Cystathionineβ-synthase,CBS)、胱硫醚γ-裂解酶(Cystathionineγ-lysae,CSE)催化L-半胱氨酸产生的,且CBS、CSE广泛表达于胃肠道的神经、黏膜及平滑肌。前期研究发现[5],豚鼠胆囊存在CBS和CSE,且随着胆囊炎症的增加,CBS、CSE的蛋白表达及CSE活性增加。此外,我们还发现,H2S在AAC中起抑制炎症的作用,给予NaHS(即外源性H2S)后,豚鼠胆囊炎症、水肿减轻。相反,给予CSE抑制剂PAG后,血浆中的H2S合成受到抑制,却加重了胆囊的炎症反应和损伤[2]。本研究采用免疫组织化学法及Western blot法显示,BDL-48 h组加入PAG后,炎症评分增加,同时CSE蛋白表达及其H2S合成减少,而NF-κB p65表达却显著升高,表明内源性H2S可能通过抑制NF-κB p65表达,从而减轻胆囊的炎症程度。
既往研究表明,H2S在体内具有抗炎和促炎双重作用。例如,在烧伤模型小鼠的研究中发现,外源性H2S可以抑制炎症相关因子(如IL-8、IL-6、TNF-α)的激增、减少淋巴细胞浸润、降低细胞间粘附因子1 (ICAM-1)的表达和中性粒细胞的聚集,从而发挥保护作用[6]。国内刘蓓蓓等[7]研究发现,在脓毒症大鼠体内给予PAG后,模型大鼠肺组织TNF-α、IL-1β、MPO水平明显降低,其炎症及水肿损伤减轻;然而给予外源性H2S后,则发现肺的炎症损伤加重。国外Linden等[8]学者证实,在盲肠结扎和穿刺引发的脓毒血症实验中,外源性H2S可以促进炎症反应,加重组织损伤;他们进一步研究发现,外源性H2S可以激活NF-κB,激活后的NF-κB迅速从胞质进入到细胞核,促进炎症介质等基因(如IL-1β、IL-6、TNF-α)的转录、合成,最终导致炎症反应加重。这些结果提示,H2S发挥抗炎或促炎的作用与炎症动物模型、作用部位及H2S来源等因素密切相关。
Gomez等[1]研究发现,在AAC的发生、发展中,NF-κB与胆囊炎症有着密切的关系。例如,胆囊组织缺血缺氧、胆汁淤积等可以促进NF-κB、COX-2、iNOS等炎症相关介质的表达;而纠正缺血缺氧等因素后NF-κB活性明显降低[1]。此外,使用NF-κB活化抑制剂抑制NF-κB活化后可以显著改善梗阻性黄疸时肠道黏膜的通透性,并阻止全身炎症反应的扩大[9]。因此,我们推测,NF-κB的活化参与了AAC的病理过程,而内源性H2S可以抑制NF-κB激活,减轻炎症,从而起保护作用。
Zhang等[10]研究显示,外源性H2S可以减轻肝缺血-再灌注损伤,保护肝功能。在内毒素血症引起的肝脏损伤中加入PAG同样可以减轻肝脏的损伤,降低ALT、AST值[11]。本研究发现,胆道梗阻48 h后血清ALT、AST、Bilirubin浓度均明显升高,而PAG组较BDL-48 h组差异无统计学意义,产生的原因可能是,急性胆道梗阻时Bilirubin浓度急剧升高,肝细胞损害严重。
综上所述,NF-κB的活化参与了AAC的病理过程,内源性H2S可能通过抑制NF-κB的表达从而减轻胆囊的炎症反应,起保护作用。此外,本研究尚存在一定的局限性,前期已经证实,在豚鼠胆囊组织中同时存在合成H2S的两种关键酶:CSE和CBS,本实验只考虑到了CSE,尚需补充应用CBS的抑制剂作为实验组进行进一步研究,以得出更为完整的结论。
[1]Gomez-Pinilla PJ,Camello PJ,Tresguerres JA,et al.Tempol protects the gallbladder against ischemia/reperfusion[J].J Physiol Biochem,2010,66(2):161-72.
[2]胡桂英,余保平,张 丽,等.硫化氢对急性非结石性胆囊炎的影响[J].医学研究杂志,2013,42(12):25-29.
[3]Parkman HP,Bogar LJ,Bartula LL,et al.Effect of experimental acalculous cholecystitis on gallbladder smooth muscle contractility [J].Dig Dis Sci,1999,44(11):2235-2243.
[4]Zhang H,Moochhala SM,Bhatia M.Endogenous hydrogen sulfide regulates inflammatory response by activating the ERK pathway in polymicrobial sepsis[J].J Immunol,2008,181(6):4320-4331.
[5]Zhang L,Pan C,Yang B,et al.Enhanced expression of cystathionineβ-synthase and cystathionineγ-lyase during acute cholecystitis-induced gallbladder inflammation[J].PLoS One,2013,8(12): e82711.
[6]Zeng J,Lin X,Fan H,et al.Hydrogen sulfide attenuates the inflammatory response in a mouse burn injury model[J].Mol Med Rep, 2013,8(4):1204-1248.
[7]刘蓓蓓,陈 娣,潘 昊,等.硫化氢在脓毒症大鼠肺损伤中的作用[J].中国急救医学,2013,33(5):394-398.
[8]Linden DR,Levitt MD,Farrugia G,et ala.Endogenous production of H2S in the gastrointestinal tract:still in search of a physiologic function[J].Antioxid Redox Signal,2010,12(9):1135-1146.
[9]Xu F,Dai CL,Peng SL,et al.Polymyxin B protects against hepatic ischemia/reperfusion injury in a rat model[J].Inflammation,2014, 37(4):1015-1021.
[10]Zhang Q,Fu H,Zhang H,et al.Hydrogen sulfide preconditioning protects rat liver against ischemia/reperfusion injury by activating Akt-GSK-3βsignaling and inhibiting mitochondrial permeability transition[J].PLoS One,2013,8(9):e74422.
[11]Yan Y,Chen C,Zhou H,et al.Endogenous hydrogen sulfide formation mediates the liver damage in endotoxemic rats[J].Res Vet Sci, 2013,94(3):590-595.
Protective effect of endogenous hydrogen sulfide on nuclear factor-κB during acute acalculous cholecystitis.
GAO Shou-wei1,2,YU Bao-ping1,YANG Bin1,PAN Chen-wei1,HU Gui-ying1,ZHANG Li1.1.Department of Gastroenterology,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA;2.The Rehabilitation Hospital of Heilongjiang Province,Harbin 150000,Heilongjiang,CHINA
ObjectiveTo investigate the expression of nuclear factor-κB(NF-κB)in gallbladder during acute acalculous cholecystitis(AAC),and to study the protective effect of endogenous hydrogen sulfide(H2S)on NF-κB.MethodsThe model of AAC in guinea pig was established by common bile duct ligation(BDL),and 40 adult guinea pigs were randomly divided into normal group(normal group),sham control group(sham group),BDL for 48 hours group(BDL-48 h group),and DL-propargylglycine+BDL-48 h group(PAG group).Each group had 10 animals.48 hours after BDL,gallbladder tissues and serum of all animals were collected.Hematoxylin and eosin-stained slides of gallbladder samples were scored for inflammation,and cystathionineγ-lysae(CSE)activity in gallbladder tissue was examined.The level of alanine aminotransferase(ALT),aspartate aminotransferase(AST)and bilirubin in serum were detected by full automatic biochemical analysis system.Immunohistochemistry and western blotting were used respectively to determine the expression levels of CSE and NF-κB p65.ResultsThe inflammation score in PAG group was higher than those in normal,sham and BDL-48 h group(P<0.05).Compared with normal and sham group,the levels of ALT,AST,bilirubin and CSE activity were significantly increased in BDL-48 h and PAG group (P<0.05).And the CSE activity in PAG group was significantly lower than that in BDL-48 h group(P<0.05).Immunohistochemistry analysis and western blotting showed that the level of NF-κB p65 protein in PAG group was significantly higher than those in normal,sham and BDL-48 h group(P<0.05).ConclusionActivation of NF-κB is involved in the pathological process of ACC.And Endogenous H2S may help reduce the inflammation in gallbladder by inhibiting expression of NF-κB.
Acute acalculous cholecystitis;NF-κB;Endogenous hydrogen sulfide
R575.6+1
A
1003—6350(2015)19—2809—04
10.3969/j.issn.1003-6350.2015.19.1026
2015-04-18)
国家自然科学基金(编号:81170351)
余保平。E-mail:yubp62@163.com

