正交实验优化火龙果果皮红色素超声辅助醇提工艺
高治平,丁岚,刘映,余朋朋,喻翠云
(1.南华大学 药学与生物科学学院 药学系,湖南 衡阳 421001;2.湖南省分子靶标新药研究协同创新中心,湖南 衡阳 421001)
天然色素不仅有着合成色素无可比拟的着色自然、安全无害等特性,并具有强化营养、改善人体功能等生物活性[1-3],是现代社会人们期望获取的药品、食品、饮料、美容护肤化妆等产品的着色剂,备受消费者亲睐,天然植物色素的提取纯化、生产与应用研究已成为当今国际社会共同关注和探索的热点[4-5]。我国天然色素资源广,而其研究、应用与国际先进水平尚有较大差距[6],色素品种亟待进一步寻找、挖掘,拓展天然色素资源,开展优化其提取、纯化、分离与生产工艺、降低产品成本、提高产品质量的研究与探究,开发更多纯天然绿色食用、药用等。
火龙果不仅其果肉营养价值、药用价值较高,其果皮颜色鲜艳并含丰富的天然甜菜苷类色素,是一种来源较广的天然色素资源。我国政府已于1960年允许甜菜苷类色素用于食品、药品的着色[5]。它属于吡啶类衍生物,其基本发色基团是1,7-二偶氮庚甲碱,该基团共振产生颜色,当取代基R(氢或芳香族)与其共振,化合物颜色则为红色,称甜菜红素;未发生共振则化合物颜色为黄色,称甜菜黄质,他们分别在538 nm 和480 nm 处有最大吸收[7]。
甜菜红素为水溶性物质,也可以溶于乙醇、丙酮等水溶液,是一种极性或弱极性分子物质,具有极性或弱极性分子物质特性。不仅光线、温度、pH 值,金属离子等均可影响其稳定性;而提取溶液的种类与质量浓度、提取时间、料液比、提取环境可影响其提取效率[8-12]。有众多研究(提取方法各异)显示,乙醇作为火龙果果皮红色素提取溶剂,与纯水或其它有机溶剂比较,不仅提取效果好,且稳定性也较好,而乙醇最适浓度报道差异较大,20% ~75%均有报道[8-15]。我们的预实验也显示相对低浓度的乙醇水溶液提取效率比双蒸水更好。
本实验选用超声辅助乙醇浸提火龙果果皮红色素,采用紫外-可见分光光度法测量提液的吸光度值,计算其红色素提取率。试图探究超声辅助乙醇浸提法提取火龙果果皮红色素的最佳工艺条件。
1 实验部分
1.1 材料与仪器
红皮白肉火龙果;双蒸水;无水乙醇,分析纯。
UV-2102CX 型紫外可见分光光度计;B5500SDTH 型数控超声波清洗仪;FA224 电子分析天平;RE-2000A 旋转蒸发仪;HZ-D(III)循环水式多用真空泵;FW135 中草药粉碎机;202-2A 型电热恒温干燥箱;B0-2B 型台式低速离心机。
1.2 实验方法
1.2.1 样本前期处理 红皮白肉火龙果清洗干净,滤干水,去枝叶、果肉,果皮剪成约1 cm 条状物,50 ℃电热恒温干燥约8 h,直至蜷缩完全干燥,用中草药粉碎机粉碎为粉末。
1.2.2 红色素提取 按照料液比1∶50 g/mL 比例,向100 mL 烧瓶中加入30%乙醇50 mL,缓慢撒入1.00 g 果皮粉,搅拌至完全溶解,置超声仪中,40 ℃提取30 min。初提液离心20 min(4 000 r/min),上清液备抽滤,得红色素溶液(原液)。
按需适当稀释样本原液,使各样本测量吸光度A 值<0.8,确保其光密度与提取物浓度呈线性正比关系。参照文献[7]和预实验结果,于最适吸收波长538 nm 处紫外扫描各色素样本原液。参照文献[7],计算各样本红色素提取率。
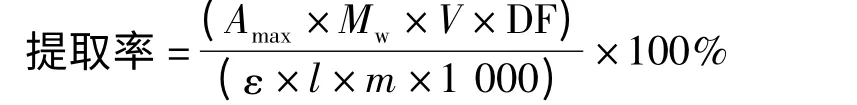
式中 Amax——最大吸收波长处测定色素的吸光度值;
Mw——甜菜苷的相对分子质量(Mw=550.4 g/mol);
V——超滤后的各浸提样本的总体积,mL;
DF——稀释倍数;
ε——样品中花色苷的摩尔吸收率[ε =66 000 L/(mol·cm)];
l——比色皿的厚度(l=1 cm);
m——称取的质量,g。
2 结果与讨论
2.1 乙醇浓度
其他条件同1.2.2 节,研究乙醇浓度对提取率的影响,结果见图1。
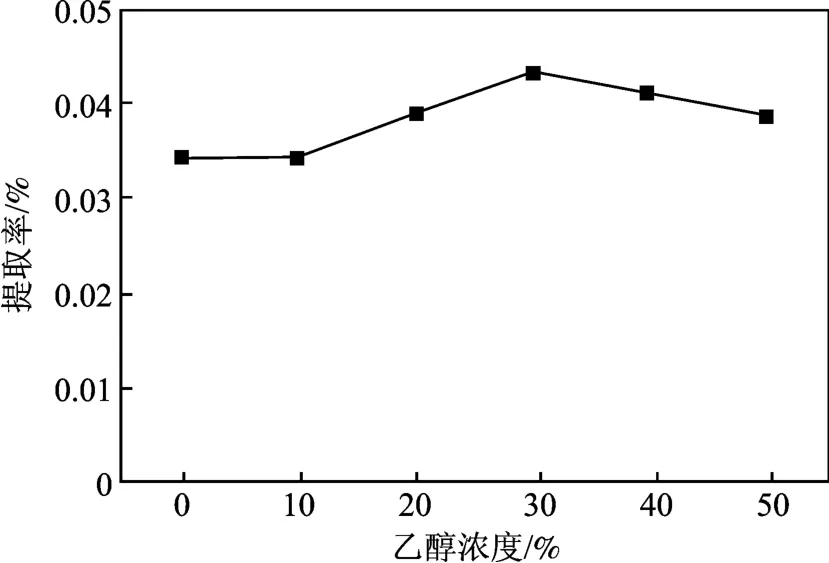
图1 乙醇浓度对火龙果红色素提取率的影响Fig.1 Effect of ethanol concentration on extraction rate of red pigment
由图1 可知,随着乙醇浓度的增加,色素的提取率增加,乙醇浓度达30%时,提取率最高;乙醇浓度>30%时,色素提取率下降。果皮粉花色苷含有亲水基及憎水基,在低浓度的乙醇下,两类集团都与提取剂作用,故而提取率较高。当乙醇浓度超越一定范围时,乙醇溶液的极性降低,非极性增大,导致色素提取率降低。同时,高浓度的乙醇溶液将可能破坏色素的化学结构。故30% 乙醇为最适提取液浓度。
2.2 料液比
其他条件同1.2.2 节,研究料液比对提取率的影响,结果见图2。
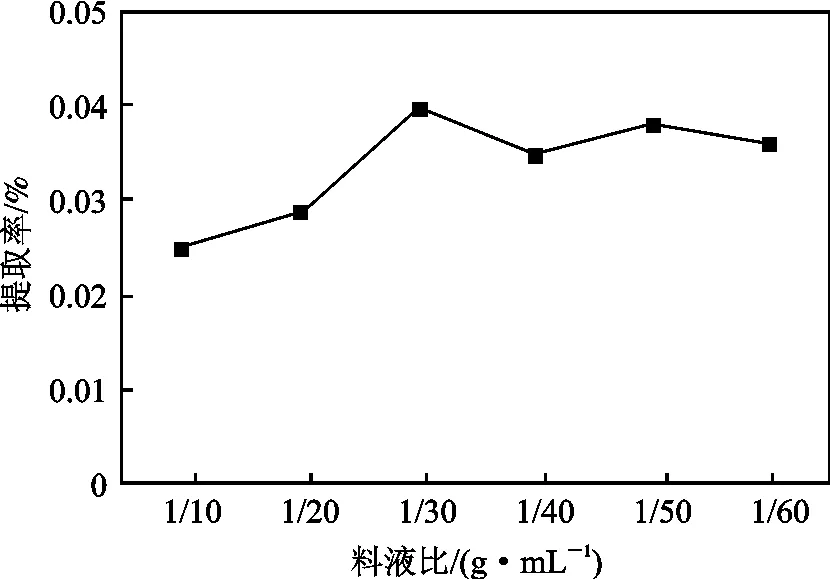
图2 料液比对火龙果红色素提取率的影响Fig.2 Effect of solid to liquid ratio on extraction rate of red pigment
由图2 可知,随着料液比的加大,色素提取率增加,当料液比为1∶30 (g/mL)时提取率最高,随后提取率有所降低。故1∶30 为最适料液比。
2.3 超声浸提时间
其他条件同1.2.2 节,研究超声浸提时间对提取率的影响,结果见图3。
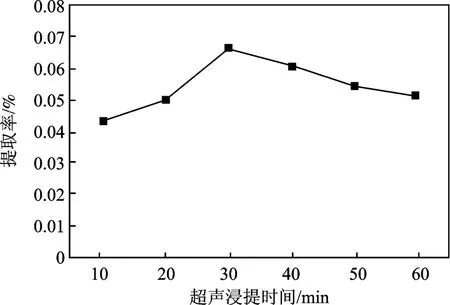
图3 超声浸提时间对火龙果红色素提取率的影响Fig.3 Effect of time on extraction rate of red pigment
由图3 可知,随着浸提时间增加,提取效率提高,30 min 时提取率最高,随后其提取率降低。故30 min 为最适时间。
2.4 超声浸提温度
其他条件同1.2.2 节,研究超声浸提温度对提取率的影响,结果见图4。
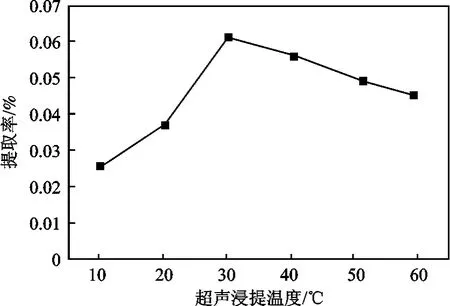
图4 超声浸提温度对火龙果红色素提取率的影响Fig.4 Effect of temperature on extraction rate of red pigment
由图4 可知,随着温度增加,提取效率增加,30 ℃时色素提取率达最高,随后色素提取率降低。故30 ℃为最适温度。
2.5 正交实验
依据上述单因素实验结果,采用60%(150 W)的超声功率,进行超声辅助乙醇提取火龙果果皮红色素的4 因素3 水平正交实验。因素与水平见表1,结果见表2。
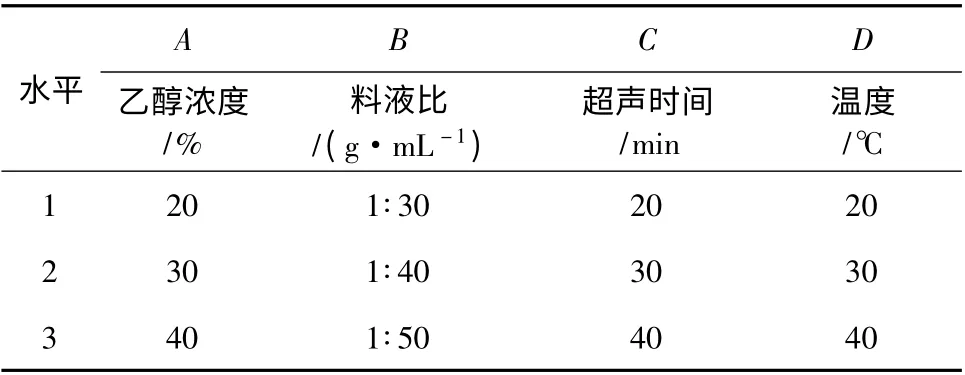
表1 因素水平表Table 1 Factors and levels table
由表2 可知,最优组合为A2B3C2D3。以相同实验方法,实施3 次实验验证,以进一步验证最佳工艺条件的客观性与科学性,结果见表3。
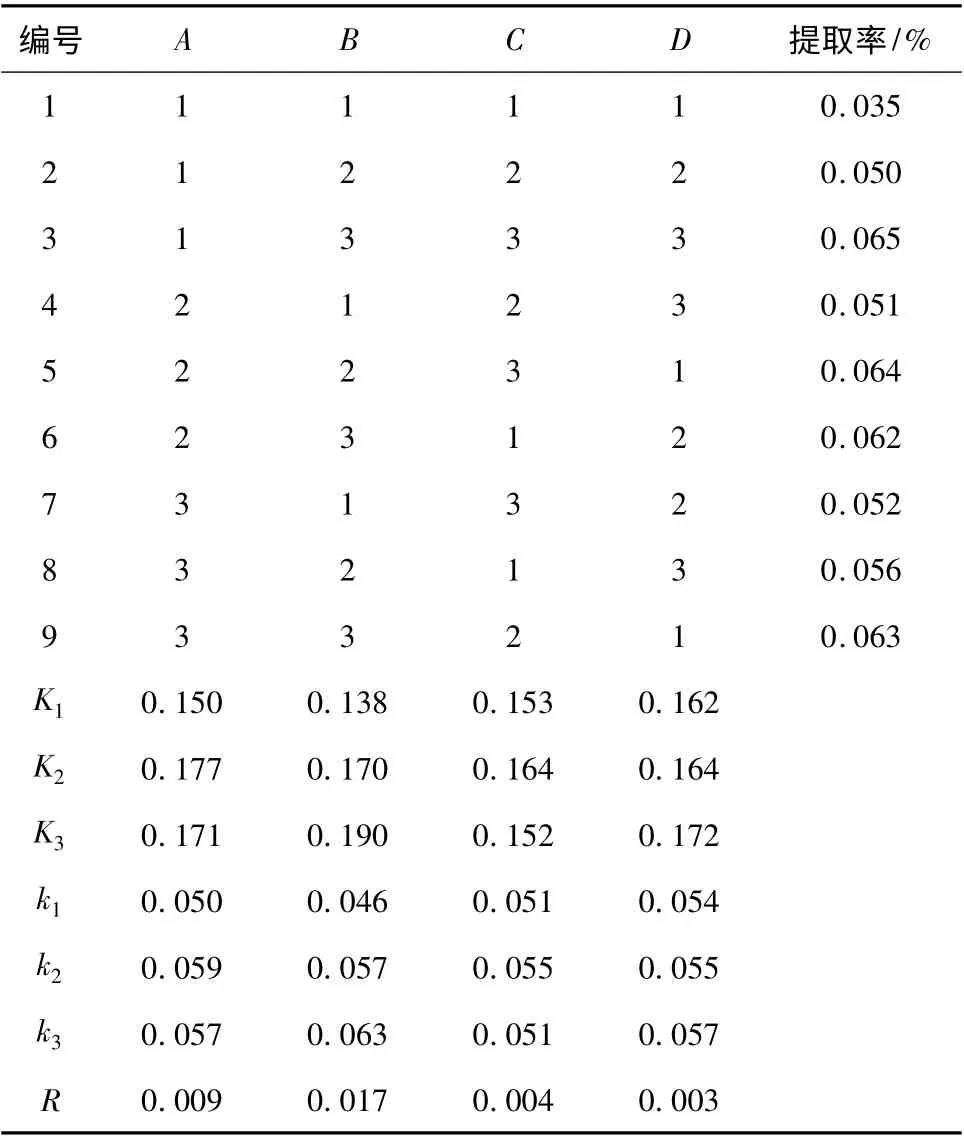
表2 正交实验结果Table 2 Results of orthogonal test
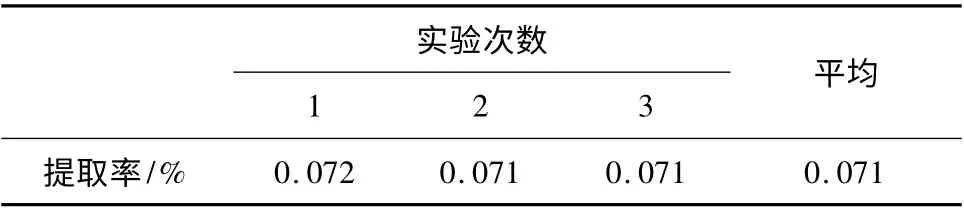
表3 验证性实验结果Table 3 Results of the verification experiment
由表3 可知,在最佳工艺条件下,火龙果果皮色素提取率为0.071%。
3 结论
超声辅助乙醇浸提火龙果果皮红色素的最佳工艺条件为:乙醇浓度30%,料液比1∶50(g/mL),超声时间30 min,提取温度40 ℃。在此条件下,红色素的提取率0.071%。
[1] 黎海利,刘锴栋,袁长春,等. 红肉火龙果果皮色素提取工艺优化及其抗氧化活性[J]. 食品与发酵工艺,2014,40(12):203-209.
[2] 廖芳,王光银,陈来平,等. 火龙果果皮色素的提取及抗氧化活性的研究[J]. 凯里学院学报,2013,31(6):61-65.
[3] Tenore G C,Novellino E,Basile A.Nutraceutical potential and antioxidant benefits of red pitaya (Hylocereus polyrhizus)extracts[J]. J Funct Foods,2012,4(1):129-136.
[4] Emiko Yanase,Kaori Nishimoto,Yuji O Kamatari,et al.Isolation of a new xanthylium-related pigment from adzuki beans vigna angularis[J]. Biosic Biotechemol Biochem,2012,76(8):1571-1572.
[5] 赵文红,梁彬霞,白卫东,等. 火龙果果皮色素的研究进展[J].中国调味品,2012,37(8):111-115.
[6] Khanafari A,Khavarinejad D,Mashinchian A. Solar salt lake as natural environmental source for extraction halophilic pigments[J].Microbiol,2010,2(2):103-109.
[7] 袁亚芳,赵珍珍,王威,等.红仙蜜’火龙果果皮红色素的提取工艺研究[J]. 热带作物学报,2014,35(1):161-165.
[8] 宋珊珊,谭沙,蔡国跃,等. 火龙果果皮色素提取工艺及稳定性研究[J].食品与机械,2013,29(2):121-125.
[9] 孙军涛,肖付刚,李芳.火龙果果皮色素的提取及稳定性研究[J].中国调味品,2014,39(8):89-91.
[10]张倩茹,袁唯. 火龙果果皮色素提取及其稳定性研究[J].农产品加工,2011,10(9):63-64.
[11]石德芝,李硕凡. 火龙果果皮红色素的提取及稳定性[J].光谱实验室,2012,29(4):2091-2094.
[12]叶丽君,邵伟琪,王兴莉,等.不同pH 值条件下火龙果色素的降解动力学[J].食品科学,2012,33(9):35-38.
[13]梁彬霞,赵文红,白卫东,等. 火龙果果皮色素提取工艺研究[J].中国食品添加剂,2012(6):103-107.
[14]王娅玲,李维峰,曹海燕.超声辅助提取火龙果果皮色素的研究[J].云南化工,2015,42(2):14-17.
[15]陈冠林,胡坤,高永清,等. 紫红肉火龙果果皮色素提取工艺的响应面法优化[J]. 湖北农业科学,2013,52(2):418-422.

