小鼠成体心脏干细胞的分离和鉴定
徐 路,詹金熹,李 云,王晓侠,吴 琼 (广西师范大学,广西 桂林 541004)
随着世界经济的迅速发展,人们生活水平的不断提高,心血管病成为各国高患病率和死亡率的主要疾病[1]。美国每年心肌梗死患者有760 万人,死亡人数超过12.5 万人。根据中国卫生部心血管病防治研究中心(NCCD)最新发布的中国心血管病2013 年度报告[2],全国心脑血管疾病(高血压、脑卒中、心肌梗死、心力衰竭等)患者约为2.9 亿,每5 人中就会有1例是心血管疾病,发病人数还在持续增加。目前,以干细胞为基础的细胞疗法成为人们关注的热点。利用成体干细胞可定向分化成心肌细胞、平滑肌细胞、血管内皮细胞;另外自体移植不存在免疫排斥反应。然而如何获得足够的自体心脏干细胞成为应用于临床的首要问题。因此建立一种可以大量高纯度提取心脏干细胞的方法至关重要。本研究以小鼠为实验对象,进行了成体干细胞的分离提取及鉴定。
1 材料与方法
1.1 实验材料
实验使用成年C57BL/6J 小鼠(2 ~3 月龄)购于湖南斯莱克景达实验动物有限公司(许可证号:湘SCXK,2011-0003)。
实验试剂:Sca-1、CD45(美国eBioscience 公司);Lineage Cocktail with Isotype Ctrl(美国Biolegend 公司);7-AAD(Life invitrigen 公司);Anti-Sca-1/Ly6A/E antibody、Goat anti-Rat IgG H&L(TRITC)Secondary antibody(英国Abcam 公司);胶原酶Ⅱ(Gibco 公司);DAPI(Sigma 公司);山羊血清、4%多聚甲醛(北京索莱宝科技有限公司);心脏干细胞生长培养基、心脏干细胞分化培养基(美国Millipore 公司)。
实验仪器:流式细胞分析仪(BD FACS Vaerse);流式细胞分选仪(BD FACS AriaⅡ);自动细胞计数仪(TC100);恒温CO2培养箱(HERAcell 240i);恒温水槽(ZSBB-712);荧光倒置显微镜(Nikon Ti-S);多用途台式高速冷冻离心机(labofuge400R);超净工作台(ESCO ACB-6A1)。
1.2 小鼠心脏细胞的分离
取小鼠断颈处死,浸泡于75%乙醇中,用大头针将小鼠固定于泡沫板上。用已灭菌的手术器械打开胸腔取出心脏,置于盛有肝素钠的平皿中。在超净工作台中用预冷的PBS 反复冲洗除去残留血液。将心脏转移至样品瓶中,剪成1 ~2 mm3的小块。每颗心脏加入2 mL 0.1%胶原酶Ⅱ,置于恒温水槽37 ℃消化25 min,每隔5 min 取出吹打均匀。消化结束加入5 mL 培养液终止消化,过45 μm 细胞筛,4 ℃1 500转离心5 min。弃掉上清加入培养基悬浮细胞,细胞计数。
1.3 小鼠心脏细胞流式分析
将提取的单细胞悬液转移到2 mL 微量离心管中,3 500 转速离心5 min。在离心管上做好标记:空白、Lin、CD45、Sca-1、Mix;空白管加入100 μL PBS 缓冲液,其他对应加入100 倍稀释的抗体PE anti-Mouse Lineage Cocktail、Anti-Mouse CD45 PerCP-Cy5.5、Anti-Mouse Ly-6A/E(Sca-1)PE-Cy7 以及三种混合的抗体。4 ℃避光孵育30 min。每管加入1 mL PBS 5 min 3 500 转速离心。再分别加入1 mL PBS 重悬细胞准备流式分析。额外准备一管细胞7-AAD 孵育20 min,孵育后加入PBS 稀释直接上流式检测细胞活性。
1.4 小鼠心脏细胞流式分选
分选前鞘液筒灭菌,做好无菌分选的准备。按上述1.3 方法处理细胞,利用流式细胞分选仪分选出Lin-CD45-Sca-1+细胞。
1.5 细胞免疫荧光染色分析
将处理好的玻片放入24 孔板中,将分选出的细胞以5 ×104密度接种于孔板中,CO2培养箱培养过夜。吸去培养基,PBS 洗3 次。加入封闭液37 ℃培养箱中封闭1 h。滴加特异性一抗Anti-Sca-1/Ly6A/E antibody,4 ℃过夜。用PBS 洗3 次,滴加二抗Goat anti-Rat IgG H&L(TRITC)Secondary antibody,室温孵育2 h。PBS 洗3 次,滴加DAPI 染核15 min。用PBS洗3 次,滴加封片剂。荧光显微镜下观察。
1.6 分选细胞体外培养
将分选出的细胞以3 ×105密度接种于96 孔板中,分别加入心脏干细胞生长培养基和心脏干细胞分化培养基,2 ~3 d 半量换液1 次。
2 结 果
2.1 流式细胞分析
将提取的单细胞悬液经抗体孵育后直接用于Lin、CD45、Sca-1 表型鉴定,鉴定此方法分离的细胞中Lin-CD45-Sca-1+所占的比例(如图1),经过多次重复实验结果:Lin-CD45-Sca-1+细胞占总细胞数的百分比例为(2.98 ± 1.23)%,每颗心脏中Lin-CD45-Sca-1+细胞数约为(1.76 ±0.68)×105。7-AAD 检测细胞活性可达到80%以上(如图2)。
2.2 分选细胞免疫荧光染色
在荧光显微镜下观察,清楚地可以看到存在表型Lin-CD45-Sca-1+细胞(如图3),通过流式细胞仪无菌分选获得的Lin-CD45-Sca-1+细胞纯度可以达到90%。
2.3 分选细胞体外培养
将无菌分选的细胞接种96 孔板后,24 h 开始贴壁,心脏干细胞生长培养基中20 h 左右可以看到小的克隆集落(如图4),随后逐渐增大。心脏干细胞分化培养基中7 d 左右开始出现形态变化(如图5)。
3 讨 论
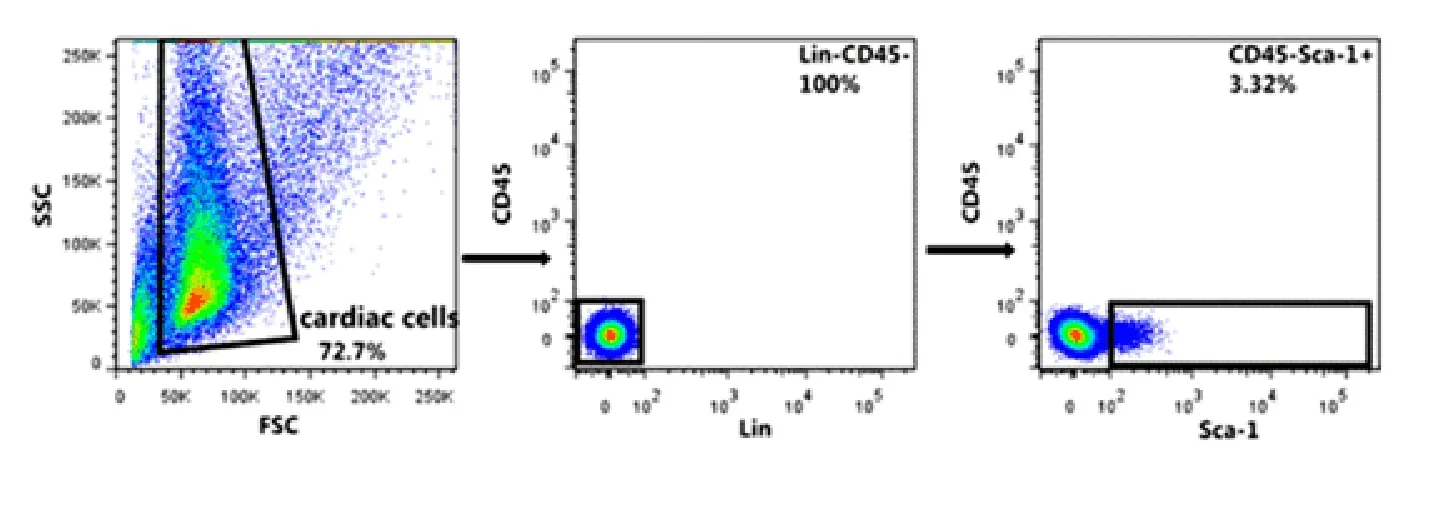
图1 干细胞表面标志鉴定
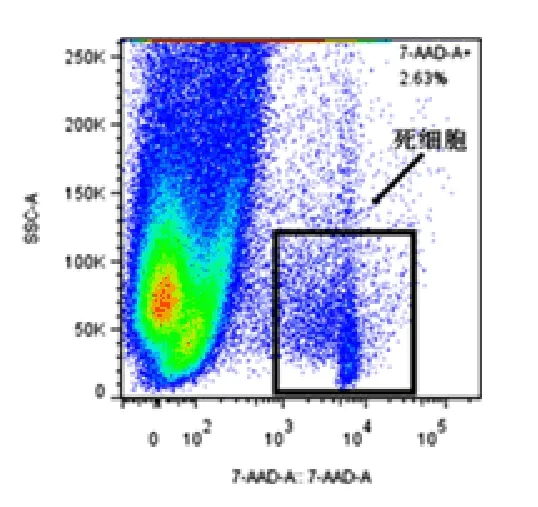
图2 7-AAD 检测细胞活性流式图
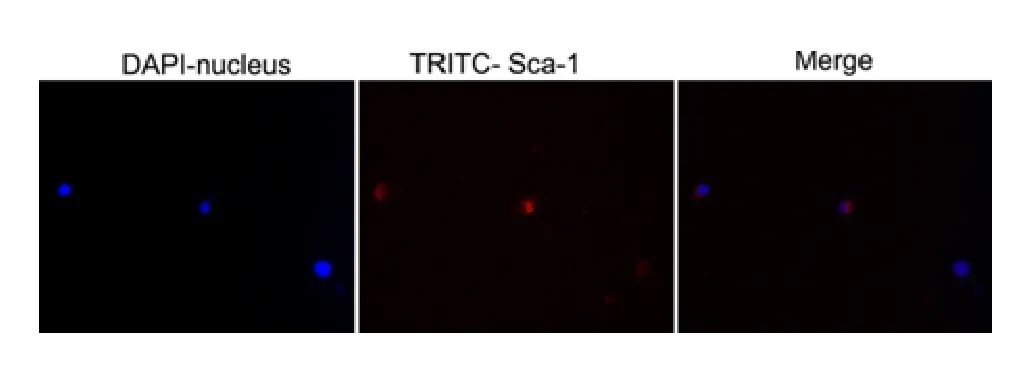
图3 免疫荧光鉴定Sca-1 在分选的Lin -CD45 -Sca-1 +细胞中的定位,Blue 为核染,Red 为Sca-1(400 ×)

图4 分选Lin -CD45 -Sca-1 +细胞体外培养形成的克隆集落,培养时间分别为:A 为1 d、B 为20 d、C 为30 d、D为40 d,高倍视野下观察到的形态
图5 分选Lin -CD45 -Sca-1 +细胞在正常培养基(A)和分化培养基(B)中培养,高倍显微镜下培养7 d 观察到的细胞形态。
长期以来,人们一直认为心脏是一个终末分化器官,但事实并非如此。Kajstura 等[3]在共聚焦显微镜下发现心脏组织中每100 万个心肌细胞有14 个细胞处于分裂状态,当患有原发性扩张性心肌病和晚期缺血性心脏病时,处于分裂状态的细胞数将会增加10倍。随后Bearzi 等[4]在人的心肌组织中分离扩增出c-kit+人的心脏干细胞(human cardiac stem cells,hCSCs),多次实验发现它们具有人的心肌功能活性,可以自我更新、克隆增殖、定向分化,据此推断心脏中存在心脏干细胞。Messina 等[5]从患者心房或心室活检标本中获得样品,通过体外培养收集到一些小、圆、亮的细胞,这些细胞可以克隆增殖,表达心脏干或祖细胞表面标记;将其移植到小鼠心脏后分化为能够收缩、表达心肌蛋白的肌细胞及血管内皮细胞,证实了人类心脏也存在心脏干细胞,并具有分化成心脏细胞系的潜能。随着对成体心脏干细胞或祖细胞的研究,在多种哺乳动物包括小鼠[6-7]、大鼠[8]和狗[9]以及人[4-5]心脏组织中都成功分离得到心脏干细胞或祖细胞。Sca-1(Stem cell antigen 1)是多种组织特异性干细胞的主要表面标志分子[10],也是目前较为常用的小鼠心脏干细胞标志蛋白[11-14]。小鼠心脏干细胞表型分类很多,所占比例各不相同。本实验主要以抗小鼠Sca-1 抗体为核心,结合其他几种抗体进行细胞标记。主要通过机械法剪碎组织和胶原酶Ⅱ消化过筛来获取单细胞悬液,细胞存活率可达到80% 左右。造血细胞系列(Lineage,Lin)抗原作为分化细胞的标志,白细胞共同抗原CD45 作为免疫细胞或血细胞的标志,结合这两种抗体可分选出Lin-CD45-Sca-1+细胞占细胞总数的百分比为(2.98 ±1.23)%,小鼠1 颗心脏中可成功分离出(1.76 ±0.68)×105个细胞。
目前常用的心脏干细胞的分离方法主要有两种,组织块培养法[5]和酶消化法[4]。利用原代组织块培养的方法获得心脏干细胞的周期较长,需要在培养基中加入多种细胞因子;而用酶消化的方法可以在短期内获得足够心脏干细胞用于后续实验,比较来说酶消化法效率更高,目前已有多组其他实验室证明[4-6]。但关于酶的种类、酶的浓度以及酶的消化时间等方面都存在一定的差异,本实验室主要采用的是浓度为0.1%胶原酶Ⅱ消化25 min,经过多次的实验确定利用这个条件获得的效率更高。
以心脏干细胞为基础的细胞疗法已经有相关报道,Rota 等在大鼠体内移植心脏祖细胞(cardiac progenitor cells,CPCs)或具有激活作用的细胞因子(GFs),2 周后观察到有新生的心肌细胞取代了约42%瘢痕组织,缓解了心室扩张[15];Williams 等通过体外诱导扩增心脏干细胞(cardiac stem cells,CSCs)注入猪的心肌梗死心脏中,4 周后检测到心肌梗死面积减少,提高了左室射血分数[16];Mohsin 等从心脏衰竭的患者体内分离出CPCs 移植到小鼠心肌梗死区,超声心动图和血流动力学检测证实20 周后改善了心室结构和功能,减小梗死区域,改善脉管系统[17]。但关于心脏干细胞如何维持自身稳态、动态变化规律以及定向分化相关影响因素和调控机制等方面的研究不够清楚,仍需要进一步研究,我们只有了解更多关于心脏干细胞的知识才能将干细胞疗法更好的应用于实践。
综上所述,本实验建立了稳定的心脏干细胞提取方法,无菌分选可获得足够量的Lin-CD45-Sca-1+细胞用于实验研究,通过体外培养可进一步了解心脏干细胞生物学特性,为心脏疾病的干细胞治疗奠定基础。
[1] Franco M,Cooper R S,Bilal U,et al.Challenges and opportunities for cardiovascular disease prevention[J].Am J Med,2011,124(2):95-102.
[2] Go AS,Mozaffarian D,Roger VL,et al.Heart disease and stroke statistics-2013 update:a report from the American Heart Association[J].Circulation,2013,127(1):e6-e245.
[3] Kajstura J,Leri A,Finato N,et al.Myocyte proliferation in end-stage cardiac failure in humans[J].Proc Natl Acad Sci U S A,1998,95(15):8801-8805.
[4] Bearzi C,Rota M,Hosoda T,et al.Human cardiac stem cells[J].Proc Natl Acad Sci U S A,2007,104(35):14068-14073.
[5] Messina E,De Angelis L,Frati G,et al.Isolation and expansion of adult cardiac stem cells from human and murine heart[J].Circ Res,2004,95(9):911-921.
[6] Oh H,Bradfute SB,Gallardo TD,et al.Cardiac progenitor cells from adult myocardium:homing,differentiation,and fusion after infarction[J].Proc Natl Acad Sci U S A,2003,100(21):12313-12318.
[7] Cai CL,Liang Xinqun,Shi Yunqing,et al.Isl1 identifies a cardiac progenitor population that proliferates prior to differentiation and contributes a majority of cells to the heart[J].Dev Cell,2003,5(6):877-889.
[8] Beltrami AP,Barlucchi L,Torella D,et al.Adult cardiac stem cells are multipotent and support myocardial regeneration[J].Cell,2003,114(6):763-776.
[9] Linke A,Muller P,Nurzynska D,et al.Stem cells in the dog heart are self-renewing,clonogenic,and multipotent and regenerate infarcted myocardium,improving cardiac function[J].Proc Natl Acad Sci U S A,2005,102(25):8966-8971.
[10] Holmes C,Stanford WL.Concise review:stem cell antigen-1:expression,function,and enigma[J].Stem Cells,2007,25(6):1339-1347.
[11] Matsuura K,Nagai T,Nishigaki N,et al.Adult cardiac Sca-1-positive cells differentiate into beating cardiomyocytes[J].J Biol Chem,2004,279(12):11384-11391.
[12] Huang Chunyan,Gu Hongmei,Yu Qing,et al.Sca-1+cardiac stem cells mediate acute cardioprotection via paracrine factor SDF-1 following myocardial ischemia/reperfusion[J].PLoS One,2011,6(12):e29246.
[13] Rosenblatt-Velin N,Lepore M G,Cartoni C,et al.FGF-2 controls the differentiation of resident cardiac precursors into functional cardiomyocytes[J].J Clin Invest,2005,115(7):1724-1733.
[14] Wang Xiaohong,Hu Qingsong,Nakamura Y,et al.The role of the Sca-1+/CD31-cardiac progenitor cell population in postinfarction left ventricular remodeling[J].Stem Cells,2006,24(7):1779-1788.
[15] Rota M,Padin-Iruegas ME,Yu Misao,et al.Local activation or implantation of cardiac progenitor cells rescues scarred infracted myocardium improving cardiac function[J].Circ Res,2008,103(1):107-116.
[16] Williams AR,Hatzistergos KE,Addicott B,et al.Enhanced effect of combining human cardiac stem cells and bone marrow mesenchymal stem cells to reduce infarct size and to restore cardiac function after myocardial infarction[J].Circulation,2013,127(2):213-223.
[17] Sadia Mohsin,Mohsin Khan,Haruhiro Toko,et al.Human cardiac progenitor cells engineered with Pim-I kinase enhance myocardial repair[J].J Am Coll Cardiol,2012,60(14):1278-1287.

