轮状病毒感染性脓毒症患儿血清CRP、免疫球蛋白水平变化及其与心肌酶谱的相关性研究
宋文君,曹巧玲
(自贡市第三人民医院儿科,四川 自贡 643020)
轮状病毒感染性脓毒症患儿血清CRP、免疫球蛋白水平变化及其与心肌酶谱的相关性研究
宋文君,曹巧玲
(自贡市第三人民医院儿科,四川 自贡 643020)
目的 分析轮状病毒感染性脓毒症患儿血清CRP、免疫球蛋白水平变化及其与心肌酶谱的关系。方法选择在本院接受住院治疗的56例轮状病毒感染性脓毒症患儿作为观察组,选择同期在本院注射疫苗的56例健康小儿作为对照组,比较两组研究对象的血清CRP、免疫球蛋白水平及心肌酶谱指标值差异,分析血清CRP、免疫球蛋白水平与心肌酶谱相关性。结果(1)观察组患儿血清CRP水平显著高于对照组(P<0.05),但其血清IgG、IgM、IgA等免疫球蛋白水平均显著低于对照组(P<0.05);(2)观察组患儿的血清高敏心肌肌钙蛋白(hs-cTnT)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)等心肌酶谱指标值明显高于对照组(P<0.05);(3)血清CRP水平与hs-cTnT、CK、CK-MB呈正相关(P<0.05),IgG、IgM、IgA水平与hs-cTnT、CK、CK-MB呈负相关(P<0.05)。结论轮状病毒感染性脓毒症患儿血清CRP、心肌酶谱水平升高,免疫球蛋白水平降低,且心肌酶谱指标值与血清CRP、免疫球蛋白含量具有相关性。
脓毒症;轮状病毒;心肌酶谱;免疫球蛋白
轮状病毒为小儿最常见感染源,多引发小儿肠道感染,严重者可引起全身炎症甚至多脏器功能损伤。脓毒症为轮状病毒感染所致的全身炎症反应综合征,易感染除肠道外的其他系统,此阶段患儿死亡率显著上升[1]。轮状病毒感染致脓毒症患儿的血清学指标水平变化与疾病的严重程度、走势甚至预后密切相关。本文主要分析轮状病毒感染性脓毒症患儿血清CRP、免疫球蛋白水平变化及其与心肌酶谱的关系,现将结果报道如下:
1 资料与方法
1.1 一般资料 选择于2012年7月至2014年7月间在本院接受住院治疗的轮状病毒感染性脓毒症患儿56例作为观察组,参照文献[1]中的标准诊断为轮状病毒感染性脓毒症。另取同期在本院接受疫苗注射的健康小儿56例作为对照组。观察组患儿中男性31例,女性25例,年龄3个月至2岁,平均(8.12±0.73)个月,体重(9.37±1.03)kg;对照组小儿中男性30例,女性26例,年龄3个月至3岁,平均(8.31±0.75)个月,体重(9.45±1.10)kg。两组小儿基线资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 观察指标
1.2.1 血清C反应蛋白 观察组与对照组小儿均抽取外周静脉血,采用酶联免疫吸附法测定血清C反应蛋白(CRP)水平。
1.2.2 免疫球蛋白 观察组与对照组小儿均抽取外周静脉血,离心后采用酶联免疫吸附法测定血清免疫球蛋白IgG、IgM、IgA水平。
1.2.3 心肌酶谱 观察组与对照组小儿均抽取外周静脉血,离心后采用电化学发光仪检测血清高敏心肌肌钙蛋白(hs-cTnT)水平;采用全自动生化分析仪检测血清肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)水平。
1.3 统计学方法 采用SPSS18.0软件对上述数据进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,相关性分析采用一元线性回归,以P<0.05为差异具有统计学意义。
2 结果
2.1 血清CRP 观察组患儿的血清CRP值为(18.72±3.16)mg/L,对照组小儿为(7.32±0.81)mg/L,观察组患儿血清CRP水平明显高于对照组,差异有统计学意义(P<0.05)。
2.2 免疫球蛋白 观察组患儿的血清IgG、IgM、IgA等免疫球蛋白水平均明显低于对照组,差异均有统计学意义(P<0.05),见表1。
表1 观察组与对照组小儿的血清免疫球蛋白水平比较(±s)
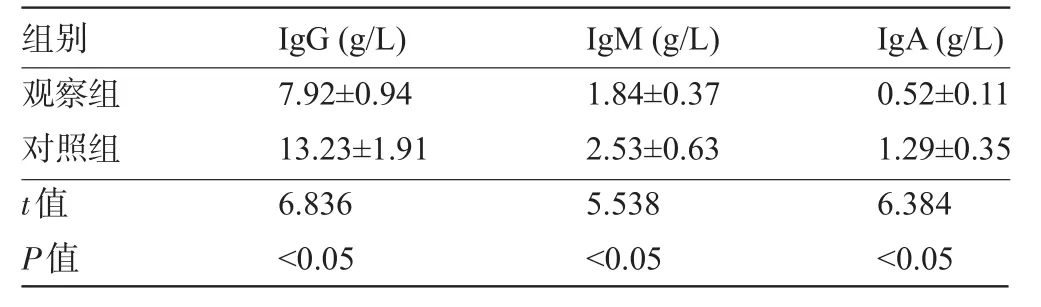
表1 观察组与对照组小儿的血清免疫球蛋白水平比较(±s)
组别IgG(g/L)IgM(g/L)IgA(g/L)观察组7.92±0.941.84±0.370.52±0.11对照组13.23±1.912.53±0.631.29±0.35t值6.8365.5386.384P值 <0.05<0.05<0.05
2.3 心肌酶谱 观察组患儿的血清hs-cTnT、CK、CK-MB等心肌酶谱指标值明显高于对照组,差异均有统计学意义(P<0.05),见表2。
表2 观察组与对照组小儿的血清心肌酶谱指标值比较(±s)
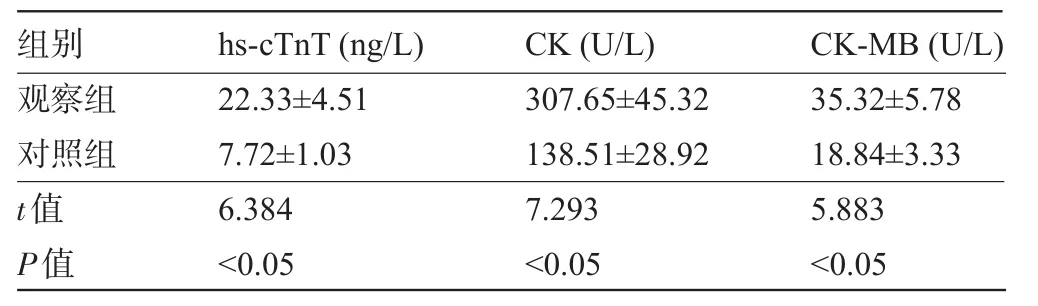
表2 观察组与对照组小儿的血清心肌酶谱指标值比较(±s)
观察组22.33±4.51307.65±45.3235.32±5.78对照组7.72±1.03138.51±28.9218.84±3.33t值6.3847.2935.883P值 <0.05<0.05<0.05
2.4 血清CRP、免疫球蛋白水平与心肌酶谱相关性 经一元线性回归分析,轮状病毒感染性脓毒症患儿血清CRP水平与各项心肌酶谱指标值呈正相关,IgG、IgM、IgA等免疫球蛋白水平与各项心肌酶谱指标值呈负相关(P<0.05),见表3。
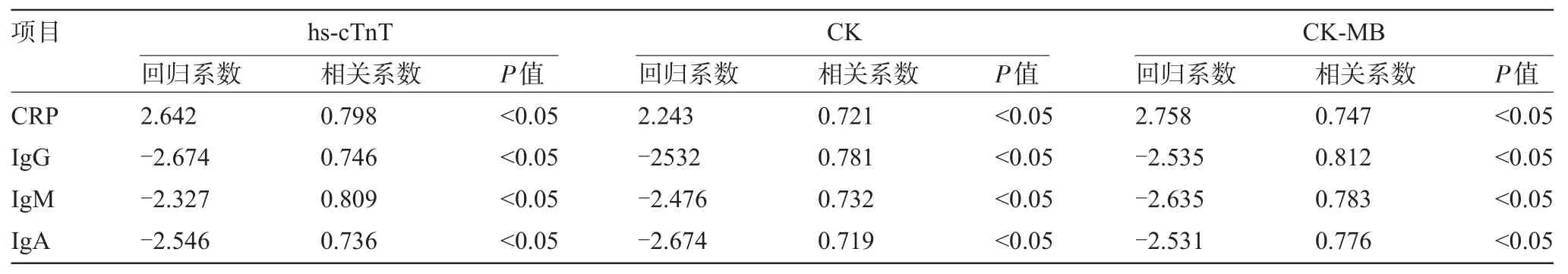
表3 轮状病毒感染性脓毒症患儿血清CRP、免疫球蛋白水平与心肌酶谱相关性
3 讨论
轮状病毒是小儿感染性疾病中最常见病原体之一,是婴幼儿致命性腹泻的首要原因。目前研究显示,轮状病毒感染不再局限于肠道病变,可引发全身感染导致多脏器功能障碍。脓毒症(Sepsis)是感染导致的全身炎症反应综合征(SIRS),多指细菌及真菌引发的重症感染,但是在儿科临床中病毒感染所致脓毒症发生率高。轮状病毒所致脓毒症的机制目前尚不明确,可能与RV直接作用或者急性炎症反应所致[2-3]。
轮状病毒合并脓毒症时各种炎症因子表达异常,CRP是其中变化最明显的炎症指标,为机体组织损伤时肝细胞合成的急性相蛋白,是机体非特异性免疫机制的一部分。脓毒症发生时患儿机体处于严重炎症及应激反应,上述研究结果中也显示:观察组患儿血清CRP水平显著高于对照组。可见脓毒症使得轮状病毒感染全身扩散,患儿各组织器官均受到损伤,CRP水平迅速上升且与患儿病情严重程度一致,急剧升高的CRP水平说明患儿病情加重、应注意多器官功能障碍综合征(MODS)发生的可能性[4]。
在轮状病毒感染中体液免疫起到监视及防御感染的作用,是人体最主要的特异性免疫系统。血清免疫球蛋白检测是判断体液免疫功能最常见指标,IgG、IgM、IgA均为抗感染抗体,当人体内有害代谢物质增加时以上免疫球蛋白大量耗损[5-6]。婴幼儿自身免疫系统尚未完善,机体抵抗力弱易受病毒感染,当轮状病毒感染时免疫功能失调,由于Ig类别转换功能低下,最终导致IgG、IgM、IgA合成、分泌缓慢。本次研究比较了轮状病毒感染后脓毒症患儿及正常小儿的血清免疫球蛋白水平,结果显示:观察组患儿的血清IgG、IgM、IgA等免疫球蛋白水平均显著低于对照组(P<0.05)。免疫球蛋白的变化直接反映机体体液免疫状态,说明轮状病毒感染致脓毒症患儿的体液免疫功能低下,这也是患儿病情进一步加重的内在原因之一[7]。
轮状病毒感染时患儿心肌损伤的发生率较高,具体机制如下:(1)轮状病毒通过胃肠道屏障进入血液循环进而导致多器官损伤;(2)淋巴系统途径所致损伤;(3)机体免疫功能降低、全身炎症反应等导致的心肌受损[8-9]。心肌组织中含有丰富酶类,当病毒导致心肌损伤时特异性心肌酶谱指标包括hs-cTnT、CK、CK-MB等均会显著上升,可以作为诊断心肌损害有效指标[10]。上述研究比较了两组小儿的血清心肌酶谱指标水平,结果显示观察组患儿的血清hs-cTnT、CK、CK-MB等心肌酶谱指标值明显高于对照组(P<0.05)。可见轮状病毒感染致脓毒症患儿确实存在明显的心肌损伤,若不及时治疗可出现不可逆性心脏损害[11]。
对于轮状病毒感染患儿,其进展至脓毒症有一个过程,对于单纯RV感染性肠炎患儿并不需要常规进行心肌保护治疗,当血液指标检测出明显的心肌酶谱水平上升时心肌损伤已较明显,故选择何时进行患儿心肌保护成为临床难点[12-13]。上述研究对RV感染致脓毒症患儿的血清CRP、免疫球蛋白水平与心肌酶谱指标值进行相关性分析,结果显示:轮状病毒感染性脓毒症患儿血清CRP水平与各项心肌酶谱指标值呈正相关,IgG、IgM、IgA等免疫球蛋白水平与各项心肌酶谱指标值呈负相关。可见当轮状病毒感染患儿检测出CRP明显上升及免疫球蛋白水平降低时,心肌损伤的风险已经显著增加,此时可早期进行心肌保护治疗以减少甚至避免心肌损害导致的心肌酶谱改变[14-15]。
综上所述,轮状病毒感染性脓毒症患儿血清CRP、心肌酶谱水平升高,免疫球蛋白水平降低,且心肌酶谱指标值与患儿其他血清指标变化存在直接相关性,对日后早期心肌保护提供新思路。
[1]Ramani S,Paul A,Saravanabavan A,et al.Rotavirus antigenemia in Indian children with rotavirus gastroenteritis and asymptomatic infections[J].Clin Infect Dis,2010,51(11):1284-1289.
[2]张卫国,唐 芳,陈德平.轮状病毒感染性脓毒症患儿血清降钙素原、白细胞介素-6、肿瘤坏死因子-α水平变化的意义[J].实用儿科临床杂志,2012,27(6):421-423.
[3]Marthaler D,Homwong N,Rossow K,et al.Rapid detection and high occurrence of porcine rotavirus A,B,and C by RT-qPCR in diagnostic samples[J].J Virol Methods,2014,209C:30-34.
[4]周喜友,刘文娟.轮状病毒感染性脓毒症患儿中性粒细胞CD11b、白细胞介素-6、hs-CRP水平变化及其临床意义[J].中国实用医药,2012,7(29):128-130.
[5]Leshem E,Lopman B,Glass R,et al.Distribution of rotavirus strains and strain-specific effectiveness of the rotavirus vaccine after its introduction:a systematic review and meta-analysis[J].Lancet Infect Dis,2014,14(9):847-856.
[6]Oishi T,Taguchi T,Nakano T,et al.The occurrence of severe rotavirus gastroenteritis in children under 3 years of age before and after the introduction of rotavirus vaccine:a prospective observational study in three pediatric clinics in Shibata City,Niigata Prefecture, Japan[J].Jpn J Infect Dis,2014,67(4):304-306.
[7]张付来.小儿轮状病毒肠炎合并脓毒症对病情及预后的影响[J].中外医疗,2011,34(7):34-36.
[8]Tatsumi M,Nagaoka Y,Tsugawa T,et al.Longitudinal analysis of VP7 gene of group A human rotavirus G2P[4]strains circulating in the pre-vaccine era in Sapporo,Japan from 1991 to 2011[J].Microbiol Immunol,2014,58(9):540-504.
[9]Marthaler D,Suzuki T,Rossow K,et al.VP6 genetic diversity,reassortment,intragenic recombination and classification of rotavirus B in American and Japanese pigs[J].Vet Microbiol,2014,172(3-4): 359-366.
[10]韩 联.婴幼儿轮状病毒感染对血清心肌酶谱的影响及临床意义[J].航空航天医学杂志,2014,25(5):666-668.
[11]Anca IA,Furtunescu FL,Pleşca D,et al.Hospital-based surveillance to estimate the burden of rotavirus gastroenteritis in children below five years of age in Romania[J].Germs,2014,4(2):30-40.
[12]Bekdas M,Demircioglu F,Goksugur SB,et al.Is there a relationship between rotavirus positive gastroenteritis and ABO blood groups?a retrospective cohort study[J].Arch Argent Pediatr,2014, 112(4):345-347.
[13]Shetty SA,Mathur M,Deshpande JM.Complete genome analysis of a rare group A rotavirus,G11P[25],isolated from a child in Mumbai,India,reveals interspecies transmission and reassortment with human rotavirus strains[J].J Med Microbiol,2014,63(Pt 9): 1220-1227.
[14]Duponchel S,Troupin C,Vu LT,et al.Transfection of exogenous rotavirus rearranged RNA segments in cells infected with a WT rotavirus results in subsequent gene rearrangements[J].J Gen Virol, 2014,95(Pt 9):2089-2098.
[15]Madhi SA,Bamford L,Ngcobo N.Effectiveness of pneumococcal conjugate vaccine and rotavirus vaccine introduction into the South African public immunisation programme[J].SAfr Med J,2014,104 (3 Suppl 1):228-234.
Serum CRP,immune globulin level change of children with sepsis for rotavirus infection and relationship with myocardial enzyme.
SONG Wen-jun,CAO Qiao-ling.Department of Paediatrics,the Third People's Hospital of Zigong, Zigong 643020,Sichuan,CHINA
Objective To analyze serum CRP,immune globulin level change of children with sepsis for rotavirus infection and its relationship with myocardial enzyme.MethodsFifty-six children with sepsis for rotavirus infection in our hospital were enrolled in observation group,and 56 healthy children received vaccine injection in our hospital over the same period were enrolled in control group.Then serum CRP level,immunoglobulin and myocardial enzyme index were compared,and correlations between serum CRP,immunoglobulin level and myocardial enzyme were analyzed.Results(1)Patients'serum CRP level in the observation group was significantly higher than that in the control group(P<0.05).Serum IgG,IgM and IgA levels were significantly lower than those of control group(P<0.05).(2)Patients'serum myocardial enzyme index hs-cTnT,CK,CK-MB in the observation group were significantly higher than those in the control group(P<0.05).(3)Serum CRP level was positively correlated with hs-cTnT,CK, CK-MB levels(P<0.05).IgG,IgM and IgA immune globulin levels were negatively correlated with hs-cTnT,CK, CK-MB levels(P<0.05).ConclusionSerum CRP and myocardial enzymes levels increase in children with sepsis for rotavirus infection,while immunoglobulins levels decrease.There are significant correlations between myocardial enzyme index and serum CRP,immune globulin levels.
Sepsis;Rotavirus;Myocardial enzyme;Immune globulin
R725.4
A
1003—6350(2015)07—0958—03
10.3969/j.issn.1003-6350.2015.07.0343
2014-10-17)
自贡市科学技术局重点科技计划项目(编号:0J08)
宋文君。E-mail:398146220@qq.com

