复方扶正消癌1号对胃癌患者T淋巴细胞及树突状细胞表型影响的临床研究
高红芳 周 莉
(上海市第七人民医院肿瘤科,上海200137)
胃癌是我国发病率最高的恶性肿瘤之一,中晚期多表现为气阴两虚型。我院中药复方扶正消癌1号在以往研究中被证实治疗中晚期胃癌气阴两虚型疗效确切,但其作用机制尚不清楚。T淋巴细胞和树突状细胞(dendritic cell,DC)是参与机体细胞免疫的主要功能细胞,其中DC是目前已知的机体内最强的抗原提呈细胞,是细胞免疫应答的始动者,其通过捕获抗原、加工处理后将抗原特异性地递呈给T淋巴细胞而发挥免疫保护功能。研究发现,T淋巴细胞和DC介导的细胞免疫与肿瘤的发展、转移、复发密切相关[1]。本研究旨在通过比较,观察复方扶正消癌1号对胃癌晚期患者T淋巴细胞及树突状细胞表型表达的影响,探讨复方扶正消癌1号对中晚期胃癌气阴两虚型患者免疫功能的作用。
1 临床资料
1.1 一般资料 收集我院肿瘤科2010年1月到2014年3月间收治的晚期胃癌患者60例,所有患者均有明确的病理学或细胞学诊断,按照单盲法随机分为治疗组与对照组。治疗组30例:男18例,女12 例;年龄 48~67 岁,平均年龄(56.92±11.27)岁;病理分型腺癌25例,其他5例;临床分期Ⅲ期13例,Ⅳ期17例;转移部位为肺转移8例,肝转移12例,脑转移3例,骨转移3例,没有转移6例。对照组30例:男 17例,女 13例;年龄 44~64岁,平均年龄(58.12±12.10)岁;病理分型腺癌 24 例,其他 6 例;临床分期Ⅲ期14例,Ⅳ期16例;转移部位为肺转移9例,肝转移11例,脑转移3例,骨转移3例,没有转移6例。2组患者一般资料比较,无统计学差异(P>0.05),具有可比性。
1.2 诊断标准 西医诊断标准:按照全国胃癌协作组通过的胃癌诊断标准及UICC分期标准[2],所有病例均有病理学或细胞学诊断。中医诊断标准:参考《中药新药临床研究指导原则》中气阴两虚证的辨证依据[3]。主症:①胃脘痞满;②堵闷不舒;③食后加重;④舌质胖嫩或有齿痕,色淡红,苔薄白或少苔;⑤脉沉细或濡缓。次症:①神疲乏力;②少气懒言;③自汗;④口干少饮;⑤形体消瘦。凡具备以上主症2项(其中舌苔脉象必备1项)加次症2项即可诊断。
1.3 纳入标准 (1)经病理学确诊为胃癌;(2)参考国际抗癌联盟分期标准,临床分期为Ⅲ-Ⅳ期;(3)中医符合气阴两虚型诊断;(4)行为状态评分≥3分;(5)预计生存期>6 个月;(6)至少有一处可测量的病灶,主要脏器功能正常;(7)年龄为44岁到64岁;(8)知情同意,依从性好,可随访。
2 治疗方法
2.1 对照组 根据病情,均为无法耐受或放弃放、化疗等治疗的患者,予最佳支持疗法(BSC):结合气阴两虚证型,每日予以参麦注射液60mL益气养阴、抗肿瘤、提高免疫;结合患者其他兼证给予必要的对症处理,如予以硫酸吗啡缓释片止痛,奥美拉唑注射液制酸,盐酸甲氧氯普胺止呕等。
2.2 治疗组 在对照组治疗的基础上给予口服复方扶正消癌1号,药物组成:黄芪15g,太子参15g,麦冬15g,白术 10g,山药12g,茯苓 12g,白花蛇舌草30g,当归 15g,冬凌草 15g,延胡索 15g,柿蒂 10g,甘草6g。汤药制备由医院制剂科统一完成,专人负责质控监制,每剂水煎煮2次,合并药汁约300mL,每日1剂,分2次饭后服。
2组均以治疗1个月为1个疗程,连续治疗3个疗程。
3 疗效观察
3.1 观察指标 流式细胞仪检测治疗前后患者外周血T淋巴细胞CD3+、CD4+及CD8+和DC细胞表型 CD1α、CD80、CD86 及 CD83 的表达。
3.2 统计学方法 采用SPSS16.0统计软件进行处理。计量资料以(±s)表示,治疗组与对照组比较采用t检验,组间率的比较采用方差分析,P<0.05为差异有统计学意义。
3.3 治疗结果
3.3.1 2组患者治疗前后T淋巴细胞表达变化 治疗前2组患者外周血 T淋巴细胞 CD3+、CD4+及CD8+表达未见明显差异 (P>0.05)。与治疗前相比,治疗组治疗3个月后外周血T淋巴细胞CD3+、CD4+表达显著增加(P<0.05),而 CD8+表达显著下降(P<0.05),CD4+/CD8+水平显著增加(P<0.05)。与治疗前相比,对照组治疗3个月后,CD3+、CD4+、CD8+表达及CD4+/CD8+水平未见明显差异(P>0.05)。 见表 1。
表1 治疗组与对照组治疗前后T淋巴细胞表达比较(±s)%
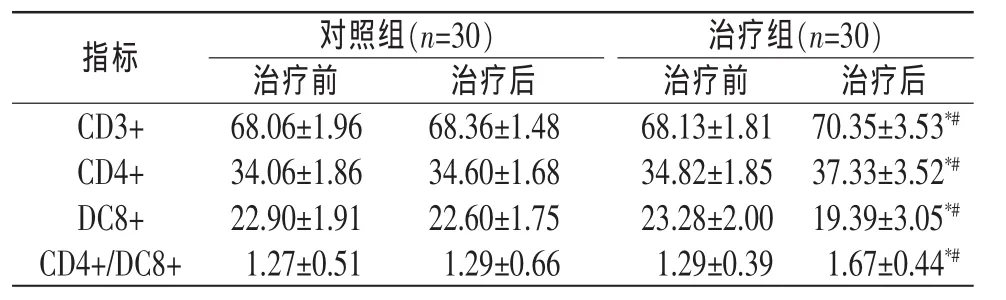
表1 治疗组与对照组治疗前后T淋巴细胞表达比较(±s)%
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
对照组(n=30)治疗组(n=30)治疗前 治疗后 治疗前 治疗后CD3+指标68.06±1.96 70.35±3.53*#68.36±1.48 68.13±1.81 CD4+DC8+ 22.90±1.91 22.60±1.75 23.28±2.00 19.39±3.05*#34.06±1.86 34.60±1.68 34.82±1.85 37.33±3.52*#CD4+/DC8+ 1.27±0.51 1.29±0.66 1.29±0.39 1.67±0.44*#
3.3.2 2组患者治疗前后DC表型表达变化 治疗前2组患者 DC表型 CD1α、CD80、CD86及 CD83表达未见明显差异(P>0.05)。与治疗前相比,治疗组治疗3 个月后 DC 表型 CD1α、CD80、CD83、CD86 表达显著增加(P<0.05)。与治疗前相比,对照组治疗3个月后DC细胞表型表达未见明显差异(P>0.05)。见表2。3.4 不良反应发生情况 整个临床试验阶段发现有3例患者出现了呕吐症状,推测此呕吐发生与原发胃癌有关,经对症治疗后症状消失,无其他明显肝、肾毒性反应,表明临床上加服复方扶正消癌1号治疗晚期胃癌是安全的。
表2 治疗组与对照组治疗前后DC表型表达比较(±s)%
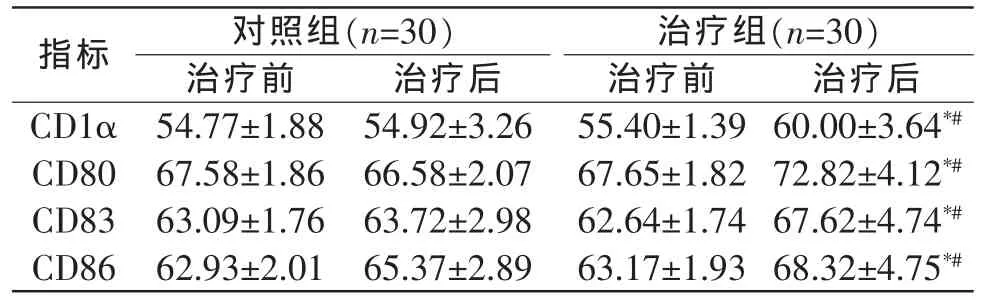
表2 治疗组与对照组治疗前后DC表型表达比较(±s)%
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
对照组(n=30)治疗组(n=30)治疗前 治疗后 治疗前 治疗后CD1α指标54.77±1.88 60.00±3.64*#54.92±3.26 55.40±1.39 CD80 CD83 63.09±1.76 63.72±2.98 62.64±1.74 67.62±4.74*#CD86 62.93±2.01 65.37±2.89 63.17±1.93 68.32±4.75*#67.58±1.86 66.58±2.07 67.65±1.82 72.82±4.12*#
4 讨论
早中期胃癌目前治疗方法仍以手术、放疗、化疗为主,效果较好,但针对晚期胃癌缺乏有效手段。中医扶正祛邪法在改善中晚期胃癌患者的临床症状,提高生活质量,延长生存时间以及辅助化疗的增效与减毒等方面表现出明显优势。中晚期胃癌多以虚为主,虚多实少,主要表现为气阴两虚型,本研究采用的复方扶正消癌1号,是我院肿瘤科的临床经验方。方中黄芪、太子参、白术扶正益气为君,白花蛇舌草、冬凌草攻伐抗癌为臣,佐以延胡索、柿蒂止痛降逆,并以甘草调和诸药。全方健脾补气、益胃固表,共奏扶助正气、攻伐癌肿之效。
本研究结果显示,与对照组比较,复方扶正消癌1号治疗3个疗程后,患者外周血T淋巴细胞CD3+、CD4+表达明显增加,CD8+表达显著降低,CD4+/CD8+比例明显增加。CD3+可以反映T淋巴细胞总值的变化,CD3+增加,提示复方扶正消癌1号可以提高淋巴细胞总值。CD4+的T淋巴细胞也称辅助性T淋巴细胞,它可以通过多种途径发挥抗肿瘤作用。CD8+T淋巴细胞分为抑制性T细胞(TS)和杀伤性T细胞(TC)。与CD4+的T淋巴细胞相比,CD8+T细胞一方面在细胞免疫的终末阶段产生杀伤肿瘤的作用,另一方面也可以产生抑制T淋巴细胞调节的作用,故而,CD4+/CD8+可以反映T辅助细胞与T抑制细胞之间的平衡,进而反映机体的免疫状态。CD4+增加,CD4+/CD8+增加,CD8+降低,提示复方扶正消癌1号可以促进淋巴细胞活化和增殖,提高机体免疫功能。
肿瘤抗原递呈是诱导细胞免疫应答发挥抗肿瘤功能的关键过程,而DC是机体内已知的最强抗原递呈细胞,它能高效摄取、加工处理和递呈抗原[4],未成熟的DC具有较强的迁移能力,成熟DC能有效激活初始型T细胞,将信息传递给T淋巴细胞,开始机体细胞免疫应答。肿瘤细胞可以通过干扰DC迁移或成熟而影响DC功能的发挥,逃避机体的免疫监测,进而增殖或转移[5]。而DC细胞功能的发挥,同其细胞表型表达有关。其中CD1α是DC的特异性表面标志,CD1α阳性细胞数的多少可反映DC的数量[6];CD83是成熟DC的主要特征性标志,其激活淋巴细胞功能最强[7];CD86是DC表面重要的共刺激分子,CD86与T细胞表面的CD28构成共刺激通路,可激活MHCI类限制性CD8+的T细胞和MHCⅡ类限制性CD4+的T细胞,从而发挥抗肿瘤作用[8];CD80为DC表面的共刺激分子之一,通过与淋巴细胞表面的共刺激分子受体相结合,形成强烈的共刺激信号,参与T细胞的活化[9-10]。本研究结果表明,与治疗前和对照组治疗后相比,复方扶正消癌1号治疗3个月后胃癌患者DC细胞表型CD1α、CD80、CD83、CD86 表达显著增加, 提示复方扶正消癌1号能够促进DC成熟,进而提升T淋巴细胞发挥抗肿瘤的免疫应答作用。
本研究为复方扶正消癌1号的临床推广提供了依据,至于复方扶正消癌1号降低的CD8+T淋巴细胞具体是TS还是TC还有待进一步研究。
[1] MeliefCJ,Cancerimmunotherapybydendriticcells.Immunity,2008,29(3):372
[2] 权继传,解亦斌,田艳涛.国际抗癌联盟胃癌TNM分期系统第七版解读.中华诊断学电子杂志,2014,2(1):72
[3] 郑筱萸.中药新药临床研究指导原则(试行).北京:中国医药科技出版社,2002:124
[4] Conrad C,Nestle FO.Dendritic cell-based cancer therapy.Curr Opin Mol Ther,2003,5(4):405
[5] Vicari AP,Caux C,Trinchieri G.Tumour escape from immune surveillance through dendritic cell inactivation.Semin Cancer Biol,2002,12(1):33
[6] Coventry BJ,Austyn JM,Chryssidis S,et al.Identification and isolation of CD1α positive putative tumour Infiltrating dendritic cells in human breast cancer.Adv Exp Med Biol,1997,417:571
[7] Kashimura S,Saze Z,Terashima M,et al.CD83 (+ )dendritic cells and Foxp3 (+) regulatory T cells in primary lesions and regional lymph nodes are inversely correlated with prognosisofgastric cancer.Gastric Cancer,2012,15(2):144
[8] Parlato S,Logozzi M,Belardelli F,et al.A new type I IFN-mediated pathway for the rapid differentiation of monocytes into highly active dendritic cells.Stem Cells,2003,21(3):357
[9] Seager Danciger J,Lutz M,Hama S,et al.Method for large scale isolation,culture and cryopreservation of human monocytes suitable for chemotaxis,cellular adhesion assays,macrophage and dendritic cell differentiation.J Immunol Methods,2004,288(1-2):123
[10] Rouard H,Léon A,KlonjkowskiB,etal.Adenoviral transduction of human'clinical grade'immature dendritic cells enhances costimulatory molecule expression and T-cellstimulatory capacity.JImmunolMethods,2000,241(1-2):69

