乙醇含量对广东黄酒香气成分的影响
黄伟健,白卫东,2 *,孙双鸽,钱 敏,颜冬梅
(1.仲恺农业工程学院 轻工食品学院,广东 广州 510225;2.华南农业大学 食品学院,广东 广州 510642)
广东黄酒即客家娘酒,又称“月子酒”,集营养、可口、保健于一体,在客家地区,妇女生完孩子坐月子时,用其煮鸡肉滋补身体,可以使妇女在短时间内恢复身体[1]。广东黄酒是用优质糯米经过浸泡、蒸饭、拌曲、前发酵、压榨、后发酵、灭菌、灌装等程序做成的味浓香醇的甜型黄酒,具有独特的风味[2],还含有丰富的生物活性成分,如γ-氨基丁酸[3-4]、低聚糖[5]及多酚类物质[6-7]等。在前发酵阶段,由于广东地区气候的关系,发酵期过长,会导致糯米变酸、变坏。因此,在发酵约5~7 d时会添加一定量的食用酒精,以杀死微生物、阻止糯米的继续糖化,乙醇含量为30%vol~50%vol,广东黄酒并没有一个统一标准。鉴于此,本研究考察广东客家黄酒酿造过程中添加不同乙醇浓度的食用酒精对黄酒香气成分的影响。
本实验采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)与气相色谱-质谱联用技术(gas chromatography-mass spectrometer,GC-MS)相结合,对实验室条件下添加不同乙醇浓度的广东黄酒进行香气成分检测,与比工厂条件下添加乙醇浓度为40%vol~50%vol食用酒精所酿黄酒的风味成分进行对比,以分析实验室条件下所酿黄酒之间香气成分的差别,对工厂生产不同质量的广东黄酒做出理论指导。
1 材料与方法
1.1 材料与试剂
糯米:市售;酒药、麦曲、红曲、工厂酒样等:广东省紫金县黄龙实业发展有限公司;食用酒精:广州市俱辉化工有限公司;氯化钠(分析纯):天津市福晨化学试剂厂。
1.2 仪器与设备
GC6890N/MS5973:美国安捷伦公司;85-2A 型数显恒温磁力搅拌器:江苏金坛市金城国胜实验仪器厂;50/30 μm DVB/CAR on PDMS固相萃取头:上海安逸科学仪器有限公司。
1.3 试验方法
1.3.1 样品处理方法
根据广东黄酒酿造工艺在实验室条件下酿制黄酒[8]。取1 800 g糯米,经浸米16 h后蒸饭、拌曲、入缸发酵,6 d后,拌匀,平均分装到6组1 L的广口瓶中,向其中分别添加180 mL乙 醇 浓 度 为25%vol、30%vol、35%vol、40%vol、45%vol、50%vol的食用酒精,发酵45 d,经压榨、澄清、过滤、煮酒后,相同条件下储存6个月,为待测样品。
将样品摇匀后,按照韩笑等[9]的方法根据实验室自身条件进行修改,分别取实验室条件下的酿酒与工厂酒样品7 mL,加入NaCl 3 g于10 mL顶空瓶中,在55 ℃条件下预热20 min,萃取50 min,GC进样口解析5 min。
1.3.2 样品的GC-MS分析
色谱条件:色谱柱为HP-INNOWax(30 mm×0.25 mm,0.25 μm),进样口温度250 ℃,起始温度40 ℃,恒温1 min后,以6 ℃/min 程序升温至100 ℃,再以3 ℃/min程序升温至200 ℃,然后以10 ℃/min程序升温至230 ℃,恒温3 min,保持载气为He,流速1.0 mL/min。
质谱条件:电离方式为电子电离(electronic ionization,EI),电离电压70 eV,连接杆温度250 ℃,扫描范围为29~550 amu。
按此分析测试条件,对黄酒样品进行GC-MS定性分析。化合物定性分析是根据GC-MS联用所得质谱信息,经计算机用NIST 02谱库解析检索香气成分,采用归一化法计算各个挥发性成分的相对含量。
2 结果与分析
2.1 自酿黄酒及工厂酒样香气成分GC-MS分析
加50%vol食用酒精的黄酒和工厂酒样的总离子流色谱图分别见图1和图2。
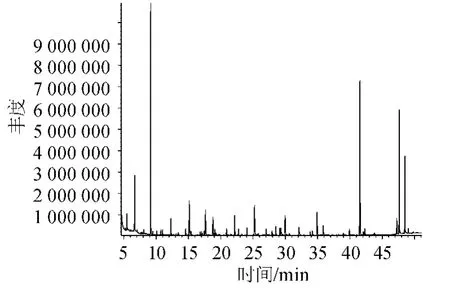
图1 添加乙醇含量50%vol食用酒精的黄酒的总离子流色谱图Fig.1 Total ion chromatogram of the Cantonese rice wine sample with 50%vol ethanol addition
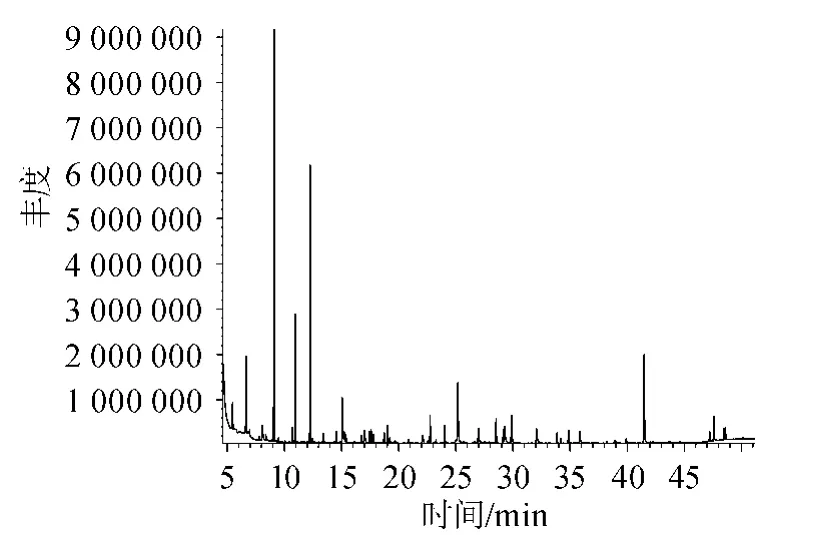
图2 工厂酒样的总离子流色谱图Fig.2 Total ion chromatogram of factory sample
实验室条件下添加不同乙醇含量的食用酒精所酿黄酒与工厂酒样的香气成分GC-MS分析结果见表1。
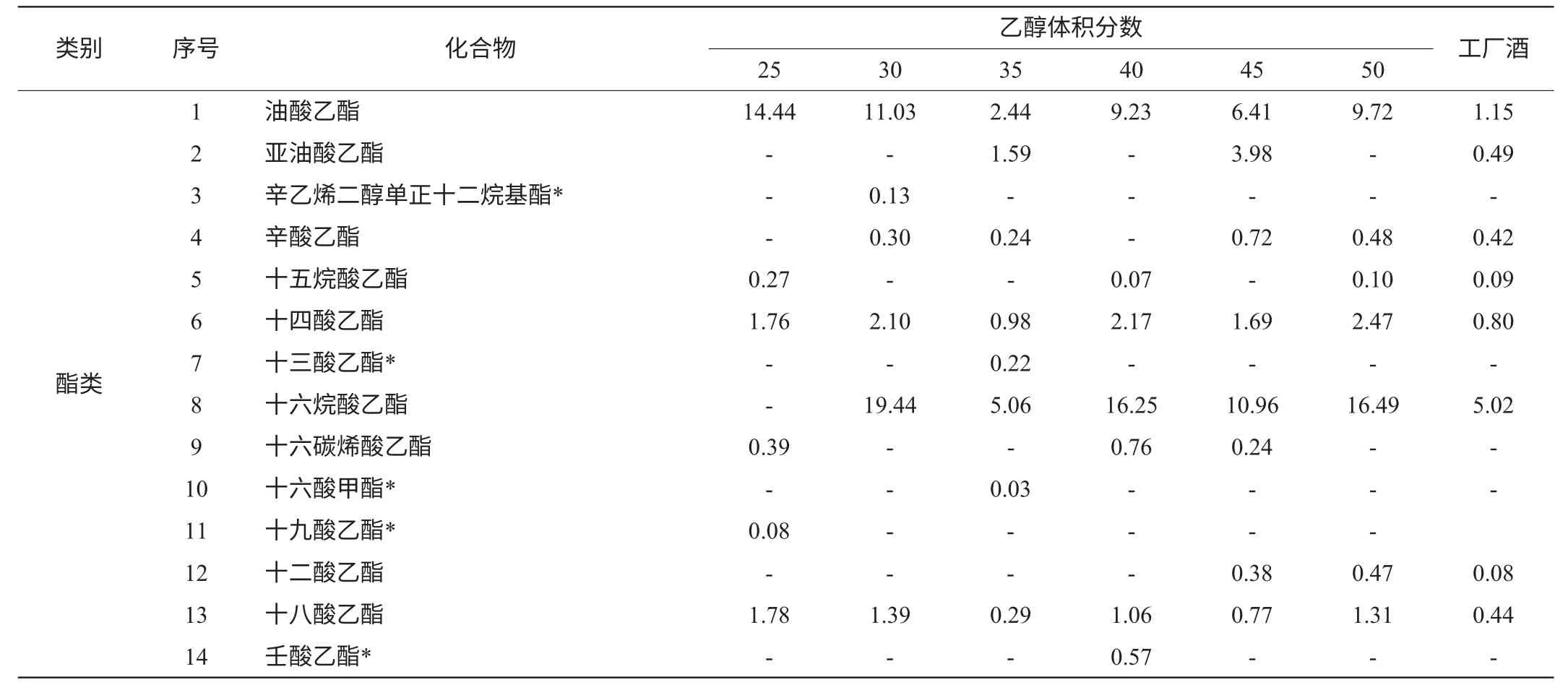
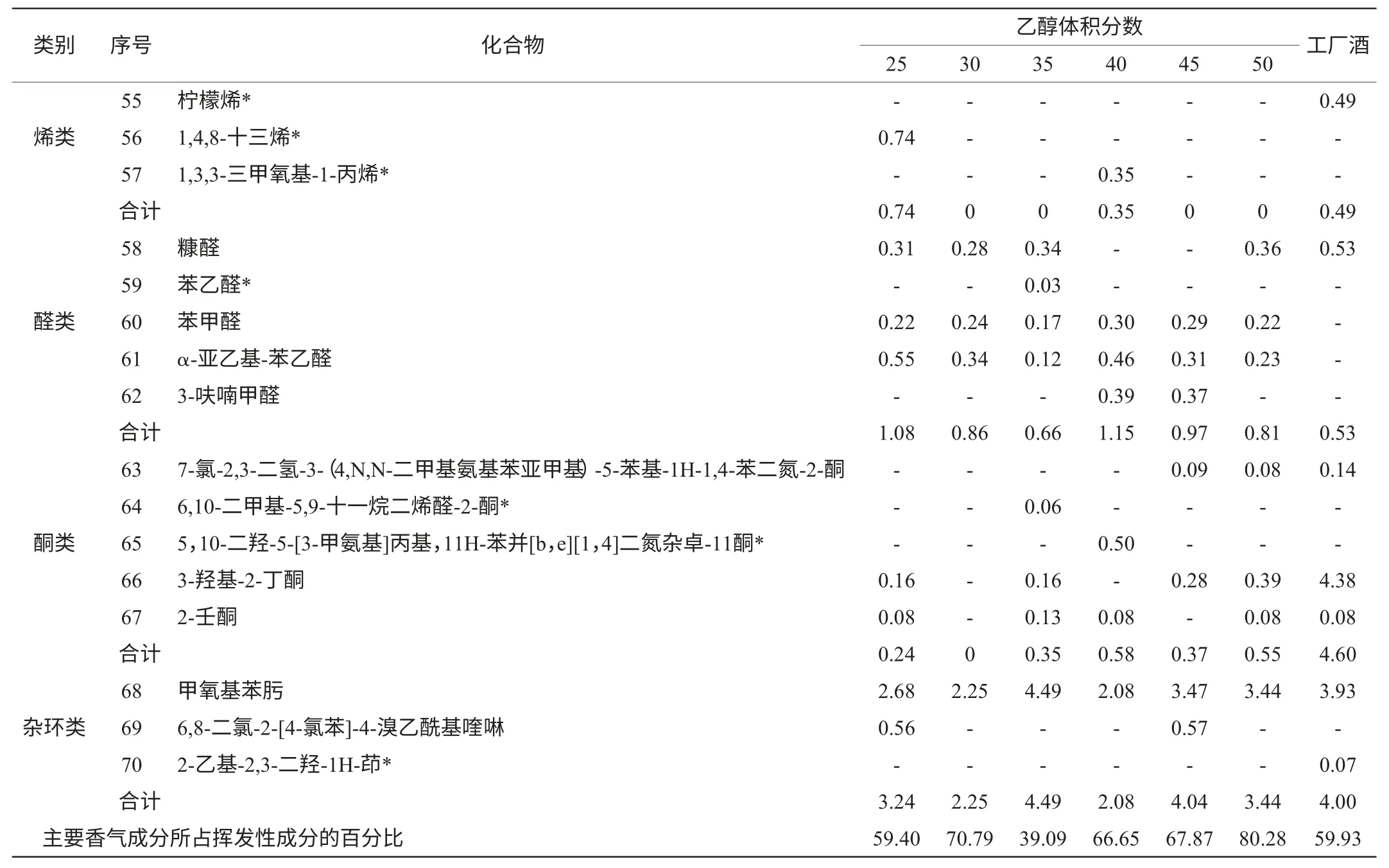
表1 自酿黄酒与工厂酒样挥发性香气成分GC-MS检测结果Table 1 The results of home-made rice wine and factory wine detected by GC-MS %
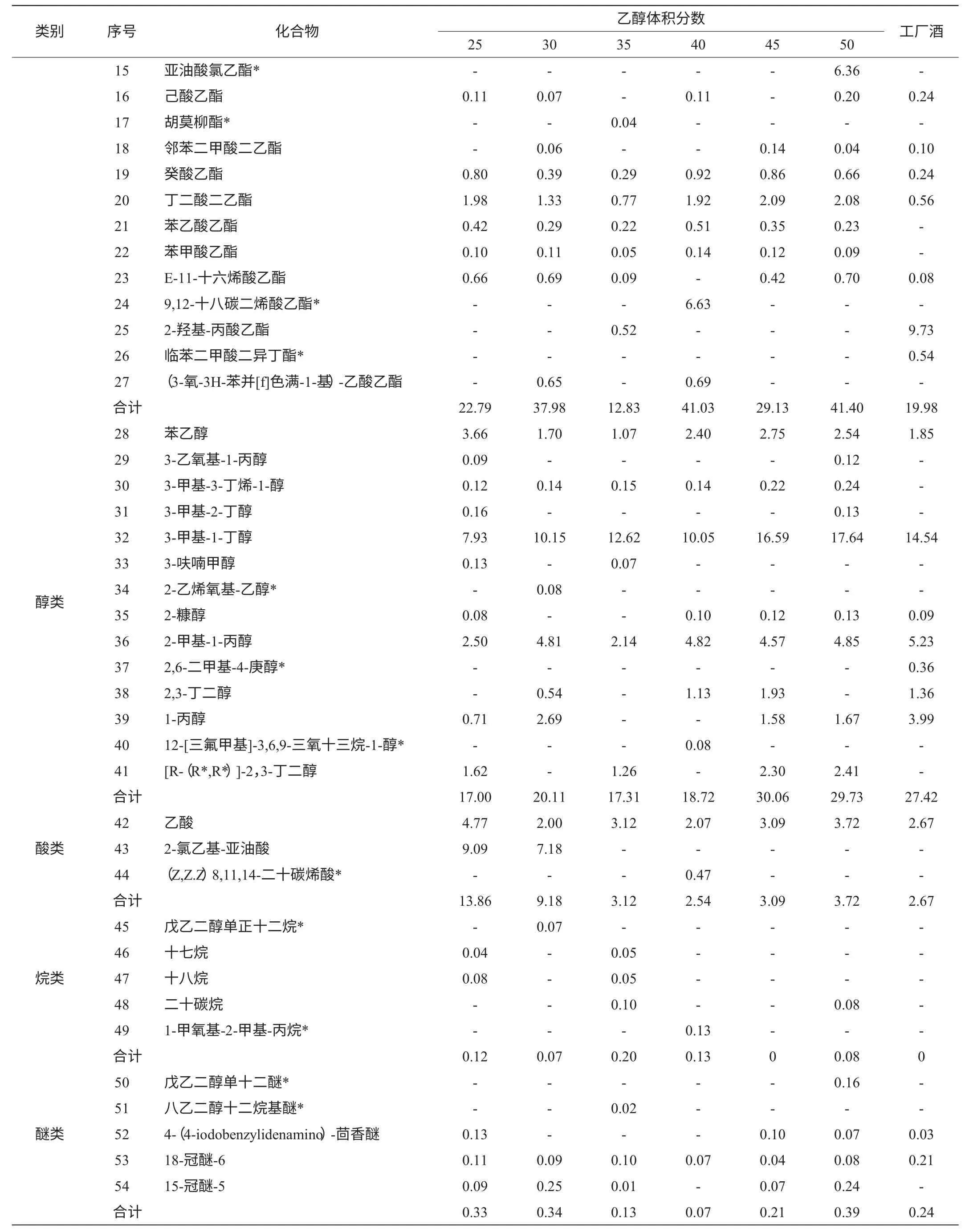
续表%
续表%
黄酒中挥发性香气成分很多,主要有酯、醇、烷、醚等化合物,是黄酒香气的主体[10]。香气特征对黄酒整体品质有重要的影响[11],从表1可以看出,实验室条件下所酿黄酒中总共检测到66种香气成分,添加不同乙醇含量的食用酒精所酿的黄酒中分别测得37、30、36、32、33、37种香气成分。酯类物质总共有26种,缺乏工厂酿造黄酒的临苯二甲酸二异丁酯;醇类物质有14种,缺乏工厂酿酒中的2,6-二甲基-4-庚醇;醛、醚、烷、酮类物质都有5种;杂环类、烯类物质各有2种,1,4,8-十三烯为添加乙醇25%vol食用酒精所酿的黄酒所特有,1,3,3-三甲氧基-1-丙烯为40%vol的黄酒所特有;推测乙醇含量可能对烯类物质的生成有比较大的影响。而杂环类的2-乙基-2,3-二羟-1H-茚为工厂酒所特有。
酒样挥发性成分中,含量最高的酯类成分是十六烷酸乙酯,其次是油酸乙酯,但在添加乙醇25%vol食用酒精所酿黄酒中并未检测到十六烷酸乙酯,却检测到了较高含量的油酸乙酯,推测30%vol左右的乙醇含量对2种酯的形成有密切的联系。而含量最高的醇是3-甲基-1-丁醇。
2.2 乙醇含量对黄酒主要香气成分的影响
前发酵添加食用酒精是广东黄酒酿造工艺的一个重要环节,而添加食用酒精的乙醇含量对黄酒的香气成分是否有影响目前并没有过类似研究。
从表1可以看出,添加50%vol食用酒精所酿的黄酒所含香气成分比重最高,达到了80.28%;而35%vol的香气成分最少,为39.09%,挥发性成分大部分都是乙醇。分析原因可能是较高水环境或较高酒精环境都利于各种挥发性成分的转化生成,而中间环境,因为水与酒精之间的制约,使得挥发性香气成分生成量相对较少。
酯、醇类物质在黄酒香气成分中所占比例较多,实验室自酿黄酒的酯类物质总个数相差不大,但除了7种是共有酯外,各酒精度酿酒都有特有酯,酯类的相对含量从高到低为50%vol(41.40%)、40%vol(41.03%)、30%vol(37.98%)、45%vol(29.13%)、25%vol(22.79%)、35%vol(12.83%),呈锯齿状变化;乙酯类物质种类最多,黄酒中乙酯类化合物主要是在发酵和陈酿过程中酸性化合物和乙醇的酯化反应产生的[12],也可来源于微生物的醇酰基转移酶和醇的缩合反应[13]。各乙醇含量所酿酒测得16种醇类物质中有彼此间有4种相同成分。酯类物质与工厂酒对比,除了添加35%vol食用酒精所酿黄酒含酯类较低,其他均高于工厂酒,推测可能由于环境温度的影响。而醇类物质随酒精度的增加整体呈上升趋势,说明乙醇对醇类物质的形成有一定影响。
表1显示醛类、醚类、酮类物质相对含量较少,但如同王培璇等[14]所述,对黄酒整体风味也有影响。30%vol的样品中并没有检测到酮类,有可能是生成的挥发性酮类物质转化成其他物质,使得低于检测限。而醛类物质与工厂酒相比明显量少。随添加乙醇浓度的不同醛、醚、酮类物质,呈无规则的变化,若需确定其中的规律,需要进一步定量检测。
2.3 特有挥发性香气成分分析
从表1可以看出,添加25%vol食用酒精的样品中有2种特有成分,为1,4,8-十三烯和十九酸乙酯;30%vol的样品中有3种特有成分,分别为辛乙烯二醇单正十二烷基酯,2-乙烯氧基-乙醇和戊乙二醇单正十二烷;35%vol的样品中有5种特有物质,为6,10-二甲基-5,9-十一烷二烯醛-2-酮,八乙二醇十二烷基醚,苯乙醛,胡莫柳,十六酸甲酯,十三酸乙酯,其中有三种酯;40%vol的样品中特有成分达到了最高,为7种,(Z,Z.Z)8,11,14-二十碳烯酸,1,3,3-三甲氧基-1-丙烯,12-[三氟甲基]-3,6,9-三氧十三烷-1-醇,5,10-二羟-5-[3-甲氨基]丙基-11H-苯并[b,e][1,4]二氮杂卓-11酮,1-甲氧基-2-甲基-丙烷,9,12-十八碳二烯酸乙酯,壬酸乙酯,并无醛、醚、杂环类物质;50%vol的样品中有2种特有成分,为亚油酸氯乙酯和戊乙二醇单十二醚;45%vol的样品中没有检测到特有成分。不同乙醇含量的食用酒精所酿黄酒基本都有特有成分,说明乙醇含量对黄酒挥发性成分有较大的影响,但其具体风味也与香气成分的含量与比例有关[15]。
3 结论
黄酒挥发性成分是黄酒的风味特征的关键因素之一,在黄酒的风格和质量方面起着重要作用。本实验结果显示除了添加乙醇含量45%vol食用酒精所酿的黄酒,其余的都检测到了独特的挥发性成分。添加50%vol食用酒精的黄酒所含香气成分比重最高,而35%vol的香气成分比重最少。酯类、醇类成分含量最高、比重最大。测得的烯类物质种类较少,但检测的每个烯都是不同酒精度酿黄酒的特有成分,推测乙醇含量可能对烯类物质的生成有比较大的影响,如要确认需要进一步定量测定。
添加不同乙醇含量的食用酒精对黄酒香气成分的种类有着一定的影响,占风味成分比较大的酯类、醇类物质与工厂黄酒比有约一半的相同成分,不同成分推断是受添加乙醇含量的影响。
广东黄酒中添加食用酒精中乙醇的不同含量影响了黄酒的风味特征,以此可对工业生产黄酒作出指导,按照人们需求的不同,生产出不同风味、不同品质的广东黄酒。
[1]沈 棚,黄敏欣,白卫东,等.客家娘酒中氨基甲酸乙酯回归分析[J].中国酿造,2013,32(5):153-156.
[2]白卫东,赵文红,冯爱军,等.广东客家娘酒风味物质在发酵过程中的变化研究[J].中国食品学报,2013(4):241-244.
[3]朱 豪.广东客家黄酒中γ-氨基丁酸的研究[D].广州:仲恺农业工程学院硕士论文,2014.
[4]黄敏欣,赵文红,朱 豪,等.广东客家黄酒酒曲中微生物的初步鉴定及其产γ-氨基丁酸能力的研究[J/OL].现代食品科技,2015(8).
[5]方晓弟.广东客家娘酒中低聚糖的研究[D].广州:仲恺农业工程学院硕士论文,2013.
[6]白卫东,韩 珍,赵文红,等.客家黄酒中多酚类物质的研究[J].中国食品学报,2013,13(8):261-267.
[7]韩 珍,冯爱军,赵文红,等.黄酒中多酚类物质检测方法研究进展[J].中国酿造,2011,30(8):5-8.
[8]冯爱军.广东客家娘酒中风味物质研究[D].福州:福建农林大学硕士论文,2011.
[9]韩 笑,毛 健,黄桂东.微量通气处理对黄酒陈化过程中风味物质和游离氨基酸的影响[J].食品科学,2014,34(3):123-127.
[10]汪建国.黄酒中色、香、味体的构成和来源分析[J].中国酿造,2004,23(4):16-18.
[11]寿虹志,凌志勇,杨 旭,等.浅析黄酒麦曲中的微生物与黄酒风味的关系[J].中国酿造,2007,26(8):55-57,67.
[12]LILY M,BAUER FF,STYGER G,et al.The effect of increased branched-chain amino acid transaminase activity in yeast on the production of higher alcohols and on the flavour profiles of wine and distillates[J].FEMS Yeast Re s,2006,6(5):641-659.
[13]DELFINI C,GAIA P,BARDI L,et al.Production of benzaldehyde,benzyl alcohol and benzoic acid by yeasts andBotrytis cinereaisolated from grape musts and wines[J].Vitis,1991,30:253-263.
[14]王培璇,毛 健,李晓钟,等.不同地区黄酒挥发性物质差异性分析[J].食品科学,2014,34(6):83-89.
[15]陈佳楠,陈 双,徐 岩.不同酿酒酵母(Saccharomyces cerevisae)对黄酒挥发性香气物质的影响[J].工业微生物,2013(1):30-35.

