金欣口服液对RSV感染BALB/c小鼠RIG-I信号传导通路的影响*
陈争光,汪受传,魏肖云,徐建亚
(南京中医药大学中医儿科研究所,南京 210029)
金欣口服液对RSV感染BALB/c小鼠RIG-I信号传导通路的影响*
陈争光,汪受传△,魏肖云,徐建亚
(南京中医药大学中医儿科研究所,南京 210029)
目的:研究金欣口服液对呼吸道合胞病毒(RSV)感染的BALB/c小鼠肺组织中RIG-I信号传导通路的影响,探讨其可能的抗病毒机制。方法:RSV滴鼻感染BALB/c小鼠,不同剂量金欣口服液灌胃给药进行干预,于首次滴鼻后24 h、72 h、144 h取各组小鼠肺组织,Real time RT-PCR分别检测RSV-M、RIG-I、IPS-I和IFN-β在mRNA水平的表达情况,Western Blot检测RIG-I和IPS-I在蛋白水平上的表达情况。结果:RSV感染24 h和72 h后,其肺组织中RIG-I、IPS-I和IFN-β的表达均较正常组显著升高,金欣口服液不同剂量组RIG-I、IPS-I和IFN-β表达较RSV组明显下调;144 h后,RIG-I、IPS-I和IFN-β表达量显著下调,金欣口服液不同剂量组能上调RIG-I、IPS-I和IFN-β的低表达。结论:RSV能诱导RIG-1信号传导通路的激活从而促进IFN-β的表达,而金欣口服液能通过调控RIG-1信号通路从而调节IFN-β的表达。
金欣口服液;呼吸道合胞病毒;RIG-I;IFN-β
呼吸道合胞病毒(respiratory syncytial virus,RSV)属于副黏液病毒科肺炎病毒属,具有包膜非片段性的单股负链RNA病毒。RSV是引起婴幼儿和老年人下呼吸道感染的主要病原,也是婴幼儿住院的首要原因,临床上主要表现为毛细支气管炎和支气管肺炎,并与哮喘密切相关[1-3]。
维甲酸诱导基因 I(Retinoic Acid-Inducible Gene I,RIG-I)是目前可以识别细胞质内病毒双链RNA的模式识别受体之一[4],是机体识别病毒抗原产生抗病毒反应的第一道防线,在抗病毒感染中发挥了重要的作用[5]。目前研究发现,RIG-I信号通路与RSV感染关系极为密切[6-7]。
金欣口服液是南京中医药大学汪受传教授根据《伤寒论》“麻杏石甘汤”加减而成,通过长期临床研究证实,该方治疗RSV肺炎具有显著疗效[8]。本课题组前期实验研究也表明,该方能多途径发挥抗病毒作用[9-12]。
本实验从金欣口服液对RIG-I信号通路相关接头蛋白调控入手,进一步阐释金欣口服液的抗病毒机制。
1 材料与方法
1.1 动物与病毒
BALB/c小鼠(雌性,6~8周龄,体质量18~22 g,SPF级)75只,扬州医学院比较实验研究中心提供(许可证号SCXK(苏)2012-0004),RSV A型Long株由武汉大学国家典型培养物保藏中心提供。
1.2 药物与试剂
利巴韦林颗粒50 mg/包,四川百利药业有限责任公司(批号080335)。金欣口服液由炙麻黄、虎杖、苦杏仁、桑白皮、生石膏、前胡、黄芩、葶苈子组成,经江苏省植物药深加工工程中心制备和质控,含生药1.351 g/ml。RNA iso plus试剂盒、逆转录试剂盒、实时荧光定量PCR试剂盒:TAKARA大连宝生物公司;兔抗RIG-1多克隆抗体、兔抗IPS-1多克隆抗体:美国CST公司;抗β-actin抗体、羊抗兔荧光二抗:美国Abcam公司;引物由上海生工生物技术有限公司合成。
1.3 仪器
实时荧光定量PCR仪,ABI7500荧光定量PCR仪:美国AB公司;蛋白核酸分析仪:BioPhotometer,德国Eppendorf公司;imageQuant LAS4000 mini超灵敏化学发光成像仪:美国GE公司。
1.4 实验分组及干预方法
1.4.1 模型制备和分组 根据文献报道[13]制作RSV肺炎的动物模型:取乙醚10 ml倒入垫有脱脂棉的广口瓶中,将小鼠放入广口瓶30~60 s,观察小鼠无明显活动时将其快速取出,吸取100TCID50的RSV悬液鼻腔滴注,每侧鼻腔25 μL,每日1次;正常组采用同种方法给予等量的DMEM培养基。每日给予小鼠称重、测体温,观察小鼠进食、活动和精神状况。造模成功标志为RSV滴鼻后24 h即出现体温增高、进食减少、活动减少、精神萎靡等。
实验分为A组(24 h)、B组(72 h)和C组(144 h)各25只。A组、B组和C组分别在RSV首次滴鼻后24 h、72 h、144 h处死取肺组织。每大组分为5小组,每小组5只,包括正常组、模型组、利巴韦林组、金欣高剂量组和金欣等效剂量组。实验检测时每小组随机选取3个样本用来检测。
1.4.2 干预方法 A组:提前给药2 d,末次给药2 h后RSV滴鼻;B组:RSV滴鼻2 d,每次滴鼻后2 h给予相应药物,共给药3d;C组:RSV滴鼻2 d,每次滴鼻后2 h给予相应药物,共给药5 d。
据参照文献报道[14]换算小鼠给药剂量,金欣等效剂量组为27.6 g/(kg·d)(相当于2岁儿童临床等效剂量);金欣高剂量组为138 g/kg·d(相当于2岁儿童临床等效剂量5倍);利巴韦林组为27.6 mg/kg·d(相当于2岁儿童临床等效剂量),每只小鼠每天灌胃给药2次,每次0.2 mL/10 g,根据给药量制备相应浓度的药物,正常组和模型组给予同体积的生理盐水。
1.5 Real-time RT-PCR法
将肺组织放入液氮预冷的研钵内研末,按照肺组织100 mg加入RNA iso plus lmL,并按照试剂盒说明书提取总RNA,蛋白核酸分析仪对RNA进行质量分析,按照RT-PCR试剂盒说明书将总RNA反转录成cDNA,SYBR GreenⅡ实时荧光定量PCR法检测肺组织中RSV-M、RIG-I、IPS-I和IFN-β mRNA的转录水平。表1显示,实时荧光定量PCR反应条件(采用两步法):95℃预变性15 s,95℃变性5 s,60℃退火34 s,设置40个循环,同时做熔解曲线。以上实验独立重复3次。
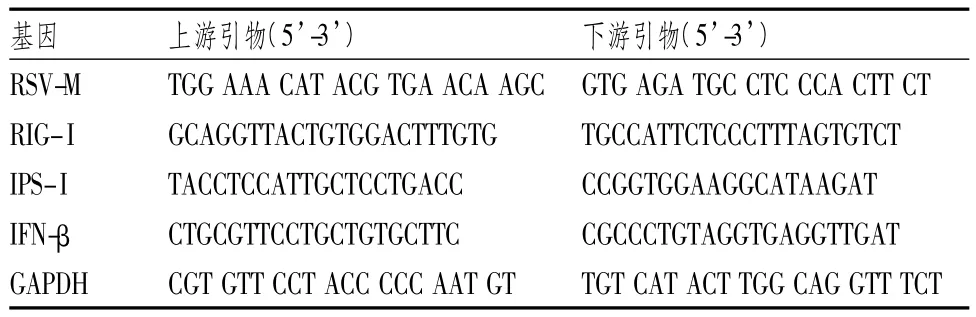
表1 RSV病毒M基因和小鼠RIG-I、IPS-I、IFN-β、GAPDH基因引物
1.6 Western-blot法
将肺组织放入液氮预冷的研钵内研末,按肺组织每100 mg加入500 μL RIPA+5 μL PMSF,冰浴中超声匀浆至澄清,4℃15000 rpm离心30 min,取上清即为总蛋白,使用BCA法蛋白定量试剂盒测定总蛋白浓度。根据总蛋白浓度,加入相应体积的上样缓冲液,97℃变性5 min。SDS-PAGE凝胶电泳(80 V30 min,100 V 1 h);半干转膜(25 V 30 min);洗膜,5%脱脂奶粉封闭2 h;洗膜,1∶1000一抗孵育,4℃过夜;洗膜,1∶5000二抗孵育,室温,2 h;洗膜,ECL Western Blotting Substrate显色;imageQuant LAS4000 mini超灵敏化学发光成像仪成像。
1.7 统计学方法
Real timeRT-PCR实验数据采用2-ΔΔCt方法[15]进行计算,ΔΔCt=(Ct样本-Ct内参)实验组-(Ct样本-Ct内参)对照组。Western blot实验结果采用Image-Pro Plus软件进行光密度计算。采用 SPSS 17.0统计软件统计分析,结果以均数±标准差(珋x± s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 金欣口服液对RSV感染BALB/c小鼠肺组织内RSV-M mRNA的影响
表2显示,RSV感染后24 h,利巴韦林和不同剂量金欣口服液均能抑制RSV-M mRNA的表达(P<0.01);金欣口服液高剂量对RSV-M mRNA表达抑制作用低于利巴韦林组(P<0.01);金欣口服液等效剂量组与利巴韦林组比较差异无统计学意义(P>0.05)。
72 h和144 h后,利巴韦林和不同剂量金欣口服液均可显著抑制 RSV-M mRNA的表达(P<0.01),但利巴韦林组的抑制作用显著高于金欣口服液不同剂量组(P<0.01)。
表2 金欣口服液对RSV感染BALB/c小鼠肺组织内RSV-M mRNA的影响(±s)

表2 金欣口服液对RSV感染BALB/c小鼠肺组织内RSV-M mRNA的影响(±s)
注:与模型组比较:△△P<0.01;与利巴韦林组比较:▲▲P<0.01
组)别RSV-M mRNA相对表达量(2-ΔΔCt24 h 72 h 144 h正 常 组 — — —模 型 组 1.00±0.00 1.00±0.00 1.00±0.00利 巴 韦 林 组 0.72±0.03△△ 0.16±0.01△△ 0.83±0.04△△金欣高剂量组 0.89±0.04△△▲▲0.45±0.01△△▲▲ 0.48±0.05△△▲▲金欣等效剂量组 0.74±0.01△△ 0.26±0.01△△▲▲ 0.55±0.04△△▲▲
2.2 金欣口服液对RSV感染的BALB/c小鼠肺组织内RIG-I mRNA和IPS-I mRNA表达的影响
表3显示,RSV感染后24 h和72 h,RIG-I mRNA表达均升高(P<0.01)。利巴韦林和不同剂量金欣口服液对RIG-I mRNA高表达均有明显下调作用(P<0.01,P<0.05),但金欣口服液高剂量组的下调作用均低于利巴韦林组(P<0.01)。在感染后24 h,金欣口服液等效剂量组的下调作用高于利巴韦林组(P<0.01),但在感染后72 h,金欣口服液等效剂量组与利巴韦林组比较差异无统计学意义(P>0.05)。
144 h后,RIG-I mRNA表达显著降低(P<0.01);利巴韦林能下调RIG-I mRNA的低表达(P<0.05),金欣口服液高剂量组与RSV组比较差异无统计学意义(P>0.05),但金欣口服液等效剂量组能上调RIG-I mRNA的低表达(P<0.01)。
表3 金欣口服液对RSV感染BALB/c小鼠肺组织内RIG-I mRNA的影响(±s)
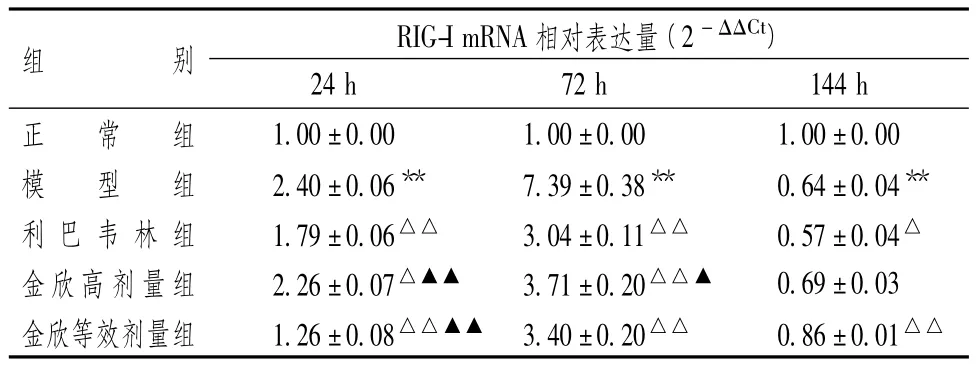
表3 金欣口服液对RSV感染BALB/c小鼠肺组织内RIG-I mRNA的影响(±s)
注:与正常组比较:**P<0.01;与模型组比较:△P<0.05,△△P<0.01;与利巴韦林组比较:▲P<0.05,▲▲P<0.01
组RIG-I mRNA相对表达量(2-ΔΔCt) 24 h 72 h 144 h正 常 组别1.00±0.00 1.00±0.00 1.00±0.00模 型 组 2.40±0.06** 7.39±0.38** 0.64±0.04**利 巴 韦 林 组 1.79±0.06△△ 3.04±0.11△△ 0.57±0.04△金欣高剂量组 2.26±0.07△▲▲ 3.71±0.20△△▲ 0.69±0.03金欣等效剂量组 1.26±0.08△△▲▲ 3.40±0.20△△ 0.86±0.01△△
表4 金欣口服液对RSV感染BALB/c小鼠肺组织内IPS-I mRNA的影响(±s)

表4 金欣口服液对RSV感染BALB/c小鼠肺组织内IPS-I mRNA的影响(±s)
注:与正常组比较:**P<0.01;与模型组比较:△△P<0.01
组IPS-I mRNA相对表达量(2-ΔΔCt) 24 h 72 h 144 h正 常 组别1.00±0.00 1.00±0.00 1.00±0.00模 型 组 2.25±0.17** 2.14±0.08** 0.68±0.05**利 巴 韦 林 组 1.56±0.14△△ 1.06±0.05△△ 0.73±0.07金欣高剂量组 1.40±0.06△△ 1.10±0.06△△ 0.98±0.07△△金欣等效剂量组 1.53±0.06△△ 0.95±0.09△△ 1.18±0.02△△
表4显示,RSV感染后 24 h和 72 h,IPS-I mRNA表达均升高(P<0.01)。利巴韦林和不同剂量金欣口服液对IPS-I mRNA高表达均有明显下调作用(P<0.01),但利巴韦林和不同剂量金欣口服液对IPS-1 mRNA的调控作用之间比较差异无统计学意义(P>0.05)。
144 h后,IPS-I mRNA表达显著降低(P<0.01);利巴韦林对IPS-I mRNA的低表达无明显调控作用(P>0.05),但金欣口服液不同剂量组均能上调RIG-I mRNA的低表达(P<0.01)。
2.3 金欣口服液对RSV感染的BALB/c小鼠肺组织内RIG-I蛋白和IPS-I蛋白表达的影响
图1表5显示,RSV感染后24 h,RIG-I蛋白表达量上调(P<0.01)。利巴韦林组对RIG-I蛋白高表达具有显著上调作用(P<0.01);金欣等效剂量组对其高表达有显著下调作用(P<0.01);但金欣口服液高剂量组与模型组比较差异无统计学意义(P>0.05)。

图1 金欣口服液对RSV感染BALB/c小鼠肺组织RIG-I和IPS-I蛋白表达影响的显影图
表5 金欣口服液对RSV感染BALB/c小鼠肺组织内RIG-I蛋白表达的影响(±s)
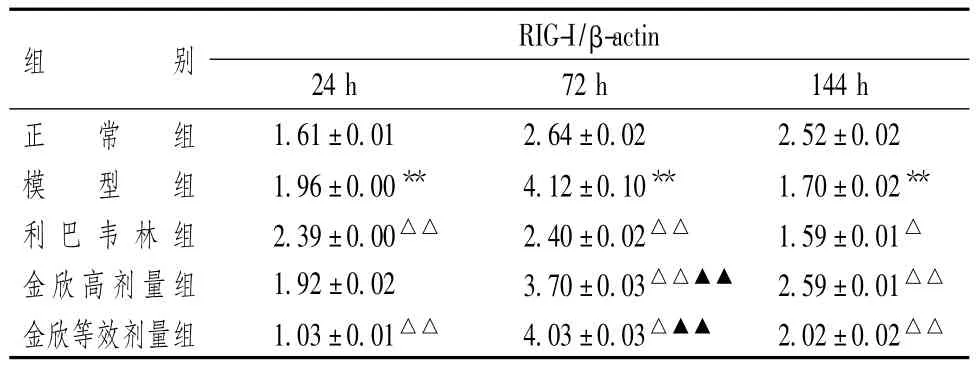
表5 金欣口服液对RSV感染BALB/c小鼠肺组织内RIG-I蛋白表达的影响(±s)
注:与正常组比较:**P<0.01;与模型组比较:△P<0.05,△△P<0.01;与利巴韦林组比较:▲▲P<0.01
组RIG-I/β-actin 24 h 72 h 144 h正 常 组别1.61±0.01 2.64±0.02 2.52±0.02模 型 组 1.96±0.00** 4.12±0.10** 1.70±0.02**利 巴 韦 林 组 2.39±0.00△△ 2.40±0.02△△ 1.59±0.01△金欣高剂量组 1.92±0.02 3.70±0.03△△▲▲ 2.59±0.01△△金欣等效剂量组 1.03±0.01△△ 4.03±0.03△▲▲ 2.02±0.02△△
72 h后,RIG-I蛋白表达量明显上调(P<0.01)。利巴韦林组(P<0.01)、金欣口服液高剂量(P<0.01)和等效剂量组(P<0.05)对其高表达均有显著下调作用。利巴韦林的下调作用高于金欣口服液不同剂量组(P<0.01)。
144 h后,RIG-I蛋白表达量显著下调(P<0.01)。利巴韦林组对其低表达具有下调作用(P<0.05),但金欣口服液不同剂量组对其低表达具有上调作用(P <0.01)。
表6 金欣口服液对RSV感染BALB/c小鼠肺组织内IPS-I蛋白表达的影响(±s)

表6 金欣口服液对RSV感染BALB/c小鼠肺组织内IPS-I蛋白表达的影响(±s)
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:△P<0.05,△△P<0.01;与利巴韦林组比较:▲▲P<0.01
组IPS-I/β-actin 24 h 72 h 144 h正 常 组别0.52±0.02 1.24±0.01 1.45±0.02模 型 组 1.06±0.01** 1.38±0.03* 0.54±0.01**利 巴 韦 林 组 1.13±0.00△ 0.91±0.01△△ 0.28±0.00△△金欣高剂量组 0.68±0.00△△ 0.53±0.01△△▲▲ 0.68±0.00△△金欣等效剂量组 0.33±0.00△△ 0.68±0.01△△▲▲ 0.39±0.01△△
图1表6显示,RSV感染后24 h,IPS-I蛋白表达量上调(P<0.01)。利巴韦林组对其高表达具有上调作用(P<0.05);金欣口服液不同剂量组对其高表达均有显著下调作用(P<0.01)。
72 h后,IPS-I蛋白表达量上调(P<0.05)。利巴韦林组和不同剂量金欣口服液对其高表达均有显著下调作用(P<0.01),金欣口服液不同剂量组的下调作用均高于利巴韦林组(P<0.01)。
144 h后,IPS-I蛋白表达量显著下调(P<0.01)。利巴韦林和金欣口服液等效剂量组对其低表达具有下调作用(P<0.01)。金欣口服液高剂量组对其低表达具有显著上调作用(P<0.01)。
2.4 金欣口服液对RSV感染BALB/c小鼠肺组织内IFN-βmRNA的影响
表7 金欣口服液对RSV感染BALB/c小鼠肺组织内IFN-β m RNA的影响(±s)

表7 金欣口服液对RSV感染BALB/c小鼠肺组织内IFN-β m RNA的影响(±s)
注:与正常组比较:**P<0.01;与模型组比较:△△P<0.01;与利巴韦林组比较:▲▲P<0.01
组IFN-β mRNA相对表达量(2-ΔΔCt) 24 h 72 h 144 h正 常 组别1.00±0.00 1.00±0.00 1.00±0.00模 型 组 84.81±0.92** 1.57±0.12** 0.17±0.01**利 巴 韦 林 组 35.18±0.73△△ 0.26±0.02△△ 0.22±0.01金欣高剂量组 58.42±0.40△△▲▲ 1.01±0.10△△▲▲ 0.45±0.04△△金欣等效剂量组 24.93±0.67△△▲▲ 1.44±0.08 0.52±0.06△△
表7显示,RSV感染后24 h,IFN-β mRNA表达显著升高(P<0.01)。利巴韦林和不同剂量金欣口服液对其高表达有明显下调作用(P<0.01);利巴韦林的下调作用高于金欣口服液高剂量(P<0.01),但低于等效剂量组(P<0.01)。
72 h后,IFN-β mRNA表达显著升高(P<0.01)。利巴韦林和金欣口服液高剂量对其高表达有明显下调作用(P<0.01);利巴韦林的下调作用高于金欣口服液不同剂量组(P<0.01);金欣口服液等效剂量对其高表达无明显下调作用(P>0.05)。
144 h后,IFN-β mRNA表达显著降低(P<0.01)。利巴韦林组与模型组之间比较差异无统计学意义(P>0.05);金欣口服液不同剂量对其低表达有明显的上调作用(P<0.01)。
3 讨论
RIG-I是含DExD/H盒的RNA解旋酶家族的成员之一,能够识别病毒RNA[16]。当病毒RNA入侵宿主细胞后,RIG-I与病毒结合后,其构象发生变化,RIG-I被激活;RIG-I通过与IPS-I的相互作用,IPS-I被激活[17-18]。激活的IPS-I通过复杂的信号传导从而促使IRF-3、IRF-7磷酸化,启动Ⅰ型干扰素的表达。RSV感染后,机体经RIG-I介导引起免疫细胞表达的炎症因子、细胞因子,从而发挥抗病毒作用[19]。
该研究表明,通过测定RSV-M mRNA的表达情况,证实RSV感染的小鼠模型造模成功,并测定不同时间点RSV-M mRNA表达情况,证实金欣口服液具有抗病毒作用。RSV感染BALB/c小鼠后,其肺组织中RIG-I和IPS-I的表达均显著上调,但随着时间推移,其表达水平逐渐下降,呈现出先增高后降低的表达趋势。RSV感染BALB/c小鼠后,其肺组织中IFN-βmRNA的表达随着时间推移呈先增高后降低的趋势,144 h后下降至正常水平以下。通过以上研究表明,RSV感染初期,病毒激活RIG-I信号通路导致IFN-β的高表达,金欣口服液能抑制RIG-I通路的过度激活,防止因IFN-β等细胞因子引起的炎症损伤。在RSV感染后期,RIG-I信号通路表达呈现下调的趋势,但金欣口服液可以维持RIG-I信号通路的持续表达,从而使IFN-β的表达维持在一定范围内,既能发挥有效的抗病毒作用,又可以防止炎症因子的过度表达引起的炎症损伤。
综上所述,RSV感染可以诱导小鼠RIG-I信号通路的激活,而金欣口服液对激活的RIG-I信号通路具有调控作用,从而调节干扰素表达以发挥抗病毒效应。
[1]GHILDYAL R,H.A.,JANS DA.Central role of the respiratory syncytial virus matrix protein in infection[J].FEMS Microbiol Rev,2006,30(5):692-705.
[2]Nair H,Nokes DJ,Gessner BD,et al.Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children:a systematic review and meta-analysis[J].Lancet,2010,375:1545-1555.
[3]Hansbro NG,Horvat JC,Wark PA,et al.Understanding the mechanisms of viral induced asthma:New therapeutic direction[J].Pharmacol Ther,2008,117(3):313-353.
[4]Hornung V,Ellegast J,Kim S,et al.5-Triphosphate RNA is the ligand for RIG-I[J].Science,2006,314(5801):994-997.
[5]Hongbo Chi,Richard A Flavell.Innate recognition of non-self nucleic acids[J].Genome Biology,2008,9:211.
[6]Ping Liu,Mohammad Jamaluddin,Kui Li,et al.Retinoic Acid-Inducible GeneⅠ Mediates Early Antiviral Response and Toll-Like Receptor 3 Expression in Respiratory Syncytial Virus-Infected Airway Epithelial Cells[J].Journal of Virology,2007,81 (3):1401-1411.
[7]Carolina Scagnolari,Fabio Midulla,Alessandra Pierangeli,et al.Gene Expression of Nucleic Acid-Sensing Pattern Recognition Receptors in Children Hospitalized for Respiratory Syncytail Virus-Associated Acute Bronchiolitis[J].Clinical and Vaccine Immunology,2009,16(6):816-823.
[8]汪受传,韩新民,任现志,等.小儿病毒性肺炎痰热闭肺证治疗方法研究[J].南京中医药大学学报,2004,20(2):72-75.
[9]廖辉,汪受传,徐建亚,等.金欣口服液含药血清对呼吸道合胞病毒黏附,膜融合影响的实验研究[J].实用中西医结合临床,2008,8(1):3-4.
[10]陈彩霞,汪受传.金欣口服液对呼吸道合胞病毒感染人胚肺成纤维细胞胞内钙离子的影响[J].江西中医学院学报,2009,21(2):52-54.
[11]赵霞,汪受传,胡钰,等.金欣口服液含药血清对呼吸道合胞病毒感染细胞早期凋亡的影响[J].中华中医药杂志,2010,25(2):225-227.
[12]赵霞,汪受传,张沛,等.金欣口服液对呼吸道合胞病毒感染大鼠Ⅰ型干扰素表达的影响[J].中华中医药杂志,2011,26 (7):1508-1510.
[13]Barney S.Graham,Mark D.Perkins,Peter F.W right,et al.Primary Respiratory Syncytial Virus Infection in Mice[J].Journal of Medical Virology,1988,26:153-162.
[14]陈奇.中药药理学研究方法学[M].北京:人民卫生出版社,2006:33.
[15]Schm ittgen TD,Zakrjsek BA,Mills AG,et al.Quantitative reverse transcription ploymerase chain reaction to shtdv mRNA decav:comparison of endpoint and real time methods[J].Anal Biochem,2000,285(2):194.
[16]Vilaysanea A,Muruve D A.The innate immune response to DNA[J].Semin Immunol,2009,21(4):208-214.
[17]Kumar H,Kawai T,Kato H,et al.Essential role of IPS-1 in innate immune responses against RNA viruses[J].J Exp Med,2006,203(7):1795-1803.
[18]Wooff J,Pastushok L,Hanna M,et al.The TRAF6 RING finger domain mediates physical interaction with Ubc13[J].FEBS Lett,2004,566(13):229-233.
[19]Dejardin E,Droin N M,Delhase M,et al.The lymphotoxin-beta receptor induces different patterns of gene expression via two NF-kappaB pathways[J].Immunity,2002,17(4):525-535.
Effect of Jinxin Oral Liquid on RIG-I Signal Transduction Pathway in BALB/c Mice Infected with RSV
CHEN Zheng-guang,WANG Shou-chuan△,WEI Xiao-yun,XU Jian-ya
(Pediatric Institution of Nanjing University of Chinese Medicine,Nanjing 210029,China)
Objective:To study the effect of Jinxin Oral Liquid(JOL)on Retinoic Acid-Inducible Gene I(RIG-I) signaling transduction pathway in BALB/c mice infected by respiratory syncytial virus(RSV),and to explore its antiviral mechanism.Method:BALB/c Mice were infected with RSV,and were administered with the different dosage of JOL.After 24,72 and 144 hours of the first inoculated with RSV,the mice were killed and the lung tissue was collected to detect the mRNA level of RSV-M,RIG-I,IPS-I,and IFN-β with Real time RT-PCR and to measure the level of the protein of RIG-I and IPS-I by Western blot.Result:After 24 and 72 hours of RSV infection,the expression of RIG-I,IPS-I and IFN-β in the model group all increased significantly compared with the normal group,while the expression of RIG-I,IPS-I and IFN-β in JOL group all decreased compared with the model group.However,after 144 hours of RSV infection,the expression of RIG-I,IPS-I and IFN-βin the model group all decreased significantly compared with the normal group.The JOL group all up-regulated the expression of RIG-I,IPS-I and IFN-β compared with the model group.Conclusion:The activation of RIG-I signaling transduction pathway was induced by RSV to promote the expression of IFN-β.JOL can regulate the RIG-I signaling transduction pathway to control the proper expression of IFN-β.
Jinxin Oral Liquid;Respiratory syncytial virus(RSV);Retinoic Acid-Inducible Gene I(RIG-I); Interferon-beta(IFN-β)
R285.5
:B
:1006-3250(2015)07-0819-05
2015-03-24
国家自然科学基金资助项目(81072840)-金欣口服液对RSV活化诱导的TLRs信号传导通路作用机制研究
陈争光(1985-),男,河南渑池人,医学博士,从事小儿肺系疾病的临床与研究。
△通讯作者:汪受传(1946-),男,江苏盐城人,主任医师,医学硕士,教授,博士研究生导师,从事小儿肺系疾病研究。

