冠状动脉旁路移植术体外与非体外循环围术期胃黏膜pH值、SvO2、Lac变化比较
刘超+++秦智刚
[摘要] 目的 探讨冠状动脉旁路移植术(CABG)在体外循环与非体外循环下围术期胃黏膜pH值(PHi)、混合静脉血氧饱和度(SvO2)、血乳酸(Lac)的变化。 方法 选取我院2013年6月~2014年1月60例多支冠状动脉病变患者。按是否进行体外循环(CPB)随机分为OPCAB组和CCABG组,每组30例。观察术前(T1)、术中予鱼精蛋白时(T2)、术后4 h(T3)3个时点PHi、SvO2、Lac变化,并记录两组患者ICU停留时间、气管插管留置时间、呼吸机使用时间、住院时间。 结果 在T2时,OPCAB组的PHi高于CCABG组,SvO2低于CCABG组,差异有统计学意义(P<0.05)。在T3时,OPCAB组的胃黏膜PHi、SvO2高于CCABG组,Lac低于CCABG组,有显著性差异(P<0.05)。OPCAB组患者气管导管留置时间、呼吸机使用时间短于CCABG组。 结论 非体外循环冠状动脉旁路移植术有利于术中胃黏膜和脏器的保护,减少围术期的并发症,减少患者ICU时间、呼吸机使用时间、气管导管留置时间。
[关键词] 冠状动脉旁路移植术;体外循环;胃黏膜内pH值
[中图分类号] R654.1 [文献标识码] A [文章编号] 1673-9701(2015)02-0005-03
胃肠功能障碍容易诱发多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),胃黏膜内pH值(gastric intramucosa pH,PHi)作为研究胃肠功能障碍患者病情变化的主要检测指标,能够敏感反映MODs发生过程中最容易受累的胃肠黏膜缺氧情况,较其他临床指标能更早提示患者病情[1]。本研究探讨冠状动脉旁路移植术在体外循环与非体外循环两种方式中整个围术期PHi的走势和变化规律,旨在为临床手术决策的优化和围术期麻醉处理提供参考。
1资料与方法
1.1 一般资料
选取我院2013年6月~2014年1月60例多支冠状动脉病变患者,均为择期手术。其中男36例,女24例。平均年龄(60.2±5.6)岁,体重(66.3±3.5)kg,均符合以下条件:①术前1个月无心肌梗死、左室射血分数(left ventricular ejection fractions,LVEF)>30%、无室壁瘤、室间隔穿孔等心肌梗死的并发症。②无基础胃肠道疾病和严重肺、肝、肾功能不全。③不包含合并瓣膜手术的病例。患者按是否进行体外循环(cardiopulmonary bypass,CPB)分为体外循环冠状动脉旁路移植术(OPCAB)组和非体外循环冠状动脉旁路移植术(CCABG)组,每组30例。CCABG组患者年龄(58.5±3.5)岁,体重(65.2±5.2)kg,LVEF值(50.2±5.5)%,伴高血压18例,糖尿病15例。OPCAB组患者年龄(60.3±2.5)岁,体重(63.8±4.6)岁,LVEF值(48.2±4.2)%,伴高血压20例,糖尿病18例。两组患者的临床资料无显著差异(P>0.05)。
1.2 手术及麻醉方法
全身麻醉,气管插管,术前有创桡动脉置管测压,放置Swan-Ganz漂浮导管(Edwards,美国)连续血流动力学监测。气管插管后置入TONO胃管(14F,Datex-Ohmeda,芬兰),通过听诊和抽吸胃液法确认胃管的位置,连接空气法胃张力模块连续检测胃内PgCO2。胸骨正中切口获取右侧乳内动脉,①CCABG组: 静脉使用全量肝素 400 U/kg,维持ACT>480 s,经升主动脉和右房插管,建立体外循环,在中低温体外循环下进行,心肌保护采用主动脉根部灌注冷钾停跳液,心肌局部深低温,桥血管与目标血管远端吻合后,开放主动脉,心脏复跳后,主动脉根部上侧壁钳并打孔,作静脉近端与升主动脉的吻合,体外循环时间(90.2±20.1)min。手术完毕后用鱼精蛋白中和肝素,术后按需应用正性肌力药物。②OPCAB 组:经静脉内使用肝素200 U/kg保持 ACT>300 s,术中使用特殊胸骨牵开器和心表固定器,使预作吻合的冠状动脉局部固定,远端吻合完成后,在升主动脉上侧壁钳并打孔,做静脉近端与升主动脉吻合。主动脉阻断时间(45.9±10.5)min。记录上述两组患者术前、术中、术后心率、平均动脉压、中心静脉压、PHi等血流动力学参数和动脉血气情况。
1.3 观察指标
选取术前(T1),术中给鱼精蛋白时(T2),术后4 h(T3)三个时点,分别测定患者的PHi、SvO2、Lac。采集桡动脉血用Gem3000血气分析仪行血气分析,心排仪测定SvO2,采用体外校准,入ICU后禁食禁饮,并常规应用H2阻滞剂或质子泵抑制剂,可排除胃酸和进食对测量PHi的影响。另外随访记录两组患者的ICU停留时间、气管插管留置时间、呼吸机使用时间、住院时间 。
1.4 统计学处理
应用SPSS 19.0统计学软件进行统计分析,计量资料以均数±标准差(x±s)表示,采用重复测量资料的方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
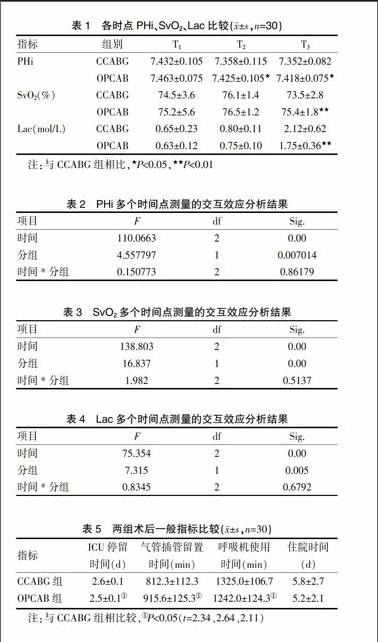
本研究表明在T2时,OPCAB组的胃黏膜PHi高于CCABG组,有显著性差异(P<0.05),SvO2、Lac无显著性差异。在T3时,OPCAB组的胃黏膜PHi,SvO2高于CCABG组,Lac低于CCABG组,有显著性差异(P<0.05)。术后两组患者在住院时间上无统计学意义,OPCAB组患者在气管导管留置时间、呼吸机使用时间要短于CCABG组。见表1~5。
表1 各时点PHi、SvO2、Lac比较(x±s,n=30)
注:与CCABG组相比,★P<0.05,★★P<0.01
表2 PHi多个时间点测量的交互效应分析结果
表3 SvO2多个时间点测量的交互效应分析结果
表4 Lac多个时间点测量的交互效应分析结果
表5 两组术后一般指标比较(x±s,n=30)
注:与CCABG组相比较,①P<0.05(t=2.34、2.64、2.11)
3 讨论
胃肠道是血液灌流减少发生最早、最明显且恢复最迟的脏器。而胃肠道黏膜的逆向微循环特点,使胃肠黏膜在缺血缺氧时更易受损伤。胃肠黏膜血流的减少,引起局部组织氧供的下降,局部以无氧代谢为主,形成局部高碳酸血症[2],PHi是反映胃肠黏膜缺血缺氧最敏感的指标[3,4]。
本研究表明在T2时,OPCAB组的胃黏膜PHi高于CCABG组,有显著性差异(P<0.05),Lac、SvO2无显著性差异。在T3时,OPCAB组的胃黏膜Lac低于CCABG组,SvO2、PHi高于CCABG组,有显著性差异(P<0.05)。
PHi作为一个间接测定局部组织氧合情况的指标在疾病早期全身氧供指标未发生改变前就发生明显的变化,能早期判断患者的预后。其可能机制是胃肠黏膜血管袢极度弯曲呈发夹状,血液易从小动脉经短路直接进入小静脉,黏膜对氧供降低非常敏感,这个特征使胃肠道成为机体应激、血液重新分配后影响最早也是最重器官。胃肠黏膜持续氧合不足,细胞无氧糖酵解和酸中毒导致PHi降低,因此PHi为局部氧合障碍的反映,也是全身氧合障碍的最早表现,SvO2反映机体组织对氧的利用情况,SvO2升高表示组织利用氧发生障碍或氧供增加,降低表示组织利用氧增加或氧供不足,血乳酸是体内无氧酵解的正常产物,其产生的量与氧供和低灌注程度有关。这两个指标相对于PHi而言,Lac、SvO2的改变常明显迟于PHi的改变,在反映组织水平上氧代谢平衡的PHi可作为评定全身性氧代谢平衡指标。多份研究表明,PHi能更早预测心脏手术后循环衰竭的发生及患者的预后[5]。
CPB停机前PHi显著降低,说明在CPB期间存在胃黏膜低灌注导致的缺血缺氧、酸中毒。而且低灌注状态在体外循环恢复后依然存在,其原因可能是因为在恢复循环后,复温代谢率增加CPB期间的氧供,机体氧耗增加,停CPB后,虽然血压和心排血量维持正常,但是氧摄取可能仍然不足,氧供需失衡。在OPCAB期间,尤其是在吻合前降支(LAD)和后降支(PDA)时,由于手术体位和固定器的压迫,患者的心排血量(CO),平均动脉压(MAP)出现下降,二尖瓣、三尖瓣出现反流,氧供减少,SvO2下降,但由于生理性循环自身的调节机制,保证了各重要器官的氧需[6]。本研究亦表明,相对于CCABG组,OPCAB组的ICU停留时间、呼吸机使用时间、气管导管留置时间缩短。与众多研究结果相符。
综上所述,体外循环期间应采取积极的胃黏膜保护措施,包括术前应用奥美拉唑、达喜等[7]。奥美拉唑主要通过NO增加胃黏膜血流量参与这种保护作用[8]。彭惠华等[9]研究表明长托宁可提高CPB期间的胃内pH值,对胃黏膜有一定的保护作用。对于术前有基础胃肠道疾病、多器官功能障碍的患者术前给予胃黏膜保护剂,采用OPCAB的手术方式将更加适合。比较两种术式对患者PHi变化、手术方式的选择、麻醉处理和ICU临床治疗有着重要意义。PHi和血乳酸、SvO2可作为早期预测危重患者预后的独立指标。但PHi是提示内脏灌注较佳的指标,临床应用中应使外科危重患者维持PHi>7.32,Lac<2.3 mmol/L,SvO2>65%[10]。本研究病例为无基础胃肠道疾病、Europe评分系统分值<5分者,至于CPB 期间胃肠黏膜通透性是否改变及如何预防胃肠黏膜缺血缺氧尚待进一步研究。
[参考文献]
[1] Yapici N,Ince C. Gastrointestinal complications and its predictors after cardiac surgery[J]. Turk J Gastroenterol,2010,21(1):3-6.
[2] Marik PE,Vasu T,Hirani A,et al. Stress ulcer prophylaxis in the new millennium: A systematic review andmeta analysis[J]. Crit Care Med,2010,38(11):2222-2228.
[3] 黑飞龙,崔勇丽,龙村. 胃肠激素和胃粘膜PH值在体外循环心脏手术中的变化[J]. 世界华人消化杂志,2009, 17(7):708-711.
[4] Zhang G,Wu N,Liu H,et al. Case control study of gastrointestinal complications after cardiopulmonary bypass heart surgery[J]. Perfusion,2009,24:173-178.
[5] 饶丹,张勤斌,陈绪发. 埃索美拉唑对体外循环心脏手术应激性溃疡保护作用的临床观察[J]. 心肺血管病杂志,2011,30(1):17-19.
[6] 祁行毅,胡强夫,黄维勤. 非体外循环冠状动脉旁路移植术中血流动力学的变化及处理[J]. 心血管康复医学杂志,2010,19(1):265-266.
[7] Kuipers EJ,Sung JJ,Barkun A,et al. Safety and tolerability of high-dose intravenous esomeprazole for prevention of peptic ulcer rebleeding[J]. Adv Ther,2011,28(2):150-159.
[8] Adluri RK,Singh AV,Skoyles J,et al. The effect of fenoldopam and dopexamine on hepatic blood flow and hepatic function following coronary artery bypass grafting with hypothermic cardiopulmonary bypass[J]. Eur J Cardiothorac Surg,2009,35(6):988-994.
[9] 彭惠华,江伟航,程平瑞,等. 盐酸戊乙奎醚对体外循环心脏手术患者胃肠功能的影响[J]. 湖北医药学院学报,2012,31(1):29-31.
[10] Lebuffe G,Robin E,Vallet B. Gastric tonometry[J]. Intensive Care Med,2001,27(1):317-319.
(收稿日期:2014-07-07)
——体外循环质量控制的基石

