植物毛状根的诱导及应用
王成龙,周美亮,邵继荣,吴燕民
(1.中国农业科学院生物技术研究所,北京100081;2.四川农业大学生命科学学院,四川 雅安625001)
发根农杆菌(Agrobacteriu m r hizogenes)是一种根瘤菌科的革兰氏阴性菌。其侵染植物后,会使植物产生大量的不定根,这些不定根不断分支,表现出毛状,称之为毛状根(Hair y Roots)[1],具有生长迅速、生长周期短、无向地性、多分支且根毛生长旺盛的特点。毛状根在培养过程中,不需添加任何外源激素即可大量增殖,且产出的毛状根遗传性稳定,有效成分含量高,生化特性不易改变[2]。基于毛状根自身的特点,若以牧草为受体,利用发根农杆菌对现有牧草品种进行改良,进而可以培育出更加优良的品种,对于牧草新品种的创制以及草业生物技术的发展都有着有极为重要的意义。
1 植物毛状根的诱导
1.1 毛状根的特点
相较于其他植物组织,毛状根主要具备以下几方面的特点:1)毛状根可以在无激素的培养基上正常生长。发根农杆菌含有Ri质粒,其感染植物伤口后,会促使伤口处细胞合成特殊的酚类小分子化合物,进而诱导Ri质粒的Vir 区基因活化。从而将Ri质粒上的T-DNA 区整合到植物基因组中。T-DNA上含有合成激素的相关基因,当其整合到植物的基因组并进行表达后,植物细胞本身的激素代谢平衡被打破,最终使得毛状根可以在无激素的培养基上正常生长;2)毛状根具有极强的遗传稳定性。与根癌农杆菌转化植物所不同的是,利用发根农杆菌侵染植物不会产生嵌合体。通过发根农杆菌诱导产生的毛状根均来源于单一的植物细胞,含有与亲本完全相同的一套染色体,这样就保证了其在遗传方面的稳定性[3];3)毛状根生长迅速且次生代谢产物合成旺盛。植物次生代谢产物的积累与细胞的分化速度密切相关,由于毛状根的数量按指数模式增长,所以毛状根生长速度很快,生物量倍增所需时间较短,故而其次生代谢产物的合成也相当旺盛;4)发根农杆菌诱导毛状根的植物多为双子叶植物,单子叶植物被诱导形成毛状根的报道还为数不多。已成功诱导出毛状根的单子叶植物仍都处于实验室理论研究,实践应用还不广泛,还需要进行深入的研究。但是,通过根瘤农杆菌侵染的单子叶植物已涵盖鸢尾科、禾本科等单子叶植物[4-8]。目前,发根农杆菌已经在玉米(Zea mays)、水稻(Or yza sativa)等单子叶植物上成功诱导出毛状根[9-12]。同时,百脉根(Lotus cor nicul atus)、紫花苜蓿(Medicago sativa)等豆科牧草更是实现了由发根农杆菌介导的遗传转化[13-14]。这些研究成果的取得也从分子水平上证明了单子叶植物可以作为农杆菌侵染的受体,进而可以为发根农杆菌诱导单子叶植物毛状根的产生奠定坚实的理论依据。
1.2 毛状根诱导的机理
1.2.1 发根农杆菌的Ri质粒 发根农杆菌诱导植物产生毛状根的分子机理与之含有的Ri质粒有着密切的关系。Ri质粒主要 由Ori 区Vir区和T-DNA区三部分组成。发根农杆菌诱导植物产生毛状根是一个复杂的过程,是三部分基因共同作用的结果。
Ri质粒Vir 区基因负责接收外界信号,在T-DNA的剪切和转移过程中扮演着极为重要的角色。研究发现,Vir 区位于复制起点和T-DNA 区之间大约20 kb,具有很高的保守性,并与Ti质粒的Vir 区同源。其包含有Vir A、Vir B、Vir C、Vir D、Vir E、Vir F、Vir G 7个基因,起共调控作用[15-16]。
发根农杆菌Ri质粒的T-DNA 区则包含两类基因,分别是为其提供营养来源的冠瘿碱合成基因以及决定致病表型的Rol基因群。根据其冠瘿碱合成基因的不同,可将发根农杆菌的Ri质粒分为4种类型,分别是甘露碱型、黄瓜碱型、农杆碱型以及异黄瓜碱型。其中,农杆碱型菌株由于其较强的诱导能力,使其比其他类型的发根农杆菌有更为广泛的宿主范围,可以用于诱导大多数的植物材料产生毛状根[17-20]。
农杆碱型发根农杆菌的T-DNA 区域是不连续的,分TL-DNA 和TR-DNA 两部分。TL-DNA 上含有与根的形态发生及再生植株某些形态特征有关的Rol基因群,其通过改变激素平衡或改变细胞对生长素及细胞分裂素的敏感性而影响毛状根的发生。在某些情况下,Rol基因的催化效果甚至可以完全调控植物细胞产生大量的次生代谢产物。其中Rol B 最为重要,Rol A 基因产物在植物细胞次生代谢中起刺激作用,Rol C 在植物次生代谢中较为稳定,其主要作用是促进次级代谢通路的激活[21-23]。TR-DNA 上带有农杆碱合成酶基因(Ags)和生长素合成酶基因(t ms-1 和t ms-2),后者指导IAA的合成,负责为植物细胞提供生根所必须的植物激素,因此,诱导产生的毛状根是激素自养型的。
然而,甘露碱型和黄瓜碱性的T-DNA 区域是连续的,与农杆碱型Ri质粒的TR-DNA 没有明显的同源性,但具有与TL-DNA 高度同源的片断。其区域中不含生长素合成相关基因。因此,此类发根农杆菌不能诱导毛状根的形成[24]。
1.2.2 毛状根诱导的分子机制 首先,发根农杆菌附着到植物细胞后,会停留于细胞间隙。之后,农杆菌会促进受伤的植物组织经莽草酸合成途径产生乙酰丁香酮和羟基乙酰丁香酮等可溶性小分子酚类化合物,这些小分子酚类化合物将作为信号分子,促进农杆菌向植物组织的转移[25]。同时,这些信号分子在Vir A 基因产物(一种结合在膜上的受体蛋白)的介导下,使得Vir G 蛋白的磷酸化结构发生改变,进而激活其他Vir 区基因,促使T-DNA 的复制T-链蛋白复合体的形成。而后,T-链蛋白复合体在转运蛋白的协助下通过细胞膜转运,最终进入植物细胞核,将T-DNA 整合进植物的基因组之中,并在植物中转录和表达,使植物在伤口附近生长出毛状根[26]。
2 毛状根的应用
由于毛状根具有生长迅速、遗传稳定以及次生代谢产物合成旺盛等特点。故而,毛状根常被用于作物品种改良,次生代谢物的生产以及环境污染的修复等诸多方面。
2.1 毛状根用于作物品种改良
通过基因工程技术将外源基因导入毛状根,之后利用植物再生的方法获得转基因植株,从而可以实现对作物品种的改良,培育出具有优良性状的作物新品种。利用转基因毛状根实现植物的再生与培养条件密切相关,其可以通过加入适当的植物激素来实现经由体细胞胚胎途径的再生[27-28]。
2.1.1 发根农杆菌介导的遗传转化的方法 目前,借助发根农杆菌将外源基因转移到目标植物体上,主要有以下几种方法:1)直接接种法:直接将已活化好的菌液通过注射的方法接种到植物幼苗的茎尖或茎秆上,在一段时间的培养后,注射处就可以观察到毛状根的产生。根据菌株的种类,寄主的生理状态以及培养条件的不同,诱导出毛状根的时间也不近相同,通常在侵染后的2~4周会观察到毛状根的出现。2)外植体接种法:外植体接种法是目前应用较多的方法,因发根农杆菌诱导毛状根的遗传转化与根癌农杆菌介导的遗传转化机理相似,故而其被多数学者应用到试验之中[29]。外植体接种法主要是利用宿主植物的子叶、下胚轴、幼嫩的茎等部位作为外植体,之后将其浸泡在发根农杆菌菌液中,再经过共培养、抗性筛选等步骤,最后得到脱菌的转基因毛状根[30]。3)原生质体共培养法:原生质体共培养法则是利用无壁或处于壁再生阶段的原生质体对农杆菌的敏感性来达到遗传转化的目的。该法首先通过原生质体与发根农杆菌混合培养,经历抗性筛选,得到转化的植物细胞,之后通过再生植株的培养,进而获得转化的再生植株。但是,此方法只适合于原生质体再生效率较高的植物种类,故与前两者相比,存在一定的局限性。
2.1.2 利用发根农杆菌进行作物品种改良的优势及成果 相对于传统的根癌农杆菌介导法,通过发根农杆菌诱导的毛状根进行作物品种改良具有一定的优越性。首先,利用根癌农杆菌介导遗传转化时,为了不影响植物的再生,人们通常会去除其Ti质粒中T-DNA 区的癌基因,即所谓的“解除武装”。而利用发根农杆菌诱导的毛状根进行遗传转化时,无需“解除武装”,这便使得转化后的阳性细胞更易产生再生植株。其次,根癌农杆菌介导的遗传转化可能产生“嵌合体”,但发根农杆菌诱导产生的毛状根均来源于同一细胞,不会产生“嵌合体”,得到的阳性转基因毛状根分化率高、倍性稳定、增长迅速。
根据现有文献报道,已有包括烟草(Nicotiana tabacu m)、咖啡(Cof f ea)、苜蓿、豌豆(Pisu m sativu m)在内的多种植物,成功实现了通过毛状根诱导出再生植株,但培养条件因物种而异[31-36]。同时,科研人员还发现,通过转基因毛状根获得的再生植株通常还表现出许多可遗传的变异性状,如植株矮化,节间缩短,花型叶型改变等[37-41]。若将这一特性利用于景观花卉植物的育种中,将会有很高的应用前景。并且,通过转基因毛状根获得的再生植株还会表现出根系发达且须根生长旺盛等特点。若将这一特性应用于抗旱植物的培育中,同样会有很好的应用前景。
2.2 利用毛状根生产次生代谢产物
众所周知,植物中含有大量对人类有益的化学成分,诸如多酚、多糖、萜类、黄酮、生物碱等。通常,亲本植株能合成的次生代谢物均可利用毛状根来生产,且次生代谢产物的产量往往高于植物自身所能合成的量[42-43]。因而,这是一条利用生物技术生产次生代谢产物的有效途径。植物毛状根的诱导培养为生产结构复杂、植物中含量低、自然资源缺乏的次生代谢物提供了一条新的方法,具有很高的应用前景(表1)。
2.2.1 毛状根生产次生代谢物的优势 利用植物毛状根进行次生代谢产物的培养具有其他传统方法难以比拟的优势。传统农业方法不仅生产周期长,产量不稳定,而且还要受到生产环境、病虫害等多种因素的影响,很难获得预期的产量。同时,传统的植物细胞培养方法也存在一定的不足,常会遇到诸如细胞生长缓慢,需要添加激素维持等问题,同时其次生代谢物的产量有限,生产能力也不稳定。但是,毛状根体系却具有生长迅速、遗传稳定以及次生代谢产物合成旺盛等优点,这是工业化生产所梦寐以求的。
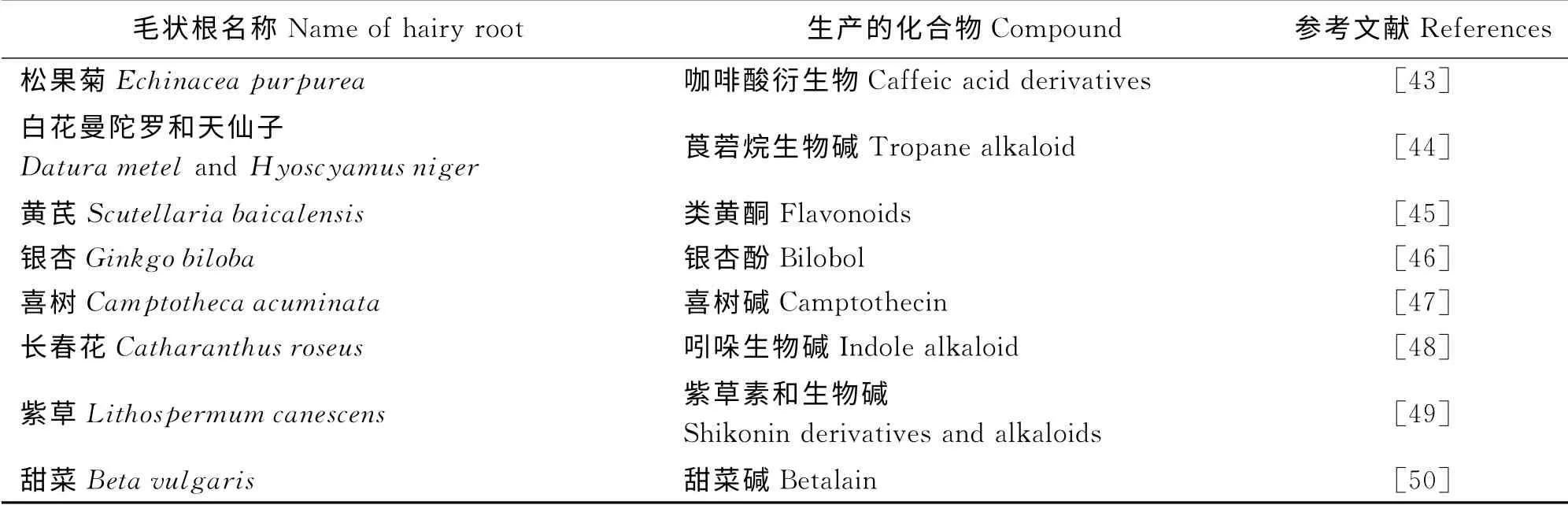
表1 植物毛状根用于次生代谢物的生产Table 1 Plants hairy roots for the production of secondary metabolites
2.2.2 毛状根生产次生代谢物的成果 Moyano等[44]科研人员,利用发根农杆菌将烟草的腐胺N-二甲基转移酶(PMT)基因转入曼陀罗(Datur a str amoniu m)和天仙子(Hyoscyamus niger)毛状根之中,催化莨菪烷生物碱合成通路中的首个关键步骤,进而通过转基因毛状根的生长以达到托烷类生物碱的大量积累。迄今为止,通过毛状根可以培养生产出的次生代谢产物已涵盖生物碱类、甙类、黄酮类、醌类、多糖类等多种物质。同时,已有包括喜树碱、银杏酚、葛根素、类黄酮在内的几十种重要医药用成分实现了通过毛状根来生产[45-47]。而据文献报道,紫草(Lithosper mu m canescens)、长春花(Cathar anthus roseus)、甜菜(Beta vul garis)等植物更是实现了毛状根生产的工业化[48-50]。
2.3 植物毛状根用于环境修复
2.3.1 毛状根用于环境修复的可行性 对于污染物的去除,传统方法都存在一定的缺点,如效率低,成本高,有些还会产生有毒的副产品,而植物修复技术则主要是利用植物来清理受污染的土壤和水[51]。近年来,利用植物根系修复污染的土壤和地下水,越来越受到人们的关注。其基本的吸收机制是通过毛状根广泛的接触面积来吸收有毒的物质并进行分解。通过分析不同的生物系统对污染环境的修复,学者们认为,毛状根体系在环境修复方面具有很高的研究价值和应用前景[52]。由于毛状根与植物根系本身有很大的生化相似性,而且其环境兼容性强,生产成本低,可以被多次利用,故而毛状根应用于环境修复已被人们广泛认可(表2)。
2.3.2 毛状根用于污水治理 酚类物质作为一类主要的化学污染物,具有高毒性和致癌性,是一种对人体和动物都极为有害的物质。为了去除污水中的这一有害物质,人们进行了许多的尝试。目前,酚类物质的去除主要是利用溶剂萃取,活性炭吸附,化学氧化和微生物降解。烟草的转基因毛状根对苯酚具有极大的耐受性,可以用于污水中苯酚污染的去除[53]。有文献报道,诱导产生的胡萝卜(Daucus car ota)毛状根能够在120 h之内去除施加于培养基中90%以上的外源酚类物质[54]。Coniglio等[55]研究发现,酚类物质的去除源于毛状根中过氧化物酶的作用。同时,在酚为底物的甘蓝型油菜(Br assica napus)毛状根中,中性和碱性过氧化物酶相比酸性过氧化物酶表现出较高的亲和力和催化效率[55]。油菜和番茄(Lycopersicon esculentu m)的毛状根已经被用于去除水中的酚类污染物,其最高去除效率分别可达到95%和70%。油菜的毛状根可以高效的去除污水中的污染物,在250 mg·L-1的酚类污染液中去除效率可达80%[56]。烟草毛状根可以在短时间内高效去除其培养环境中的2,4-二氯酚,在2,4-二氯酚初始浓度为250 mg·L-1的培养基中,其去除效率可以达到98%,在培养环境中添加10 mg·L-1过氧化氢,作用时间60 min,可以达到最高的去除效率[57]。同时,欧洲油菜的毛状根也可以清除废水中的2,4-二氯酚,其清除效率更高,清除培养基中98%的2,4-二氯酚仅需30 min[58]。

表2 植物毛状根用于修复污染Table 2 Examples of plant hair y roots used to remediate pollutants
2.3.3 毛状根用于重金属污染的治理 由于重金属污染物不能被生物或化学降解,而且易在食物链中传递,最终危害人类,故重金属污染的治理刻不容缓[59]。研究发现,利用转基因毛状根对重金属的富集作用,可以较好的完成对重金属污染的治理。天蓝遏蓝菜(Thl aspi caer ulescens)是一种公认的超富集植物,相同的镉浓度下,天蓝遏蓝菜毛状根对于镉的吸附水平是非超富集植物毛状根的1.7倍。其毛状根可以在最大镉浓度为890μmol·L-1的浓度下生长,而非超富集植物毛状根在浓度为178 μmol·L-1下便不能生存[60]。
2.3.4 毛状根用于其他污染物的治理 利用毛状根进行环境修复是一种廉价和环保的技术,其同样可以用于其他污染物的处理。向日葵(Helianthus annuus)毛状根可以在其自身相关酶的催化下,迅速消除水溶液中的四环素和土霉素,这表明向日葵毛状根具有修复这两种抗生素污染的潜力[61]。芥菜(Br assica j uncea)的毛状根具有吸收和降解DDT的能力,在利用含有C14的DDT 处理24 h后,培养基中仅检测到总施加量12%~13%的放射性,这表明DDT 被毛状根有效吸收[62]。
2.4 植物毛状根生产外源蛋白
与传统生产手段相比,利用毛状根生产外源蛋白具有以下优点:毛状根在密闭的环境中培养,这就避免了外源基因和活性蛋白在环境中的传播;同时,其在受控的条件下生长,这就避免了产生的蛋白质对外界环境的污染。
早先,Sunil等[63]报道了利用马铃薯(Sol anum tuber osu m)毛状根表达乙肝表面抗原(HBs Ag),其乙肝表面抗原产量超过整个马铃薯植株的9倍,在毛状根鲜重中高达97.1 ng·g-1。Woods等[64]报道,在本式烟(Nicotiana tabacu m)毛状根中转入人类乙酰胆碱酯酶基因,产生的乙酰胆碱酯酶占总可溶性蛋白的3.3%,大约是亲本中表达水平的3倍。还有报道称在烟草毛状根中可以表达人类表皮生长因子(h EGF),其含量达2μg·g-1。目前,经过研究更是实现了小鼠免疫球蛋白在烟草毛状根中的表达[65-67]。
2.5 为根系相关理论研究提供素材
由于某些次生代谢与根的形态分化有关,而毛状根具有多分支且根毛生长旺盛的特点,故其可以作为植物根系相关理论研究以及某些次生代谢物生物合成途径研究的理想材料。例如,在研究植物次生代谢途径方面,科研工作者可以通过对毛状根进行不同激素及不同环境条件等方面的胁迫处理,从而对次生代谢产物合成途径及其关键酶的表达进行分析,进而揭示出相关的代谢机理。Ca macho等[68]在研究腐胺的作用时,发现其在烟草毛状根中的代谢过程涉及到一种名为精氨酸脱羧酶的关键酶,但精氨酸脱羧酶介导的腐胺合成途径并非像以往学者所认为的那样,在代谢中优先合成烟碱。
同时,毛状根也可以作为研究植物根部相关病虫害的理想材料。2007年,Qu和Christ[69]首次利用马铃薯毛状根接种病源微生物粉痂菌(Spongospor a subterr anea),从而对马铃薯粉痂病病源微生物的寄生特性进行研究。Wubben 等[70]利用棉花毛状根为试验材料,进行了抗线虫棉花品种在抗虫机理方面的研究。
3 问题与展望
3.1 植物毛状根诱导的现存问题
现今,植物毛状根由于其自身的优点,越来越受到科研工作者的关注。与此同时,其自身也存在着一些潜在的问题仍需要引起人们的注意。1)在利用毛状根生产次生代谢产物的过程中,近缘植物毛状根中次生代谢产物的积累模式不近相同。Moyano等[44]在研究中发现,莨菪烷生物碱含量都随着曼陀罗和埃及莨菪(Hyoscyamus muticus)毛状根的增长而增加,然而在曼陀罗的毛状根中莨菪碱和东莨菪碱都有一定量的积累,而在埃及莨菪毛状根中只有莨菪碱水平的增加。这一结果表明,在两个相关物种的同一代谢通路中其调控也存在着一定的差异。2)发根农杆菌所侵染的宿主基因型也可能影响导入基因的表达。例如在(S33和S50)两种基因型的百脉根毛状根中,其单宁生物合成量都趋于下降,而在另一种基因型(S41)的百脉根毛状根中,其单宁含量却大幅增加[71]。3)次级代谢通路中关键酶的过表达也并非都会引起次级代谢产物的增加。例如,将两个紫草素合成关键酶基因导入到紫草毛状根中。结果表明,即使在两种关键酶高表达的情况下,紫草素的含量也未见明显增加[49]。同时,在毛状根的继代培养中还可能会出现染色体减少的现象[72]。4)单子叶植物成功诱导毛状根的例子还较少。这主要是因为,单子叶植物本身并不是发根农杆菌的天然宿主。同时,刺激发根农杆菌Vir 基因信号分子介导的酚类物质不能在单子叶植物微管系统内运输,其仅能在特定的发育时期和特定部位的细胞中产生,进而影响了毛状根的诱导[73];另一方面,不同生理状态下的细胞对农杆菌的敏感性也存着差异。有些禾本科的单子叶植物,其薄壁细胞在发育旺盛期便失去了分化能力,且受伤区域周围细胞木质化程度较高,这便使得其处于感受态的细胞较少,从而阻碍了发根农杆菌对毛状根的诱导[72]。
3.2 植物毛状根的发展前景
首先,应进一步明确毛状根的次级代谢途径及其调控机制。植物次级代谢物的合成途径非常复杂,往往有几个甚至十几个酶参与。故而,使用一些相关的新技术,例如:反向遗传学,代谢组学分析,转录组,蛋白质组,以及结合生物信息学的分析,进一步探索植物毛状根的次级代谢规律,寻找最优的培养条件是提高生产效率的关键。同时,应继续摸索单子叶植物毛状根诱导的条件,提高单子叶植物毛状根的诱导率,为次生代谢产物的生物合成以及工业生产创造条件;其次,开发新型生物反应器和探索新的培养方法。毛状根生长时易形成团状,成团的毛状根便限制了液体培养基的进入。相对于细胞悬浮培养,其混合及培养环境的控制比较困难。同时,毛状根的抗切变能力较低,不适宜强烈的搅拌,因此摸索一套合适的培养工艺,并开发大容量的适于培养毛状根的新型生物反应器显得极为重要。同时,毛状根的良好增长还受到多种因素的制约,包括培养基中碳源浓度、离子浓度、激素浓度以及农杆菌侵染外植体的选择等。故而,根据相应的生产需求摸索合理的培养方法也是必不可少的。
同时,需对转基因毛状根的生物安全性做进一步探究。植物毛状根培养技术的发展历史虽短,但发根农杆菌Ri质粒作为植物基因工程载体已显示出显著的优越性。随着研究的深入,其势必成为比Ti质粒更理想的基因转移系统。同时,由于涉及到基因转移,因而在生物工程日益发展的今天,其生物安全性问题也应受到必要的关注。虽然到目前为止,并未有研究表明外源基因的导入会对人类、家畜的健康产生威胁,但是进一步完善转基因植物安全评价体系,探究转基因植物对人类自身健康以及自然环境的影响显得十分必要[47]。应该看到,新的转基因技术与常规育种手段本质上都是基因转移过程,区别在于常规手段局限于种内或近缘种间,而转基因技术的基因来源更为广泛,涵盖动植物基因乃至微生物基因。本质上讲,转基因技术仅是扩大了可利用基因资源的范围,但同时我们也不得不承认,就当今科技而言,人们并不能完全准确的预测出一个外源基因在新的遗传背景中会产生怎样的作用。因此,对于转基因毛状根的生物安全性还应该进行更深层次地探讨。
最后,在今后的研究中应继续探索发根农杆菌诱导单子叶植物毛状根的条件。众所周知,玉米、水稻及小麦(Triticu m aestivu m)等主要粮食作物以及许多牧草都是单子叶植物。发根农杆菌诱导单子叶植物毛状根的研究存在巨大的应用前景。为了提高单子叶植物毛状根诱导的成功性,我们应着眼于以下方面:1)选择合适生长时期的合适外植体作为发根农杆菌侵染的受体;2)改进侵染手段,尝试侵染时利用超声波或添加表明活性剂,以增加发根农杆菌与外植体的相互作用。同时,加入适量的酚类物质以促进农杆菌对受体细胞的侵染。相信随着分子生物学试验技术的快速发展,基础理论研究的进一步深入,通过发根农杆菌诱导的单子叶植物将会越来越多。如将毛状根技术应用于牧草重要农艺性状的遗传改良以及抗旱耐盐牧草新品种的培育,这将为草业科学研究领域提供一种新的技术手段,植物毛状根的应用前景势必会更加广阔。
致谢:该论文是第二届全国草业生物技术大会评选出的优秀论文,并得到中国草业生物技术专业委员会提供的版面费支持。
[1] Alpizar E,Dechamp E,Lapeyre-Montes F,Guilhau mon C,Bertrand B,Jour dan C,Lasher mes P,Etiennel H.Agrobacteriu m r hizogenes-transfor med roots of coffee(Cof f ea ar abica):Conditions f or long-ter m proliferation,and mor phological and molecular characterization[J].Annals of Botany,2008,101(7):929-940.
[2] Patra A K,Saxena J.A new perspective on the use of plant secondar y metabolites to inhibit methanogenesis in t he r u men[J].Phytochemistry,2010,71(11):1198-1222.
[3] David C,Chilton M D,TempéJ.Conservation of T-DNA in plants regenerated fro m hair y root cultures[J].Nature Biotechnology,1984,2(1):73-76.
[4] 张自由,连青龙,辛海波,钟雄辉,罗弦.农杆菌介导的唐菖蒲遗传转化体系的建立[J].中国农业大学学报,2011,16(6):70-75.
[5] 王自章,张树珍,杨本鹏,李杨瑞.甘蔗根癌农杆菌介导转化海藻糖合酶基因获得抗渗透胁迫能力增强植株[J].中国农业科学,2003(2):140-146.
[6] Cheng M,Fry J E,Pang S,Zhou H,Hironaka C M,Duncan D R,Conner T W.Genetic transfor mation of wheat mediated by Agrobacteriu m tu mef aciens[J].Plant Physiology,1997,115(3):971-980.
[7] Ishida Y,Saito H,Ohta S,Yukoh H,Toshihiko K.High efficiency transf or mation of maize(Zea mays L.)mediated by Agr obacteriu m tu mef aciens[J].Nature Biotechnology,1996,14(6):745-750.
[8] Hiei Y,Ohta S,Ko mari T,Toshihiko K,Takashi K.Efficient transfor mation of rice(Or yza sativa L.)mediated by Agr obacteriu m and sequence analysis of the boundaries of the T-DNA[J].The Plant Jour nal,1994,6(2):271-282.
[9] 徐洪伟.发根农杆菌诱导玉米毛状根再生植株及抗旱性研究[D].长春:东北师范大学博士论文,2007.
[10] Chaudhuri K N,Ghosh B,Tepfer D,David T,Su mita J.Spontaneous plant regeneration in transfor med roots and calli from Tylophor a indica:Changes in morphological phenotype and tylophorine accumulation associated with transf or mation by Agrobacteriu m r hizogenes[J].Plant Cell Reports,2006,25(10):1059-1066.
[11] Shkryl Y N,Veremeichik G N,Bulgakov V P,Gor penchenko T Y,Aminin D L,Zhuravlev Y N.Decreased ROS level and activation of antioxidant gene expression in Agrobacteriu m r hizogenes p Ri A4-transfor med calli of Rubia cor dif olia[J].Planta,2010,232(5):1023-1032.
[12] Miao-bin Z,Qing-zhong L,Hao X,Peng C,Gan-qun F.Study on agrobacteriu m-mediated transf or mation of dendrobiu m[J].Acta Horticulturae Sinica,2008,35(4):20.
[13] Jian B,Hou W,Wu C,Liu B,Liu W,Song S.Agrobacterium r hizogenes-mediated transfor mation of Superroot-derived Lotus cor nicul atus plants:A valuable tool for f unctional geno mics[J].BMC Plant Biology,2009,9(1):78.
[14] Crane C,Wright E,Dixon R A,Wang Z Y.Transgenic Medicago tr uncatula plants obtained fro m Agr obacteriu m tu mef aciens-transfor med roots and Agr obacteriu m r hizogenes-transfor med hair y roots[J].Planta,2006,223(6):1344-1354.
[15] Chandra S.Natural plant genetic engineer Agrobacterium r hizogenes:Role of T-DNA in plant secondary metabolis m[J].Biotechnology Letters,2012,34(3):407-415.
[16] Britton M T,Escobar M A,Dandekar A M.The oncogenes of Agrobacteriu m tumef aciens and Agrobacteriu m r hizogenes[A].Tzvi T,Vitaly C.Agrobacterium:From Biology to Biotechnology[M].New York:Springer,2008:523-563.
[17] Ionkova I,Fuss E.Influence of different strains of Agrobacterium r hizogenes on induction of hairy roots and lignan production in Linu m tauricu m ssp.tauricu m[J].Phar macognosy Magazine,2009,17(5):4.
[18] Rahi mi K,Haghbeen K,Marefatjo J,Jazii F R.Successf ul production of hairy r oot of Valeriana sisy mbriif oliu m by Agrobacteriu m r hizogenes[J].Biotechnology,2008,7(2):200-204.
[19] Santos P A G,Figueiredo A C,Oliveira M M,Barroso J G,Pedro l G,Deans S G,Scheffer J J C.Growth and essential oil composition of hairy root cultures of Levisticum of f icinale WDJ Koch(lovage)[J].Plant Science,2005,168(4):1089-1096.
[20] Putalun W,Prasar nsi wamai P,Tanaka H,Shoyama Y.Solasodine glycoside pr oduction by hair y root cultures of Physalis mini ma Linn[J].Biotechnology Letters,2004,26(7):545-548.
[21] Rugini E,Pellegrineschi A,Mencuccini M,Mariotti D.Increase of rooting ability in the woody species ki wi(Actinidia deliciosa A.Chev.)by transfor mation with Agr obacteriu m r hizogenes rol genes[J].Plant Cell Reports,1991,10(6-7):291-295.
[22] Bulgakov V P.Functions of rol genes in plant secondary metabolis m[J].Biotechnology Advances,2008,26(4):318-324.
[23] Kiselev K V,Dubrovina A S,Veselova M V,Bulgakova V P,Fedoreyevb S A,Zhuravleva Y N.The rol B gene-induced over production of resveratrol in Vitis a murensis transfor med cells[J].Jour nal of Biotechnology,2007,128(3):681-692.
[24] Chilton M D,Tepfer D A,Petit A,David C,Casse-Delbart F,Tempe J.Agrobacterium r hizogenes inserts T-DNA into the genomes of the host plant root cells[J].Nature,1982,295:432-434.
[25] Stachel S E,Messens E,Van Montagu M,Patricia Z.Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agr obacteriu m tu mef aciens[J].Nature,1985,318:624-629.
[26] Satuti N H N,Moriguchi K,Sato M,Kataoka M,Maeda Y,Tanaka N,Yoshida K.Geno me str ucture of Ri plas mid(3).Sequencing analysis of the vir region of p Ri1724 in Japanese Agrobacteriu m r hizogenes[J].Oxford University:Nucleic Acids Sy mposium Series,2000,44(1):95-96.
[27] Somers D A,Samac D A,Olhoft P M.Recent advances in legume transfor mation[J].Plant Physiology,2003,131(3):892-899.
[28] Li Y,Zhou L Li Y,Chen D,Tan X J,Lei L.A nodule-specific plant cysteine proteinase,As NODF32,is involved in nodule senescence and nitr ogen fixation activity of the green manure legu me Astr agal us sinicus[J].New Phytologist,2008,180(1):185-192.
[29] Georgiev M I,Pavlov A I,Bley T.Hairy root type plant in vitro systems as sources of bioactive substances[J].Applied Microbiology and Biotechnology,2007,74(6):1175-1185.
[30] Li J,Todd T C,Trick H N.Rapid in planta evaluation of root expressed transgenes in chi meric soybean plants[J].Plant Cell Reports,2010,29(2):113-123.
[31] Choi P S,Ki m Y D,Choi K M,Chung H J,Choi D W,Liu J R.Plant regeneration from hairy-root cultures transf or med by infection with Agrobacterium r hizogenes in Catharanthus roseus[J].Plant Cell Reports,2004,22(11):828-831.
[32] Ku mar V,Satyanarayana K V,Itty S S,Indu E P,Giridhar P,Chandrashekar A.Stable transf or mation and direct regeneration in Cof f ea canephor a P ex.Fr.by Agrobacteriu m r hizogenes-mediated transfor mation without hairy-r oot phenotype[J].Plant Cell Reports,2006,25(3):214-222.
[33] Moghaieb R E A,Saneoka H,Fujita K.Shoot regeneration fro m GUS-transfor med to mato(Lycopersicon esculentu m)hairy root[J].Cellular and Molecular Biology Letters,2004,9(3):439-450.
[34] Suboti′c A,Jevremovi′c S,Grubiši′c D,Jankovi′c T.Spontaneous plant regeneration and production of secondary metabolites fro m hairy r oot cultures of Centauriu m er ythr aea Raf n[A].Praveen K S,Shri M J.Protocols f or In Vitro Cultures and Secondar y Metabolite Analysis of Aro matic and Medicinal Plants[M].New Yor k:Hu mana Press,2009:205-215.
[35] Yoshi matsu K,Sudo H,Kamada H,Kiuchi F,Kikuchi Y,Sawada J,Shi mo mura K.Tropane alkaloid pr oduction and shoot regeneration in hairy and adventitious root cultures of Duboisia myoporoides-D.leichhardtii hybrid[J].Biological and Phar maceutical Bulletin,2004,27(8):1261-1265.
[36] 杨沛艳,何亚丽,吴燕民.高羊茅抗逆基因工程研究进展[J].草业科学,2013,30(12):1968-1972.
[37] Tepfer D.Transf or mation of several species of higher plants by agrobacteriu m rhizogenes:Sexual trans mission of the transfor med genotype and phenotype[J].Cell,1984,37(3):959-967.
[38] Taylor B H,Amasino R M,White F F,Nester E W,Gor don M P.T-DNA analysis of plants regenerated fro m hairy root tu mors[J].Molecular and General Genetics MGG,1985,201(3):554-557.
[39] Sosa Alderete L G,Talano M A,Ib′añez S G,Silvia P,Elizabet h A,Silvia R.Milrad I.Medina.Establish ment of transgenic tobacco hair y roots expressing basic peroxidases and its application f or phenol removal[J].Jour nal of Biotechnology,2009,139(4):273-279.
[40] Cardarelli M,SpanòL,Mariotti D,Mauro M L,Sluys M A V,Costantino P.The role of auxin in hairy root induction[J].Molecular and General Genetics MGG,1987,208(3):457-463.
[41] Han K H,Keathley D E,Davis J M,Gordon M P.Regeneration of a transgenic woody legu me(Robinia pseudoacacia L.,black locust)and mor phological alterations induced by Agrobacteriu m r hizogenes-mediated transf or mation[J].Plant Science,1993,88(2):149-157.
[42] Srivastava S,Srivastava A K.Hairy root culture f or mass-production of high-value secondary metabolites[J].Critical Reviews in Biotechnology,2007,27(1):29-43.
[43] Abbasi B H,Tian C L,Murch S J,Saxena P K,Liu C Z.Light-enhanced caffeic acid derivatives biosynthesis in hair y root cultures of Echinacea pur purea[J].Plant Cell Reports,2007,26(8):1367-1372.
[44] Moyano E,Jouhikainen K,Tammela P,Palazón J,CusidóM A,Piñol M T,Teeri T H.Effect of p mt gene overexpression on tropane alkaloid production in transf or med root cultures of Datura metel and Hyoscyamus muticus[J].Journal of Experi mental Botany,2003,54(381):203-211.
[45] Tiwari R K,Trivedi M,Guang Z C,Guo G Q,Zheng G Z.Agrobacteriu m r hizogenes mediated transfor mation of Scutell aria baicalensis and production of flavonoids in hair y roots[J].Biologia Plantar u m,2008,52(1):26-35.
[46] Ayadi R,Trémouillaux-Guiller J.Root f or mation fro m transgenic calli of Ginkgo biloba[J].Tree Physiology,2003,23(10):713-718.
[47] Lorence A,Medina-Bolivar F,Nessler C L.Camptothecin and 10-hydroxycamptothecin from Camptotheca acuminata hairy r oots[J].Plant Cell Reports,2004,22(6):437-441.
[48] Goklany S,Loring R H,Glick J,Carolyn W T,Lee P.Assessing the li mitations to ter penoid indole alkaloid biosynt hesis in Cathar anthus roseus hairy r oot cultures through gene expression profiling and precursor feeding[J].Biotechnology Progress,2009,25(5):1289-1296.
[49] Pietr osiuk A,Sykłowska-Baranek K,Wiedenfeld H,Wolinowska R,Fur mano wa M,Jaroszyk E.The shikonin derivatives and pyrrolizidine alkaloids in hair y root cultures of Lithosper mu m canescens (Michx.)Leh m[J].Plant Cell Reports,2006,25(10):1052-1058.
[50] Savitha B C,Thi mmaraju R,Bhagyalaksh mi N,Ravishankar G A.Different biotic and abiotic elicitors influence betalain production in hairy root cultures of Beta vul garis in shake-flask and bioreactor[J].Process Biochemistry,2006,41(1):50-60.
[51] Paisio C E,González P S,Ger baudo A,Bertuzzi M L,Agostini E.Toxicity of phenol solutions treated wit h rapeseed and to mato hair y roots[J].Desalination,2010,263(1):23-28.
[52] Patil P,Desai N,Govind war S,Jadhav J P,Bapat V.Degradation analysis of Reactive Red 198 by hair y r oots of Tagetes patul a L.(Marigold)[J].Planta,2009,230(4):725-735.
[53] Ibáñez S G,Medina M I,Agostini E.Phenol tolerance,changes of antioxidative enzy mes and cellular damage in transgenic tobacco hairy roots colonized by arbuscular mycorrhizal f ungi[J].Chemosphere,2011,83(5):700-705.
[54] Sircar D,Mitra A.Evidence for p-hydroxybenzoate f or mation involving enzy matic phenylpropanoid side-chain cleavage in hairy r oots of Daucus carota[J].Jour nal of Plant Physiology,2008,165(4):407-414.
[55] Coniglio M S,Busto V D,González P S,Medina M I,Milrad S,Agostini E.Application of Br assica napu hair y root cultures for phenol removal from aqueous solutions[J].Chemosphere,2008,72(7):1035-1042.
[56] González P S,Maglione G A,Gior dana M,Paisio C E,Talano M A.Evaluation of phenol detoxification by Br assica napus hairy r oots,using Alliu m cepa test[J].Environ mental Science and Pollution Research,2012,19(2):482-491.
[57] Talano M A,Frontera S,González P,Medina M I,Agostini E.Removal of 2,4-diclor ophenol fr om aqueous solutions using tobacco hairy root cultures[J].Journal of Hazardous Materials,2010,176(1):784-791.
[58] Angelini V A,Orejas J,Medina M I,Agostini E.Scale up of 2,4-dichlorophenol removal fro m aqueous solutions using Br assica napus hairy roots[J].Journal of Hazardous Materials,2011,185(1):269-274.
[59] Wu G,Kang H,Zhang X,Shaob H,Chuc L,Ruan C.A critical review on the bio-removal of hazar dous heavy metals fro m contaminated soils:Issues,progress,eco-environmental concerns and opportunities[J].Journal of Hazardous Materials,2010,174(1):1-8.
[60] Zelko I,Lux A,Czibula K.Difference in the root str ucture of hyperaccu mulator Thl aspi caer ulescens and non-hyperaccumulator Thlaspi arvense[J].International Journal of Environment and Pollution,2008,33(2):123-132.
[61] Gujarathi N P,Haney B J,Par k H J,Wickramasinghe S R,Linden J C.Hair y roots of Helianthus annuus:A model system to study phytoremediation of tetracycline and oxytetracycline[J].Biotechnology Progress,2005,21(3):775-780.
[62] Suresh B,Bais H P,Raghavarao K,Ravishankara G A,Ghildyal N P.Co mparative evaluation of bioreactor design using Tagetes patula L.hairy roots as a model system[J].Process Biochemistry,2005,40(5):1509-1515.
[63] Sunil Ku mar G B,Ganapat hi T R,Srinivas L,Revathib J C,Bapat V A.Expression of hepatitis B surface antigen in potato hair y roots[J].Plant Science,2006,170(5):918-925.
[64] Woods R R,Geyer B C,Mor T S.Hairy-root organ cultures f or the production of human acetyl cholinesterase[J].BMC Biotechnology,2008,8(1):95.
[65] Parsons J,Wirth S,Dominguez M.Production of human epider mal growth factor(h EGF)by in vitro cultures of Nicotiana tabacu m effect of tissue differentiation and sodiu m nitropr usside addition[J].Inter national Jour nal of Biotechnol Biochem,2010(6):131-138.
[66] Ko mar nytsky S,Borisjuk N,Yakoby N,Garvey A,Raskin I.Cosecretion of protease inhibitor stabilizes antibodies produced by plant roots[J].Plant Physiology,2006,141(4):1185-1193.
[67] Hodges L D,Lee L Y,Mc Nett H,Stanton B G,Ream W.The Agrobacteriu m r hizogenes GALLS gene encodes t wo secreted proteins required f or genetic transf or mation of plants[J].Jour nal of Bacteriology,2009,191(1):355-364.
[68] Camacho-Cristóbal J J,Maldonado J M,González-Fontes A.Boron deficiency increases putrescine levels in tobacco plants[J].Jour nal of Plant Physiology,2005,162(8):921-928.
[69] Qu X,Christ B J.In vitro culture of the obligate parasite Spongospora subterranea(Cercozoa;Plas modiophorida)associated with root-inducing transferred-DNA transf or med potato hair y roots[J].Jour nal of Eukaryotic Microbiology,2007,54(6):465-467.
[70] Wubben M J,Callahan F E,Triplett B A,Jenkins J N.Phenotypic and molecular evaluation of cotton hairy roots as a model system for studying nematode resistance[J].Plant Cell Reports,2009,28(9):1399-1409.
[71] Carron T R,Robbins M P,Morris P.Genetic modification of condensed tannin biosynthesis in Lotus cornicul atus.1.Heterologous antisense dihydroflavonol reductase do wn-regulates tannin accu mulation in“hair y r oot”cultures[J].Theoretical and Applied Genetics,1994,87(8):1006-1015.
[72] Shar ma S,Shahzad A,Sahai A.Hair y Root Cult ure:An Efficient System for Secondar y Metabolite Production[A].Mohd S,Anwar S,Abida M,Aastha S.Recent Trends in Biotechnology and Therapeutic Applications of Medicinal Plants[M].Berlin:Springer Net herlands,2013:51-78.
[73] Spar ks C A,Doherty A,Jones H D.Genetic transfor mation of wheat via Agrobacteriu m-mediated DNA delivery[A].Robert J H,Agnelo F.Cereal Genomics[M].New York:Humana Press,2014:235-250.

