落叶松-青杨叶锈病菌担孢子萌发规律
龚文强 瓮岳太 王淑君 薛煜
(东北林业大学,哈尔滨,150040) (密山市林业局) (东北林业大学)
杨树广泛分布于北纬30°~72°之间的地区,因其生长快、易繁殖、用途广、适应性强、轮伐期短而广受林业生产单位和城市绿化部门的欢迎。然而,杨树上发生的病虫害不但多而且严重,其中落叶松-青杨叶锈病(Melampsora larici-populina)是一种分布最广、危害最严重、寄主种类最多、造成损失最大的叶部病害。已见报道的国家和地区近40 个,危害青杨派、黑杨派及其杂交种的多种杨树;遍布除南极洲以外的各大洲,几乎有杨树的地方都可见到它的危害[1-4]。近年来,该病害在东北各地苗圃普遍发生,在局部地区危害尤为严重,因此引起了生产和科研部门的普遍重视[5-6]。在发病严重的苗圃,2 年生实生苗发病率可达100%,病情指数达80 ~92,死苗率达21.5%[7]。国内外曾对该病的病原、致病性及寄主抗病性等方面进行了广泛地研究,进入20 世纪90 年代以后,研究工作主要集中在病原菌致病性及生理分化、寄主抗病性的分子遗传等方面。裴明浩等[8]对该菌的春孢子、夏孢子、冬孢子和担孢子的生物学特性进行了研究,发现春孢子萌发适温为15~18 ℃,夏孢子萌发适温为18 ~20 ℃,冬孢子以13 ~18 ℃为最适,担孢子以15 ~18 ℃为最适。郭志青等[9]的研究表明,夏孢子萌发的最适温度是20 ℃,在此温度下2 h 夏孢子就可萌发生成芽管,24 h 萌发率最高可达63.40%,芽管有多核现象。Staples等[10]报道了夏孢子萌发状态和侵染结构的分化情况。在担孢子萌发方面的研究国内外报道不多,本研究的目的是摸清担孢子的越冬情况和适宜萌发的温度条件,为该病的流行病学、预测预报研究提供科学依据。
1 材料与方法
标本采集地点:2013 年秋季在东北林业大学实验林场内采集落地的罹病杨树叶子,一部分置室内越冬,一部分置室外自然环境下越冬。
不同温度下担孢子萌发试验:将2%琼脂培养基切成2 cm×2 cm 小块,厚薄均匀适当,放在消毒的载玻片上,置于铺有浸水脱脂棉的灭菌培养皿内,载玻片下端用玻璃棒垫起。将长有冬孢子的叶子反压于皿盖内,将其分别置于5、10、15、20、25、30 ℃温度下培养,待担孢子弹落到2%琼脂培养基上时,撤掉树叶,继续观察担孢子萌发情况,当产生次生担孢子后,每隔2 h 观察一次,每个处理3 个重复,观察时,每个视野随机观察30 组数据,统计萌发率。
不同光照条件下担孢子芽管的生长情况:将收集到的担孢子分别置于全光、半光、无光3 种条件下,室温培养,各3 个重复,观察时,每个视野随机观察30 组数据,计算芽管长度。
担孢子在-10 ℃的萌发试验:为证明已萌发的担孢子经晚霜后是否仍有生命力,取罹病叶片,在室温下做萌发试验,标记培养皿1“-10 ℃”,标记培养皿2“室温”。随后观察其萌发情况,待其萌发刚产生芽管时,将培养皿1 置于-10 ℃环境下,将培养皿2 放在室温下培养。24 h 后,将培养皿1 取出,重新置于室温下,24 h 后,再观察萌发情况并记录。培养皿2 仍在室温下培养,24 h 后观察萌发情况。每个处理3 个重复,各重复观察10 个视野。
室内越冬的冬孢子萌发试验:将室内越冬的冬孢子放在培养皿内做萌发试验。培养基制作和获得担孢子的方法同不同温度下担孢子萌发试验。将培养皿1 直接置于-10 ℃的环境中48 h 后转入室内温度下继续作萌发试验,24 h 后取出玻片,观察其萌发情况。将培养皿2 放置在室温下直接作萌发试验,48 h 后观察期萌发情况,若担孢子不萌发,再置于-10 ℃下24 h 后取出再转入室温作萌发试验。每个处理3 个重复,各重复观察10 个视野。
2 结果与分析
2.1 担孢子在不同温度下的萌发率
落叶松-青杨叶锈病菌担孢子洋梨形,有一个疣状突起,担孢子萌发时首先长出短的芽管,在芽管顶端产生次生担孢子,担孢子的内容物进入到次生担孢子内,次生担孢子萌发产生芽管,有的担孢子可产生三生担孢子。试验中发现,担孢子在5 ℃和10℃下不萌发,但冬孢子可以萌发,弹射出担孢子。担孢子在15 ℃时萌发率平均可达60%,担孢子芽管不分枝。在刚开始萌发的6 h 内,担孢子萌发率直线上升,以后趋于平缓(表1,图1A)。20 ℃时担孢子的萌发率最高,培养12 h 后,平均萌发率可达83.42%(表1,图1B)。由此可见,落叶松杨栅锈菌的担孢子萌发的最适温度为20 ℃,而每年适温出现的时间或早或晚,成为当年病害是否严重的关键。如当年有利于担孢子萌发的适温比正常年份晚半个月,就会造成夏孢子比往年少一个世代,病害就会轻。担孢子在25 ℃下萌发率开始上升较慢,但到后期萌发率也可达到71.52%,但担孢子的芽管有扭曲的现象(表1,图1C)。担孢子在30 ℃时萌发率很低,比20℃时的萌发率降低了68.89%,说明30 ℃不适合担孢子萌发,担孢子芽管明显地扭曲变形,是否还有侵染能力,有待做接种试验验证(表1,图1D)。在自然界中,早春4 月末5 月初,很少有30 ℃的天气。如出现这种天气,这一年的病害肯定会比正常年份轻。
2.2 担孢子芽管长度在不同光照下的生长情况
在光照和黑暗交替的条件下,担孢子芽管生长随时间的推移而生长,最长可达58 μm,到48 h 后基本停止生长,这意味着担孢子在条件适宜的环境中可保持生长状态达48 h,甚至更长。担孢子芽管在全光条件下的生长情况与半光条件下的基本相似,说明全光和半光对于担孢子生长影响不大。在无光条件,担孢子芽管长度最长,表明担孢子更适合在无光条件下萌发(表2)。

表1 不同温度下落叶松-青杨叶锈病菌担孢子的萌发率

图1 落叶松-青杨叶锈病菌担孢子在不同温度下培养10 h后的萌发率
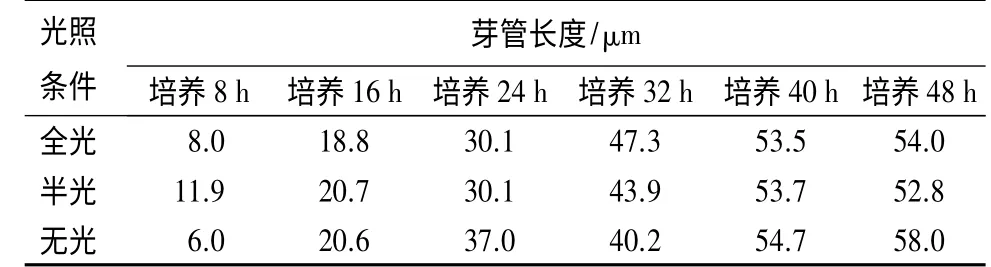
表2 不同光照下落叶松-青杨叶锈病菌担孢子芽管的生长情况
2.3 -10 ℃对担孢子萌发的影响
把在室外越冬的冬孢子置室温下,已萌发的担孢子(图2A)移入-10 ℃环境中48 h 后,再放回到室温,担孢子还可继续萌发,这证明寒冷的条件不能影响担孢子的萌发力和生活力,是一种耐寒性相当强的孢子。这意味着担孢子在早春即使已开始萌发,遇到晚霜降临,也不会影响当年担孢子的有效侵染,当温度回升后,担孢子芽管还会继续萌发生长(图2B)。
2.4 室内越冬的冬孢子的萌发特点
室内越冬的病叶直接放入-10 ℃下48 h 后,再移至室温下做萌发试验,发现冬孢子可以萌发,产生担孢子并大量萌发,说明冬孢子只要经短期的寒冷刺激就可获得萌发能力,而且萌发势与经过一冬严寒的病叶上的冬孢子无大异(图2C)。室内越冬的病叶在室内做萌发试验48 h 后,取出玻片观察,冬孢子可以产生担孢子,但担孢子无萌发能力,48 h 后也未见萌发。当将室内过冬的冬孢子所产生的、未萌发的担孢子置在-10 ℃条件下48 h 后,再转入室内做担孢子萌发试验,24 h 后观察,其担孢子萌发很好(图2D)。由此可见,寒冷条件对担孢子的萌发是至关重要的。此种现象也为林木病理学的基础理论增添了新的内容,同时也为该病害的流行学研究和预测预报提供了参考依据。

图2 落叶松-青杨叶锈病菌担孢子萌发状
3 结论与讨论
在不同温度下的担孢子萌发试验证明,担孢子在10 ℃以下时不萌发,即使产生次生担孢子也无萌发能力。15 ℃至25 ℃的环境下长势较好,20 ℃时萌发率最高,为83.42%。因此,证明早春时,自然界的温度只有高于10 ℃时,担孢子才开始萌发,且在25 ℃以后萌发率随着温度的增高而降低,担孢子芽管出现畸型现象。担孢子芽管在无光环境下生长情况要好于半光和全光,担孢子的生长速度最快。担孢子芽管长度在无光条件下最长,但光对担孢子芽管生长的影响并没有其他因素那么强烈。
根据观察室温下已萌发的担孢子移入到-10 ℃环境中,48 h 后再移入室温,可继续生长,说明担孢子的芽管和担孢子都不会受突变的寒冷影响,重新置于室温时可继续萌发生长。未经过室外越冬的冬孢子,置于低温48 h 后,移入室温下,能产生大量的担孢子且大量萌发。室内越冬的冬孢子在室温下可以产生担孢子,但担孢子无萌发能力;移入冷冻条件下48 h 后,担孢子可获得萌发能力,在室温下大量萌发。这说明担孢子是通过冷冻刺激后,才可获得萌发能力,其发生机理有待今后深入研究。
[1] 周仲铭,袁毅.杨树叶锈病的研究概况[J].北京林学院学报,1985(4):84-102.
[2] 袁毅.我国杨树叶锈病菌种类的研究[J].北京林学院学报,1984(1):48-82.
[3] 尚衍重,郝俊贞,袁秀英.内蒙古的杨树栅锈菌[J].华北农学报,1990,5(2):86-92.
[4] Pei M H,McCracken A R. Rust diseases of willow and poplar[M]. New York:Oxford University Press,2005.
[5] Hansen E A. Poplar woody biomass yields:a look to the future[J]. Biomass Bioenerg,1991,1(1):1-7.
[6] Steenackers J,Steenackers M,SteenaekersV,et al. PoPlar diseases,consequences on growth and wood quality[J]. Biomass Bioenerg,1996,10(5/6):267-274.
[7] 王纯利.新疆杨柳科植物上栅锈菌属(Melampsora Cast.)研究[D].乌鲁木齐:乌鲁木齐八一农学院,1985.
[8] 裴明浩,尚衍重.青杨叶锈病(Melamapsora laricipopulina Kleb.)的研究[J].东北林学院学报1984,12(2):40-49.
[9] 郭志青,曹支敏,余仲东.落叶松-杨栅锈菌夏抱子萌发条件研究[J].西北林学院学报,2010,25(3):118-121.
[10] Staples R C,Macko V. Germination of urediospores and differentiation of infection structures[M]Bushnell W R,Roelfs A P.The cereal rusts,origins,specificity,structure,and physiology.Orlando:Academic Press,1984:255-289.

