双水相气浮溶剂浮选-紫外分光光度法测定水中痕量氯霉素
赵晓军,王钰伟,武大引
(1.平顶山学院 化学化工学院,河南 平顶山 467000;2.河南神马氯碱发展有限责任公司,河南 平顶山 467000)
氯霉素(CAP)又名氯胺苯醇,是一种广谱抗生素,用于传染性疾病如肺炎、伤寒菌痢、百日咳、败血症等疾病治疗[1]。随着氯霉素的应用和研究,它的毒副作用也不断被发现,能够引起新生儿灰色综合症,再生障碍性贫血、粒状白细胞缺乏症[2],但由于药效高且价格低廉,目前已广泛应用在家禽、家畜、水产品等传染性疾病的控制和治疗上。由于过度使用,氯霉素在动物性食品及水产品中的残留对人类的健康构成了潜在危害,所以氯霉素残留的问题引起了国际组织和许多国家的高度重视。到目前为止,较成熟的检测方法主要有微生物学方法、免疫速测分析方法、色谱分析方法、光度分析法等。
微生物学方法可大体分为2 种:一种是基于抗生素对微生物生长的抑制作用[3];另一种是由于微生物对氯霉素敏感而引起生化特性的变化[4-6],以上这些方法费用低、操作简单,但特异性差、耗时长、灵敏度低,一般抗生素类药物都有此类反应,易造成漏检、错检。
由于氯霉素是半抗原,不能刺激机体产生抗体,将氯霉素的二氯酰胺醇和硝基苯结构和大分子蛋白结合后均可作为完全抗原有效制备相应的抗体,在此基础上建立酶联免疫竞争法测定氯霉素含量[7-8]。常用的有酶联免疫吸附法(ELISA)[9-15]、放射免疫法(RIA)[16]、胶体金免疫层析法(GICA)[17-19]、化学发光酶免疫法(CLEIA)[20-22]、伏安免疫法(VIA)[23]等。免疫速测分析技术优点是灵敏度高、分析速度快、仪器简单,缺点在于对实验条件的要求较高,易出现假阳性结果,抗体批次不同,测定结果也会出现差异,放射性污染等缺点,其稳定性及敏感性尚待进一步提高。
色谱法具有灵敏度高、结果可靠等优点,是目前国际公认的检测手段,我国现行国家标准GB/T 22338—2008 规定了动物源性食品中氯霉素类残留量的气相色谱-质谱(GC-MS)和液相色谱-质谱(LCMS)测定方法,适用于水产品、畜禽产品和畜禽副产品中氯霉素残留的定性和定量测定[24]。此外,其他色谱检测技术,如超高效液相色谱-质谱(UPLC-MS)用于禽畜肉[25]、蜂蜜[26]、牛奶[27]、奶粉[28]和多种动物源性食品[29]中氯霉素的分析检测;高效液相色谱-电喷雾离子阱质谱法(HPLC-ESI-TRAP-MS)用于乳品中氯霉素类药物残留的测定[30];气相色谱电子捕获法(GC-ECD)检测肌肉组织中的氯霉素残留[31]等。色谱检测技术具有灵敏度高、准确可靠等优点,但是样品前处理操作复杂、专业性强、成本较高,不适合进行大批量样品的快速筛选检测。
气浮溶剂浮选技术已广泛应用于金属离子检测[32-34]、有机污染物测定[35-36]、天然产物活性成分的分离[37-38]等。双水相气浮溶剂浮选集双水相体系与溶剂浮选技术的优点,具有操作简单、成本低、快速、绿色、对环境无污染等特点,该技术用于分离富集氯霉素,具有较强的实际应用价值。
1 实验部分
1.1 试剂与仪器
氯霉素标准品(纯度99.5%)、磷酸氢二钾、碳酸钾、硫酸铵、氯化钠、氯化钾、氢氧化钠、盐酸、无水乙醇、正丙醇、异丙醇、正丁醇、丙酮、四氢呋喃均为分析纯;实验用水为二次蒸馏水。
UV-2550 双光束紫外可见分光光度计;UV-1901双光束紫外可见分光光度计;PHS-3C 型数字酸度计;CP224C 电子天平;LZB-3-13 型玻璃转子流量计;H1650 离心机(湘仪);自制浮选柱(200 mL),浮选装置见图1。
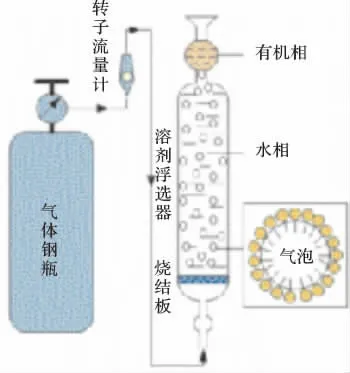
图1 双水相气浮溶剂浮选装置Fig.1 ATGS equipment
1.2 实验方法
1.2.1 双水相气浮溶剂浮选 用移液管准确移取一定量的氯霉素工作溶液,于200 mL 的浮选柱中,用一定浓度的析相盐溶液定容,调节溶液体系的pH,加入5 mL 的正丙醇,静置分层后,打开氮气钢瓶,调节氮气流速,浮选一定时间,取下层水相,用紫外可见分光光度计测定其吸光度,计算浮选率。
1.2.2 双水相萃取 取1.2.1 节相同体积的氯霉素及相同浓度的析相盐溶液200 mL,加入20 mL 正丙醇双水相萃取,待静置分层后,取下层水相,用紫外可见分光光度计在278.5 nm 处测定其吸光度,并计算浮选率。
1.2.3 浮选率计算 浮选率(F)按下式进行计算:F=C0-C1/C0,其中C0为浮选(萃取)前水溶液的吸光度,C1为浮选(萃取)后水溶液的吸光度。
2 结果与讨论
2.1 亲水有机溶剂和析相盐的选择
考察了无水乙醇、正丙醇、异丙醇、正丁醇、丙酮、四氢呋喃等6 种常用的小分子亲水有机溶剂,在特定的析相盐条件下都具有较好的分相能力。而且常温下其溶液的密度与纯水的密度之比<1,能够在水溶液上方分相,但四氢呋喃、丙酮微毒且沸点较低,实验过程中容易挥发,影响实验的稳定性。无水乙醇/水/硫酸铵、异丙醇/水/硫酸铵双水相体系,硫酸铵的溶解度随温度变化大,分相稳定时间较短,容易析出晶体,阻塞浮选柱砂芯滤板;正丙醇、正丁醇与多数盐都能形成双水相体系,但正丁醇在水中的溶解度较小(微溶),体系范围较窄,综合考虑本实验选择正丙醇/水/氯化钠体系。
2.2 检测波长的选择
准确称取0.807 8 g 氯霉素标准品,用蒸馏水溶解于250 mL 的容量瓶中,定容至刻度线,摇匀,配成3.23 mg/mL 的储备液,放置冰箱备用,用时稀释成3.23 ×10-2mg/mL 的氯霉素工作溶液。用紫外分光光度计在200 ~500 nm 范围内扫描,氯霉素吸收光谱见图2。
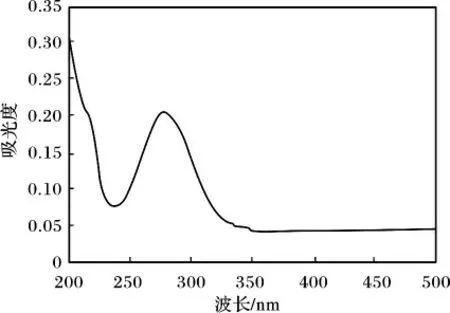
图2 氯霉素吸收光谱Fig.2 Absorption spectrum of CAP
由图2 可知,氯霉素在278.5 nm 处有最大吸收峰,因此在278.5 nm 处测量上述溶液的吸光度。
2.3 标准曲线的绘制
用移液管准确移取氯霉素工作液1.00,2.00,4.00,6.00,8.00,10.00,20.00 mL 于25 mL 的容量瓶中,定容,摇匀,分别配成1.29,2.58,5.16,7.74,10.32,12.96,25.84 μg/mL 的氯霉素溶液。在1.29~25.8 μg/mL 范围内与吸光度呈良好线性关系,回归方程:A = 0.030 3C + 0.024 4,相关系数R =0.999 0。由IUPAC 定义,检出限LOD =3SB/b,SB为10 次空白实验的标准偏差,b 为标准曲线的斜率,可得本实验对氯霉素的检出限为0.80 μg/mL。
2.4 氯化钠的浓度
在6 只200 mL 的浮选柱中分别加入质量分数为2.00,2.50,3.00,3.30,3.60 mg/mL 以及过饱和的氯化钠溶液,再分别加入5 mL 的正丙醇,考察溶液的分相情况,实验显示2.00 mg/mL 的氯化钠溶液不分相,饱和的氯化钠溶液分相明显,相界面清晰。可能是无机盐电离出来的阴、阳离子在水化过程中会夺取大量水分子,由于体系中没有自由水分子,体系就自动生成两相。
2.5 pH 的影响
用移液管准确移取3.23 ×10-2mg/mL 的氯霉素工作溶液5 mL,于200 mL 的浮选柱中,用饱和氯化钠溶液定容至200 mL 刻度线处,分别用0.01 mol/L NaOH 溶液或0.01 mol/L HCl 溶液调节溶液体系的pH 值为5,6,7,8,9,10,10.71,11.36,分别加入5 mL 的正丙醇。打开氮气钢瓶,调节氮气流速为一定值,浮选一定时间后,取上层有机相,以正丙醇为参比在278.5 nm 处测定其吸光度,结果见图3。
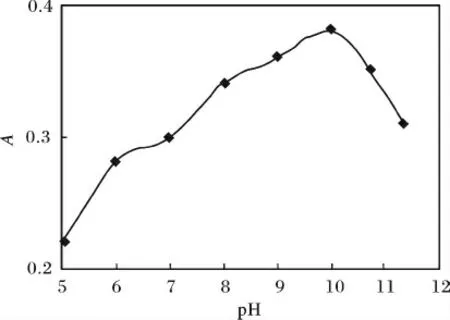
图3 pH 的影响Fig.3 Influence of the pH values
由图3 可知,pH 值在5 ~11.36 范围内,吸光度先逐渐变大,然后迅速变小,可能原因是:pH 值的变化影响氯霉素中的羟基、氨基亲水基团,使氯霉素的结构更加疏水,利于吸附在上升气泡上,进入上层有机相,浮选效果更好;但pH 值>10 左右氯霉素的结构会被破坏。综上可知,溶液体系的pH 为10 是最佳的浮选条件。
2.6 氮气流速的影响
用移液管准确移取3.23 ×10-2mg/mL 的氯霉素工作溶液5 mL,于200 mL 的浮选柱中,用饱和氯化钠溶液定容至200 mL 刻度线处,调节溶液体系的pH 值为10,加入5 mL 的正丙醇。打开氮气钢瓶,调节氮气流速为15,20,25,30,35 mL/min,浮选一定时间后,取上层有机相,以正丙醇为参比在278.5 nm 处测定其吸光度,结果见图4。
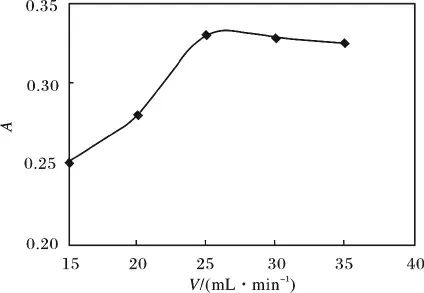
图4 氮气流速的影响Fig.4 Influence of the flow rate of nitrogen
由图4 可知,氮气流速在15 ~35 mL/min 范围内,吸光度先增大后略有减小,可能原因是:流速太小,达到平衡所需的时间较长;流速太大,气泡上升速度快,氯霉素与气泡接触时间短,吸附不稳定或已经吸附在气泡表面的氯霉素脱落重新回到水相。综上可知,氮气流速为25 mL/min 是最佳浮选条件。
2.7 浮选时间的影响
用移液管准确移取3.23 ×10-2mg/mL 的氯霉素工作溶液5 mL 于200 mL 的浮选柱中,用饱和氯化钠溶液定容至200 mL 刻度线处,调节溶液体系的pH 值为10,加入5 mL 的正丙醇。打开氮气钢瓶,调节氮气流速为25 mL/min,分别浮选10,20,30,40,50,60 min 后,取上层有机相,以正丙醇为参比在278.5 nm 处测定其吸光度,结果见图5。
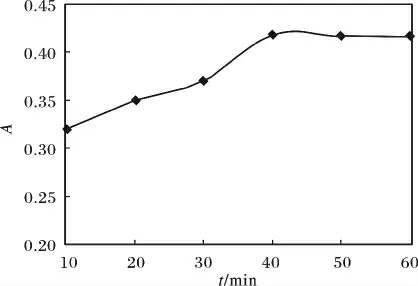
图5 浮选时间的影响Fig.5 Influence of the floatation time
由图5 可知,浮选时间在10 ~60 min,吸光度逐渐增大后略有下降。可能原因是:浮选时间太短,水相中的氯霉素随着气泡进入到有机相太少;浮选时间超过40 min 后,时间过长有可能导致气泡间水膜排水,膜层变薄使得膜层破裂,一些已被浮选至上相的氯霉素,重新回到下层水相,所以40 min 后吸光度略有下降。综上可知,浮选时间为40 min 是最佳浮选条件。
2.8 共存物质的影响
按实验方法操作,考察了常见共存离子对测定结果的影响。Cl-、NH4+、NO3-、K+、Na+、SO42-对测定基本无干扰;当相对误差≤5%时,1 500 倍的淀粉、蔗糖和乳糖,500 倍的果糖、葡萄糖;900 倍的D-色氨酸;600 倍的L-组氨酸;400 倍的甘氨酸;300 倍的抗坏血酸不干扰测定,表明该方法具有较好的选择性。
2.9 双水相气浮溶剂浮选法与双水相萃取法的对比
双水相气浮溶剂浮选法在最佳条件下按1.2.1节方法,计算出浮选率为91.2%;双水相萃取法按1.2.2 节方法,计算出浮选率为17.08%。证明了双水相气浮溶剂浮选法浮选效果要比双水相萃取法好。
2.10 样品测定
分别准确移取模拟水样(样品1),某鱼塘水(样品2)各100 mL,鱼塘水样过滤,水样在2 000 r/min下离心分离15 min,取上层清液,蒸发浓缩至30 mL,用0.45 μm 的滤膜二次过滤,分别按照实验方法操作,并进行回收率实验,结果见表1。

表1 样品中氯霉素含量的检测及加标实验结果(n= 5)Table 1 Determination of CAP content in the samples and the results of standard addition
3 结论
本文用双水相气浮浮选法测定氯霉素含量,并考察了pH 值、浮选时间、氮气流速、氯化钠质量分数等条件对浮选效果的影响,同时对比了双水相气浮浮选法和双水相萃取法的浮选效果。由以上实验结果可知,析相盐氯化钠为饱和溶液时,pH 值为10,氮气流速为25 mL/min,浮选时间为40 min,双水相气浮溶剂浮选法的浮选率为91.2%。
[1] 彭运平,齐维,唐海波,等.应用酶联免疫法检测鱼肉,蜂蜜中氯霉素的残留量[J].现代食品科技,2010,26(12):1415-1417.
[2] 高林,陆怡,史贤明.水产品中氯霉素残留检测技术的研究进展[J].现代农业科技,2009,30(20):340-341.
[3] 王志强,胡国媛.微生物抑制法快速检测鲜奶中多种抗生素残留[J].中国食品卫生杂志,2008,20(2):139-141.
[4] 王亚群,王静雪,林洪,等.发光细菌法检测水产品中氯霉素体系的建立[J].中国海洋大学学报,2009,39(1):66-70.
[5] 朱兰兰.利用发光细菌进行褐牙鲆中氮霉素残留快速检测的研究[J].食品与发酵工业,2007,33(10):155-159.
[6] 王亚群.利用海洋发光细菌进行水产品中氯霉素残留检测的方法研究[D].青岛:中国海洋大学,2008.
[7] 万宇平.快速检测技术在食品安全监管中的应用及发展新方向[J].北京工商大学学报:自然科学版,2011,29(4):1-5.
[8] Samsonova J V,Fedorova M D,Andreeva I P,et al.Characterization of anti-chloramphenicol antibodies by enzymelinked immunosorbentassay[J].Analytical Letters,2010,43(1):133-141.
[9] 陈雪昌,刘琴,钟志,等.酶联免疫法检测虾肉中氯霉素[J].浙江海洋学院学报:自然科学版,2005,24(1):73-76.
[10]程冰.家禽组织中氯霉素残留ELISA 检测与蓄积毒性的研究[D].雅安:四川农业大学,2005.
[11]郝俊虎,王仙琴,闫永利,等.酶联免疫吸附法检测鸡肝肾中氯霉素残留的分析[J].中国家禽,2004,8(1):62-64.
[12]Tajik H,Malekinejad H,Razavi-Rouhani S M,et al.Chloramphenicolresidues in chicken liver,kidney and muscle:A comparison among the antibacterial residues monitoring methods of Four Plate Test,ELISA and HPLC[J].Food and Chemical Toxicology,2010,48(8):2464-2468.
[13] 杨艳艳,张改平,邓瑞广,等.氯霉素残留检测阻断ELISA 试剂盒的研制及性能测定[J].中国预防兽医学报,2007,29(2):130-134.
[14]高茂根,杨瑞章,王太全,等.3 种ELISA 试剂盒检测动物产品中氯霉素残留的应用[J].中国兽药杂志,2009,45(9):57-58.
[15]周焕英,高志贤,孙思明,等.食品安全现场快速检测技术研究进展及应用[J].分析测试学报,2008,27(7):788-794.
[16] Arnold D,Somogyi A.Trace analysis of chloramphenicol residues in eggs,milk,and meat comparison of gas-chromatography and radioimmunoassa[J].Journal of the Association of Official Analytical Chemists,1985,68(5):984-990.
[17]李余动,张少恩,吴志刚,等.胶体金免疫层析法快速检测氯霉素残留[J].中国食品卫生杂志,2005,17(5):416-419.
[18]杨挺,王姝婷,郭逸蓉,等.动物源性食品中氯霉素残留速测金标试纸条的研制[J].中国农学通报,2007,23(11):156-161.
[19]王玮.胶体金免疫法快速检测氯霉素残留[D].天津:天津科技大学,2008.
[20]胥传来,彭池方,郝凯.化学发光酶免疫法测定水产品中残留氯霉素[J].分析化学,2005,33(12):1809.
[21]高彬文,张素霞,沈建忠,等.化学发光酶联免疫法检测鱼虾中氯霉素残留[J].中国兽医杂志,2007,43(5):68-69.
[22]马玲,关忠谊,吴健敏,等.氯霉素残留一步式化学发光酶免疫法的建立[J].南方农业学报,2011,42(2):205-208.
[23]宋巍巍,丁明星,张挪威,等.伏安免疫法检测牛奶中氯霉素残留[J].分析化学,2007,35(12):1731-1735.
[24]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22338—2008 动物源性食品中氯霉素类药物残留量测定[S].北京:中国标准出版社,2008.
[25]尹丽珠,张学忠,冯雷,等.超高效液相色谱-串联质谱法检测禽畜肉中的氯霉素残留[J].云南大学学报:自然科学版,2011,33(3):336-339.
[26]冯雷,张学忠,牛之瑞,等.超高效液相色谱-串联质谱法检测蜂蜜中氯霉素残留[J].食品研究与开发,2010,31(12):181-184.
[27]崔涛,常建军,张雪峰,等.超高效液相色谱-串联质谱法测定牛奶中氯霉素残留[J].理化检验:化学分册,2011,47:970-973.
[28]李丹妮,严凤,张文刚,等.超高效液相色谱-串联质谱法对奶粉中氯霉素残留的检测[J].分析测试学报,2008,27(11):161-163.
[29]Alechaga E,Moyano E,Galceran M T.Ultra-high performance liquid chromatography-tandem mass spectrometry for the analysis of phenicol drugs and florfenicol-amine in foods[J].Analyst,2012,137(10):2486-2494.
[30]刘艳琴,王浩,殷晓燕,等.高效液相色谱-电喷雾离子阱质谱测定乳品中氯霉素、甲砜霉素和氟甲砜霉素残留的研究[J].食品科学,2008,29(4):344-346.
[31] Vesna C F.Performance characteristics of an analytical procedure for determining chloramphenicol residues in muscle tissue by gas chromatography-electron capture detection[J].Biomedical Chromatography,2006,20(10):985-992.
[32]冯桂荷,闫永胜.浮选光度法测定痕量铜[J].光谱实验室,2001,20(5):653-655.
[33]许春萱,司学芝,汪玲.钯(Ⅱ)与铱(Ⅳ)、铜(Ⅱ)、铁(Ⅱ)和镓(Ⅲ)的浮选分离研究[J].河南师范大学学报:自然科学版,2009,37(4):98-100.
[34]马春宏,朱红,姜大雨,等.离子液体溶剂浮选-光度法测定环境水样中痕量铜[J].冶金分析,2011,31(1):74-77.
[35]马金凤.凝胶渗透色谱-气相色谱质谱法测定花生中农药残留[D].泰安:山东农业大学,2012.
[36]戈延茹,曹恒杰,傅海珍.溶剂浮选分离-紫外分光光度法测定环境水样中罗红霉素残留量[J].理化检验-化学分册,2011,47(6):653-658.
[37]董慧茹,王士辉.溶剂浮选分离富集麻黄草中有效成分[J].分析化学,2004,25(4):503-506.
[38]戈延茹,潘如,傅海珍,等.离子液体双水相溶剂浮选法分离/富集桑黄黄酮类成分[J].分析化学,2012,40(2):317-320.

