磷酸根离子选择电极研究进展*
姜涛钦,李琳娜,杨慧中
(江南大学 轻工过程先进控制教育部重点实验室,江苏 无锡214122)
0 引 言
众所周知,磷是动植物等生命体的重要组成成分,是生物体生长发育过程中所需重要的元素之一。水体中磷酸盐含量过多(超过0.2mg/L)会造成海洋、河流及湖泊的富营养化,造成微生物泛滥生长,严重时将耗尽水中氧气,造成鱼类的死亡,对良好的生态环境造成威胁。因此,总磷的检测成为水质监测的一个重要指标。总磷包括无机磷和有机磷,由于无法直接检测各种不同形态磷,需要将水样氧化消解后全部转化为正磷酸盐,再检测其磷酸根含量,然后折算为总磷。目前,各国对磷的检测主要采用传统的磷钼蓝法[1]实现。这种方法的原理是首先用过硫酸钾等氧化剂将待测水样中不同形态的磷氧化消解成正磷酸盐,加入抗坏血酸使溶液环境呈酸性,再加入钼酸铵、酒石酸锑氧钾,与正磷酸盐反应生成磷钼杂多酸后被抗坏血酸还原,生成蓝色的络合物,这种物质在700 nm 波长处有较强的吸收能力[2],再进行比色测定,根据吸光度的强弱测定磷酸盐的含量。
然而,这种方法容易受到砷酸盐、硅酸盐、硫化物和氧化剂的影响,且样品的浑浊程度对检测也会造成一定影响。此外,使用该法进行检测时,需要制备抗坏血酸、钼酸铵等试剂溶液,对试剂加入待测液的操作步骤有着严格的限制,检测后需对废弃的试剂进行安全处理。而且检测时响应时间较慢,不利于水质连续自动监测和现场分析。由此可见,传统的钼酸铵分光光度法测定水中磷酸盐由于操作步骤繁琐,试剂需现用现配,运行维护工作量大,运行成本高。离子选择电极具有检测设备简单、响应速度快、灵敏度高等优点,在医药医学、化学化工、环境保护等领域内有着很广泛的应用。因此,研究开发一种可以在现场实时测定磷酸盐的化学传感器,成为近年来研究的热点和难点。
1 磷酸根离子选择电极的工作原理
磷酸根的检测系统由离子选择电极、参比电极以及待测溶液所组成,测量电路可以等效为一个化学原电池,检测原理如图1 所示。
2 磷酸根离子选择电极的研究现状
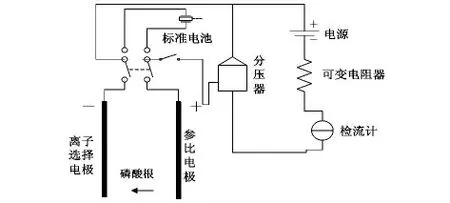
图1 原电池检测原理图Fig 1 Principle diagram of galvanic cell
在测定磷酸根离子浓度的领域中,磷酸根离子正盐主要以三种形式存在,随着溶液pH值的改变,三种正磷酸盐之间相互转换。在温度为25 ℃时,pH 值小于2 时,溶液中大部分以磷酸形态存在,只有少量的磷酸二氢根存在。pH值在4~6 之间时,溶液中磷酸二氢根的比例达80%以上,当pH 值在8~10 时,溶液中则主要以磷酸氢根形态存在。当pH 值大于12 后,溶液中主要以磷酸根形态存在。因此,针对离子选择电极对某一种磷酸根形态具有选择性,在检测时控制pH 对于磷酸根离子的检测具有重要的意义。
目前,在检测水体中磷酸根的化学传感器技术应用中,按选择性膜的构造,离子选择电极有无内充液,可以将磷酸根离子选择电极分为液态电极、固态电极两种。液态磷酸根离子选择电极和固态磷酸根离子选择电极的研究已经取得一定的进展,在磷酸根离子选择载体研究方面亦有较大的进展。
2.1 液态磷酸根离子选择电极
液态离子选择电极是基于膜—水相离子交换的原理,它由三个主要部分构成:敏感膜、内参比溶液以及内参比电极,敏感膜是离子选择电极中最主要的部分。敏感膜是将待测离子的盐类或者螯合物等溶解在不与水混合的有机溶剂中,加入对离子有选择作用的离子载体,再使这种有机溶剂渗入惰性物质制成敏感膜。通常离子载体可与离子形成配合物或者发生反应,使敏感膜产生电位响应,起到检测作用。
1980 年,俄国科学家Zarinskii V A[3]发现在含有氯仿20%正癸醇的磷酸盐水溶液中加入二辛基锡、二氢基二氯化锡、二十二烷基锡的二硝基酸酯溶液,可以与磷酸根离子形成l︰2 金属配合物,可用于制备液态离子选择电极的敏感膜。基于此原理,Scott A[4]和Glazier S A[5],分别在1988 年和1991 年将对甲基苯基二氯化锡、二苯二氯化锡和二苯基锡等二氯化物衍生物与聚氯乙烯(PVC)粉末溶解在有机溶剂中,制成电极敏感膜,在25 ℃时,用Tris—H2SO4调节待测液pH 为7,电极使用前存放在磷酸钾溶液中保存,在48~3.072 mg/L 间对具有良好的选择性,斜率达到-33.0 mV/dec,这种电极对于离子的选择性强弱顺序为,说明硫氰酸根对磷酸根检测影响较大,检测前应排除其干扰。1996 年~1997 年Chen L D[6,7]通过进一步研究,发现可用双核的有机锡制备PVC 膜,根据此方法制成的电极使用前需要在磷酸溶液中预处理3 h,在温度20 ℃,pH 值为7.2 情况下测量含有的待测液,结果表明电极在9.6 g/L~48 mg/L 呈线性,斜率为-30.1 mV/dec,对水中常见离子选择强弱为,这种电极产生电位并稳定的时间为30 s~2 min,使用寿命可达1 个月。
除了使用已有的物质作为磷酸根的离子载体,国外还通过人工合成的方法制备对磷酸根有选择作用的载体。2006 年,Mohammad Ganjali 等人[8]合成一种活性物质命名为MAA,根据此物质制作对敏感的电极,这种电极线性范围为9.6 g/L~9.6 μg/L,斜率为-29.5 mV/dec,检测下限可达5.76 μg/L,具有良好的检测下限。使用此方法制备的电极时,需用缓冲液调节待测溶液pH=8.2,在每天使用1 h 条件下,使用寿命为10 周。2007 年,Francine Kivlehan 等人[9]提出一种参杂杯芳烃的PVC 膜制备磷酸根离子选择电极方法。文章中合成的两种物质分别命名为urea和thiourea 作为磷酸根敏感膜的离子载体。合成物质制成膜后,电极采用0.1 mol/L 的NaH2PO4作为内充液,实验结果表明:电极在9.6 g/L~0.96 mg/L 有线性电位响应,其中,urea 的斜率为-33 mV/dec,thiourea 的斜率为-28 mV/dec。经过对几种常见离子的干扰性研究,发现高氯酸根干扰最大,选择系数达1.78,其它离子选择性强弱顺序为,并且影响较小,选择系数相差2 个数量级。Liu W 等人[10]在2007 年,合成一种大环二茂铁离子载体物质命名为L,制成PVC 膜后,用0.01 mol/L的K2HPO4作为电极内充液,在pH=9 的情况下对在960~0.96 mg/L 浓度的情况下有良好的线性关系,斜率达到-29.8 mV/dec,检测下限是2.1 mg/L,其他离子对磷酸根离子干扰强弱程度顺序为电极响应时间为20 s,使用时间可以达到2 个月之久。Junghwan Kim 等人[11]在2008 年自己合成了一种物质简称TUS,将它制作成敏感膜的离子载体,将0.1 mol/L的磷酸氢二钠跟0.01 mol/L 的氯化钠混合溶液作为内充液,Ag/AgCI 作为内参比电极。使用之前将制备好的电极放在0.1 mol/L 的磷酸氢二钠溶液中浸泡24 h。测量时用NAOH 调节磷酸盐溶液pH=8.2,测量时发现在960~3.1 mg/L 之间对有线性响应,有斜率接近-30.4 mV/dec效果,检测下限达到0.96 mg/L,响应时间为20 s,但是该电极检测时受到Cl-较大影响,且寿命短,不宜长时间使用。2011 年,Nishith R Modi 等人[12]提出一个含有苯基脲取代杯芳烃(命名为BJN)高度选择性敏感的PVC膜,在0.001 mol/L 的K2HPO4作为此电极内充液的情况下,对离子在960 mg/L~5.76 μg/L 浓度范围内可以达到(-29.4±0.3)mV/dec 的斜率,检测下限可达1.92 μg/L,而且响应时间小于8 s,使用时间可以达到15 周。其他离子对磷酸根的干扰情况为干扰较小。2013 年Tonelli D 等人[13]自己合成了水滑石(Mg-Al-HPO4),作为检测磷酸根的离子载体记作HT,并制成薄膜,控制pH 值在4.5~7.8 范围内的情况下对在1.92 g/L~4.8 mg/L浓度的情况下有良好的线性关系,检测下限2.88 mg/L,斜率达到-28.97 mV/dec。上述人工合成物质制成膜的最佳质量比例和检测下限如表1 所示。
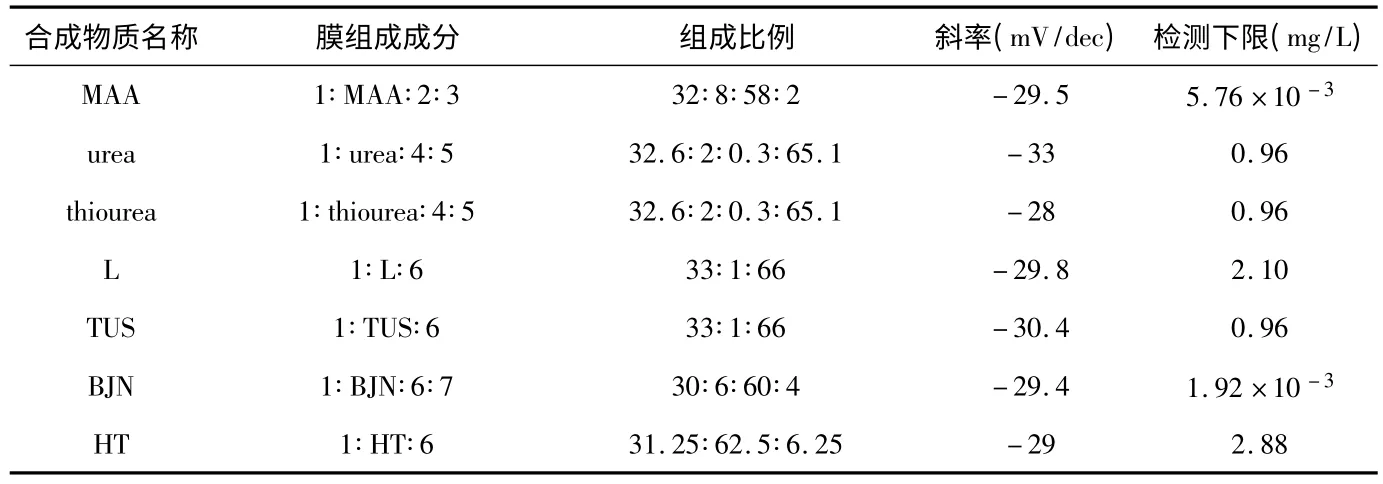
表1 膜组成成分比例Tab 1 Proportion of membrane composition
2.2 固态磷酸根离子选择电极
固体膜电极是以固体作为敏感物质的电极,电极不需要内充液和内参比电极。它包括将混合金属或者金属盐的粉末加压形成的混合物作为对待测离子敏感的电极,或以单晶膜作为敏感膜的电极,或以单一金属制成电极。固态电极是离子选择性电极中种类最多的电极。
根据Meruva R K 和Meyerhoff M E 在1996 年提出的纯钴对磷酸根呈现线性关系理论[14],在磷酸根溶液中,金属钴主要跟磷酸根发生如下反应

磷酸钴的形成,影响了钴电极的检测电位,从而可以测得到电势变化。
俞汝勤、肖丹等人[15],在1994 年以钴制备磷酸根离子选择电极,对在pH 值为4.0 的邻苯二甲酸氢钾为底液时,离子响应线性浓度范围为960~0.96 mg/L,斜率为-55 mV/dec,此固态电极稳定性、重现性和选择性良好,且常见离子对测定不干扰,但电极受水中溶解氧、压力影响较大。肖丹[16]、苏宾[17,18]分别于1998,1999,2000 年根据利用非化学计量化合物的空穴作为主体接受客体物质,依据结合点多少有关的非化学计量化合物的主客化学传感模式这一理论,提出了基于金属钴的合金固态电极。实验结果如表2 所示。
2011 年,董陶[19]、张军军等人[20]提出一种新型基于钴的磷酸根离子选择电极,并将pH 补偿引入电极检测,经过计算在25 ℃时,离子理论斜率为-59.16 mV/dec,离子斜率为-29.58 mV/dec,该电极的监测范围从960~0.96 mg/L。
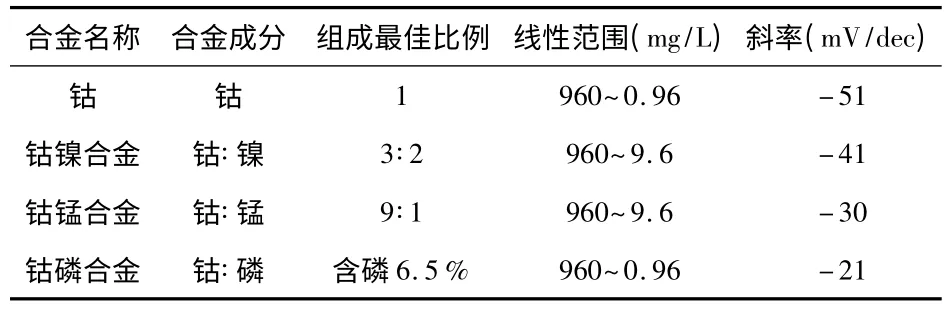
表2 金属固态电极成分比例表Tab 2 Schedule of proportion of metal solid state electrode element
国外Fikru Tafesse 等人[21]在2010 年提出用铝粉、铜粉跟磷酸铝三种物质用液压机在7000 atm 的压力下压20 min,制成一个对磷酸根具有选择性的水晶薄盘。监测范围可以为9 600~0.096 mg/L,检测下限是0.096 mg/L,且电极响应时间为60 s 以内。同年,Wang J J[22]用金属钴材料制作了一种磷酸根离子选择电极。在pH=7.5 的环境下,斜率为59.16 mV,检测下限0.96 mg/L,并且电极具有良好的稳定性。Bobacka J[23]提出一种导电聚合物的传感膜的制备方法,尽管选择性低于传统膜,这种制备离子选择性电极的方法是最简单的,也是当前分析方法发展的重要趋势之一。
由上述可见,无论是液态还是固态的磷酸根离子选择电极,目前大部分研究成果的斜率均为21~30 mV/dec,检测下限大多在mg/L 级,使用寿命和稳定性等都难以达到实际应用的要求,所以,磷酸根离子选择电极将是今后水质检测分析的重点研究方向之一。
3 结束语
水质检测分析一般要求痕量、超痕量的快速分析,所以,在选择性、灵敏度、稳定性等方面对总磷检测提出了更严格的要求。在实际水质检测中,地表水的总磷浓度一般很低,传统方法的检测下限只有0.01 mg/L,不能满足对痕量检测的要求,目前大部分的研究成果是无法用于实际的水质检测的。磷酸根离子选择电极法是一种正在发展中的分析方法,未来对离子选择的研究,主要是对新材料使用的探索。目前液态磷酸根离子选择电极主要以人工合成的离子载体为主,大多合成工艺比较复杂,且合成效果受到外界条件如pH、温度等影响较大。对于制成的离子选择性膜容易受到温度的影响,恶劣的环境中会造成电极失效,所以,液态电极往往使用寿命不长,难以应用于实际环境中。磷酸根离子固态电极使用的是单一金属或者金属合金,使用前大多要进行预处理,检测时生成的产物会附着在电极表面,对下次检测产生严重影响,因此,使用前须进行抛光处理,这就造成了不能连续监测,是一个亟待解决的问题。
上述可知,磷酸根离子选择电极在快速检测、操作难易度等方面相对于传统方法具有明显的优越性。现阶段液态电极比固态电极制作工艺复杂,而且至今还没发现天然的离子载体,人工合成的载体在合成过程中条件严格,操作繁琐,合成具有一定的难度。而固态电极制作简单,易于维护,今后对于磷酸根离子选择电极的研究,寻找合成简单或者天然的离子载体将是今后离子电极的机遇与挑战。
[1] 王海峰,李春燕,刘新侠.钼酸铵分光光度法测定水中总磷的改进消解方法[J].中国给水排水,2009,25(16):81.
[2] Lueck C H,Boltz D F.Indirect ultraviolet speetrophotometric determination of phosphorus[J].Anal Chem,1958,30(2):183-185.
[3] Zarinskii V A,Shpigun L K,Shkinev V M,et a1.Electrochemical properties of dialkyhin(IV)-compound-based liquid membranes in phosphorus(V)solutions[J].Anal Chim(USSR),1980,35(11):2137-42.
[4] Scott A,Glazier Mark A Arnold.Phosphate-selective polymer membrane electrode[J].Analytical Chemistry,1988,60(22):2540-2542.
[5] Glazier S A,Arnold M A.Selectivity of membrane electrodes based on derivatives of dibenzyltin Dichloride[J].Analytical Chemistry,1991,63(8):754-759.
[6] Chen L D,He W C,Shen D L,et al.A PVC membrane electrode sensing phosphate ion based on binuclear organtin[J].Chemical Journal of Chinese Universities,1996,17:1528-1531.
[7] Chen L D,Yang W C,Yu R H,et al.A neutral carrier based phosphate sensor with anti-Hofmeister behavior[J].Chinese Chemical Letters,1997,8:251-254.
[8] Ganjali Mohammad,Reza,Norouzi Parviz,Ghomi,Mahnaz.Highly selective and sensitive monohydrogen phosphate membrane sensor based on molybdenum acetylacetonate[J].Analytica Chimica Acta,2006,567(2):196-201.
[9] Kivlehan F,Mace W J,Moynihan H A,et al.Potentiometric evaluation of calix[4]arene anion receptors in membrane electrodes:Phosphate detection[J].Analytica Chimica Acta,2007,585(1):154-160.
[10]Liu W,Li X,Song M P,et al.A novel dibasic phosphate-selective electrode based on Ferrocene-bearing macrocyclic amide compound[J].Sensors and Actuators B:Chemical,2007,126(2):609-615.
[11]Kim Junghwan,Kang Dong Min,Shin Sung Chul,et al.Functional polyterthiophene-appended uranyl-salophen complex:Electropolymerization and ion-selective response for monohydrogen phosphate[J].Analytica Chimica Acta,2008,614(1):85-92.
[12]Nishith R Modi,Bhargav Patel,Manishkumar B Patel,et al.Menon novel monohydrogenphosphate ion-selective polymeric membrane sensor based on phenyl urea substituted calix[4]arene[J].Talanta,2011,86:121-127.
[13]Tonelli D,Ghorbel S,Colombari M,et al.Monohydrogen phosphate selective electrode based on a synthetic hydrotalcite[J].Journal of Electroanalytical Chemistry,2013,690:25-31.
[14]Meruva R K,Meyerhoff M E.Mixed potential response mechanism of cobalt electrodes toward inorganic phosphate[J].Analytical Chemistry,1996,68(13):2022-2026.
[15]俞汝勤,肖 丹,李 军.一种新的磷酸根离子敏感电极研究[J].高等学校化学学报,1994,15(2):193-194.
[16]肖 丹,俞汝勤,袁红雁.钴镍合金镀层磷酸根离子敏感电极研究[J].化学传感器,1998,18(1):63-66.
[17]王柯敏,苏 宾,袁红雁.钴锰合金磷酸根离子敏感电极研究[J].化学传感器,1999,19(4):33-37.
[18]苏 宾,袁红雁,唐志文,等.基于钴磷合金的磷酸裉离子敏感电极研究[C]∥中南、西南分析化学学术会议论文专集,2000:91-93.
[19]董陶,张军军,杨慧中.磷酸盐离子选择电极的制作及其性能特性[J].自动化仪表,2011(9):60-63.
[20]张军军,杨慧中.一种磷酸根离子选择电极的测量与补偿[J].传感器与微系统,2011,30(4):124-126,130.
[21]Fikru Tafesse,Martin Enemchukwu.Fabrication of new solid state phosphate selective electrodes for environmental monitoring[J].Talanta,2011,83(5):1491-1495.
[22]Wang J J,Bishop P L.Fabrication,calibration and evaluation of a phosphate ion-selective microelectrode[J].Environmental Pollution,2010,158(12):3612.
[23]Bobacka J,Ivaska Ari,Lewenstam Andrzej.Potentiometric ion sensors[J].Chemical Reviews,2008,108(2):329-351.

