组胺H3受体降低电激发收缩的小鼠成肌细胞胞浆中钙离子浓度*
齐 麟,冯 晓,陈 燕,薛 瑞,张 凤,王素云,孙素珂,文建国,3
(1铁道警察学院,河南郑州450053;郑州大学第一附属医院2河南省高校临床医学重点学科开放实验室,3小儿尿动力学中心和泌尿外科,河南郑州450052;4河南大学淮河学院,河南开封475001)
组胺H3受体降低电激发收缩的小鼠成肌细胞胞浆中钙离子浓度*
齐麟1,2,3,冯晓4,陈燕2,3△,薛瑞2,张凤2,王素云2,孙素珂2,文建国2,3
(1铁道警察学院,河南郑州450053;郑州大学第一附属医院2河南省高校临床医学重点学科开放实验室,3小儿尿动力学中心和泌尿外科,河南郑州450052;4河南大学淮河学院,河南开封475001)
[摘要]目的:探讨组胺H3受体(H3R)在小鼠成肌细胞C2C12成肌分化过程及分化后的横纹肌细胞中的表达和可能发挥的作用。方法:诱导C2C12细胞成肌分化,测量H3R和分化晚期标志物肌球蛋白重链mRNA和蛋白的表达;分化过程中加入H3R拮抗剂ciproxifan,测量分化早期标志物desmin、中期标志物myogenin和肌球蛋白重链mRNA的表达。Fluo-4结合剂标记分化后的横纹肌胞内钙离子,测量双极交流电200 mA刺激下,H3R激动剂甲基组胺(RMeHA)对胞浆中钙离子浓度的影响。结果: H3R和肌球蛋白重链在成肌分化过程中表达量逐渐增加。Ciproxifan在成肌分化过程中对3种分化标志物mRNA的表达与对照组相比无差异(P>0.05)。RMeHA在浓度10 nmol/L~100 μmol/L刺激细胞5~20 min,可呈钟形降低因交流电引起的肌浆钙离子浓度的升高(P<0.05),其中RMeHA 100 nmol/L在10 min和20 min对电刺激细胞中Ca(2+)的抑制百分率最高。相同浓度的RMeHA 在20 min和10 min时对Ca(2+)的抑制率比其在5 min时高(P<0.05)。结论: H3R可能在成肌分化过程中的作用不大,而在分化成熟细胞中可以降低电刺激引起的胞浆钙离子浓度的升高。
[关键词]成肌分化;组胺H3受体;电刺激;钙离子
[修回日期]2015-02-02
Histamine H3 receptor inhibited electrically evoked cytoplasmic calcium in differentiated skeletal C2C12 myoblasts
QI Lin1,2,3,FENG Xiao4,CHEN Yan2,3,XUE Rui2,ZHANG Feng2,WANG Su-yun2,SUN Su-ke2,WEN Jian-guo2,3
(1Railway Police College,Zhengzhou 450053,China;2Institute of Clinic Medicine,3Peadiatric Urodynamic Center and Department of Urology,The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China;4Huaihe Hospital of Henan University,Kaifeng 475001,China.E-mail: chenyan.abby@163.com)
[ABSTRACT]AIM: To explore the expression and possible function of histamine H3 receptor (H3R) in striated myogenesis and the differentiated C2C12 cells.METHODS: H3R and myogenesis late marker myosin heavy chain (MHC) were detected at mRNA and protein levels during C2C12 myogenesis.H3R antagonist ciproxifan was added and the expression of the myogenesis early marker desmin,intermediate markers myogenin and MHC was detected.Differentiated myoblasts were loaded with Fluo-4 calcium indicator dye and the effect of R-(a) -methylhistamine (RMeHA) on the cytoplasmic calcium concentration was determined under the 200 mA electrical stimulation.RESULTS: The expression of H3R and MHC was increased during myogenesis.Ciproxifan incubation had no influence on the 3 striated myogenesis markers (P>0.05).In C2C12 myoblasts,RMeHA (10 nmol/L~100 μmol/L) effectively diminished cytoplasmic calcium peak when the cells were electrically paced (P<0.05).The best inhibitory effect of RMeHA was observed at dose of 100 nM for 10 min and 20 min,which was higher than that for 5 min (P<0.05).CONCLUSION: H3R might have little effect on the myogenic differentiation,but diminishes cytoplasmic calcium peak of the differentiated myoblasts under electrical stimulation.
[KEY WORDS]Myogenesis; Histamine H3 receptor; Electrical stimulation; Calcium ion
人们最早是在大脑中发现组胺H3受体(H3 receptor,H3R)的,它控制组胺的释放,参与脑内多种神经递质的调控[1-2]。随后发现组胺H3R可在周围神经组织和非神经系统表达,如心、肺、气管、消化道、子宫、逼尿肌等表达。在心脏交感神经细胞突出前膜中,组胺受体(histamine receptor,HR)的亚型H3R可以抑制钙离子内流,减低细胞内钙离子浓度[3]。H3R还可以防止气道过度收缩[4]。Cardell等[5]报道了低的组胺浓度可以作为一种有效的松弛剂,在平滑肌细胞可能是通过激动H3R发生抑制H1R的效果。随后在膀胱逼尿肌(平滑肌)细胞中也发现了H3R的表达,并且可能参与了细胞胞浆中钙离子的活动[6-7]。然而,目前H3R在横纹肌成肌细胞分化过程和分化后的表达和功能,尚无相关报道。因此我们将首次探讨H3R是否参与成肌分化过程,以及在分化后的横纹肌细胞中是否像在其它细胞中一样,参与调节胞浆中钙离子浓度。
材料和方法
1细胞来源与培养
小鼠成肌细胞C2C12 (ATCC)培养在37℃、5% CO2和湿润空气的培养箱中。细胞生长液为DMEM培养基内添加10%胎牛血清(HyClone)、10 000 U/L青霉素、100 mg/L链霉素和左旋谷氨酸;细胞分化液为DMEM液内添加1%胎牛血清、10 000 U/L青霉素、100 mg/L链霉素和左旋谷氨酸。传代时用0.5 mmol/L EDTA(含0.5%胰蛋白酶; Gibco)消化贴壁细胞。
2主要材料与试剂
细胞培养液及其配方购于Lonza;各分化标志物引物购于Oligomer; H3R与MHC兔抗人多克隆IgG抗体购于Cell Signaling;无免疫性兔IgG购于R&D; Alexa Fluor488-偶联驴抗兔免疫球蛋白购于Life Technologies;驴血浆购于Jackson; 4,6 -二脒-2-苯基吲哚(DABI)显色试剂盒和Fluo-4钙离子示踪剂购于Invitrogen; Ciproxifan和RmeHA购于Sigma。
3实验方法
3.1 Real-time PCR每孔50 000个C2C12细胞加入12孔培养板中,加入生长液增殖,每24 h换1次生长液。48 h后将生长液换成分化液进行分化,每天换1次分化液。分别测量分化前、分化后2 d、4 d、6 d的细胞中各分化标志物和4种组胺受体亚型mRNA的表达。按操作说明书提取细胞总RNA。RNA纯度和浓度的测定均用分光光度计完成,取1.5 μL总RNA溶液,DEPC水作为空白对照,吸光度值为0,分别读取紫外分光光度仪在260 nm和280 nm波长下的吸光度(A),计算A260/A280比值。纯净RNA样本的该比值正常范围为1.8~2.2。取紫外分光光度仪波长为260 nm下的吸光度值,系统软件自动计算出RNA浓度(g/L)。抽提450 μg(约2~3 μL)总RNA样本至无菌的RNase-free的0.5 mL EP管中,加入4 μL 5×iscript Mix,iscript逆转录酶,iscript去核酸酶蒸馏水,总反应体积20 μL,置入载有专门cDNA合成软件的加热仪器中,25℃5 min,42℃30 min,85℃5 min,最后保持在4℃。取cDNA 2 μL、5×SYBR Mix缓冲液(含dNTPs、Tag酶等) 10 μL、上下游引物(5 μmol/L) 1 μL、双蒸水7 μL加入PCR合成管中,总反应体积20 μL,4 000 r/min离心2 min混匀后将放入PCR仪中。PCR反应条件: 94℃5 min;94℃30 s,59℃30s,72℃40 s,共35个循环;72℃5 min,冰上骤冷。本实验采用胆色素原脱氨酶(porphobilinogen deaminase,PBGD)为内参照。Real-time PCR的引物序列见表1。

表1 Real-time PCR引物序列Table 1.The sequences of the primers for real-time PCR
3.2细胞免疫荧光染色C2C12成肌细胞加入用直径13 mm圆形盖玻片覆盖的24孔培养板中,每孔约20 000个细胞,加入生长液增殖,每24 h换1次生长液。48 h后将生长液变成分化液分化,每天换1次分化液。分别取分化前、分化后2 d、4 d、6 d的细胞进行免疫荧光染色。细胞用4%多聚甲醛固定,0.5% Triton X-100/PBS破膜,暴露抗原;驴血浆常温屏蔽非特异抗原,加入I抗工作液(H3R抗体和MHC抗体)或者阴性对照无免疫性兔IgG置于4℃冷藏室内过夜。PBS液清洗细胞后,加入II抗工作液(Alexa Fluor488-偶联驴抗兔免疫球蛋白),室温下孵育1 h;加入DAPI液进行细胞核染色。清洗细胞后,使用vectshield胶将染色标本封闭在载玻片上。Leica DM 6000 B/M显微镜滤过波长为488 nm,Leica DFC 420数码相机获取图片,Leica Suite荧光应用软件分析处理图片。细胞核染色为天蓝色,C2C12细胞胞浆或胞膜出现翠绿色荧光染色为阳性。
3.3H3R拮抗剂对成肌分化标志物的影响C2C12成肌分化过程中,在细胞分化液中每天加入H3R拮抗剂ciproxifan 100 nmol/L。分析ciproxifan刺激组和对照组(未加ciproxifan刺激)中成肌分化早期标志物desmin,中期标志物myogenin和晚期标志物肌球蛋白重链在分化6 d后mRNA的表达差异,从而验证H3R是否在分化过程中发挥作用。
3.4分化成熟的肌肉细胞胞浆中钙离子浓度的测定将载有分化6 d的C2C12细胞的盖玻片放入4 μmol/L Fluo-4 AM (Invitrogen)钙离子示踪剂Elliot溶液中,室温下加载示踪剂30 min,Elliot缓冲液清洗。将细胞转移到装载有双极电极刺激装置和倒置IX70显微镜的37℃恒温RC-49MFS记录盒中,调整波长为488 nm,观测细胞内荧光强度。记录静息状态下细胞胞浆中钙离子荧光强度,然后用0.5 Hz、10 ms双极电流200 mA刺激细胞20 s,记录胞浆中钙离子浓度峰值。加入不同浓度(1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L和100 μmol/L)的H3R激动剂甲基组胺(R-a-methylhistamine,RMe-HA),分别静置5 min、10 min和20 min后,双极电流200 mA刺激细胞20 s,记录胞浆中钙离子浓度峰值变化情况。
使用匹配的HCImage软件ics K.定量分析示踪剂荧光强度并除去背景干扰,转换成钙离子浓度。以自身静息状态下胞浆中钙离子浓度或者细胞本身自然放射性强度作为自身空白对照。电刺激下胞浆中钙离子浓度峰值作为自身阳性对照。以Elliot溶液代替H3R激动剂RMeHA作为阴性对照。
4统计学处理
实验数据用均数±标准差(mean±SD)表示,应用SPSS 13.0统计软件分析。两样本均数比较采用t检验,以P<0.05为差异有统计学意义。
结果
1在成肌分化过程中C2C12细胞形态变化和H3R的表达
分化前的C2C12成肌细胞为散在圆形或者椭圆形,贴壁,单核,直径10 μm。当细胞进入分化阶段,细胞之间靠拢接触,按照同一方向排列融合,在分化6 d后,细胞为多核,长柱型,纵向直径达到150 μm。
晚期分化标志物MHC mRNA在分化过程中一直处于增长状态,分化2 d、4 d、6 d后,表达量分别为未分化的肌母细胞的7 168、89 487、279 897倍,各分化阶段表达量之间有明显差异(P<0.01)。组胺H3R的mRNA在未分化肌母细胞的表达很低,但是随着成肌分化表达逐渐增高,在分化2 d、4 d、6 d后的表达量是未分化母细胞的26、91、182倍,各分化阶段表达量之间有明显差异(P<0.01),见图1。H3R和MHC蛋白的免疫荧光染色在未分化肌母细胞中与对照组一样,呈阴性;分化6 d后,染色显示为强阳性,见图2。
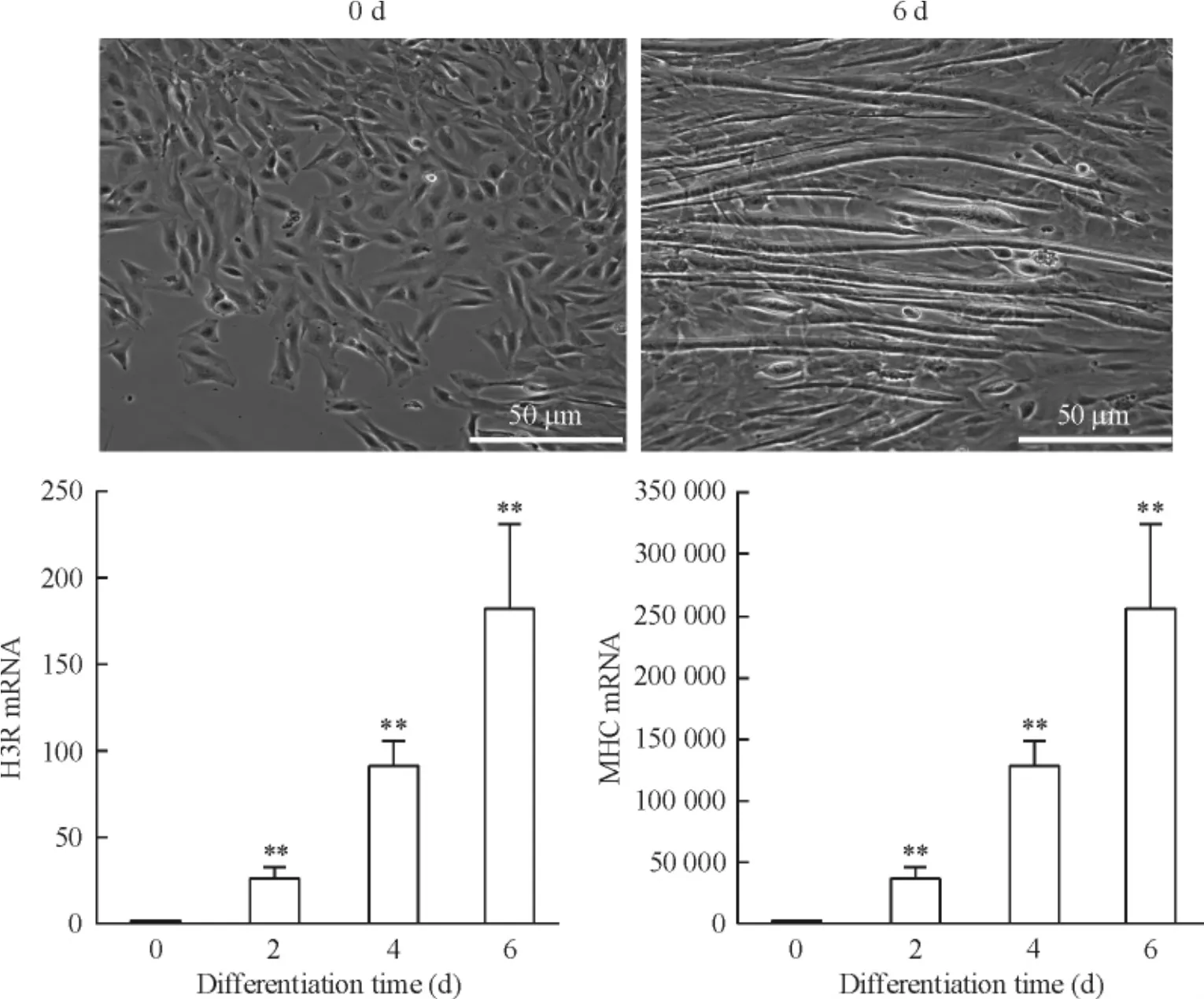
Figure 1.The morphologic change of the C2C12 cells and quantitative measurements of myosin heavy chain (a late marker) and histamine H3 receptor mRNA expression in C2C12 cells by real-time PCR.Mean±SD.n=3.**P<0.01 vs 0 d.图1在成肌分化过程中C2C12细胞形态变化和H3R、MHCmRNA的表达
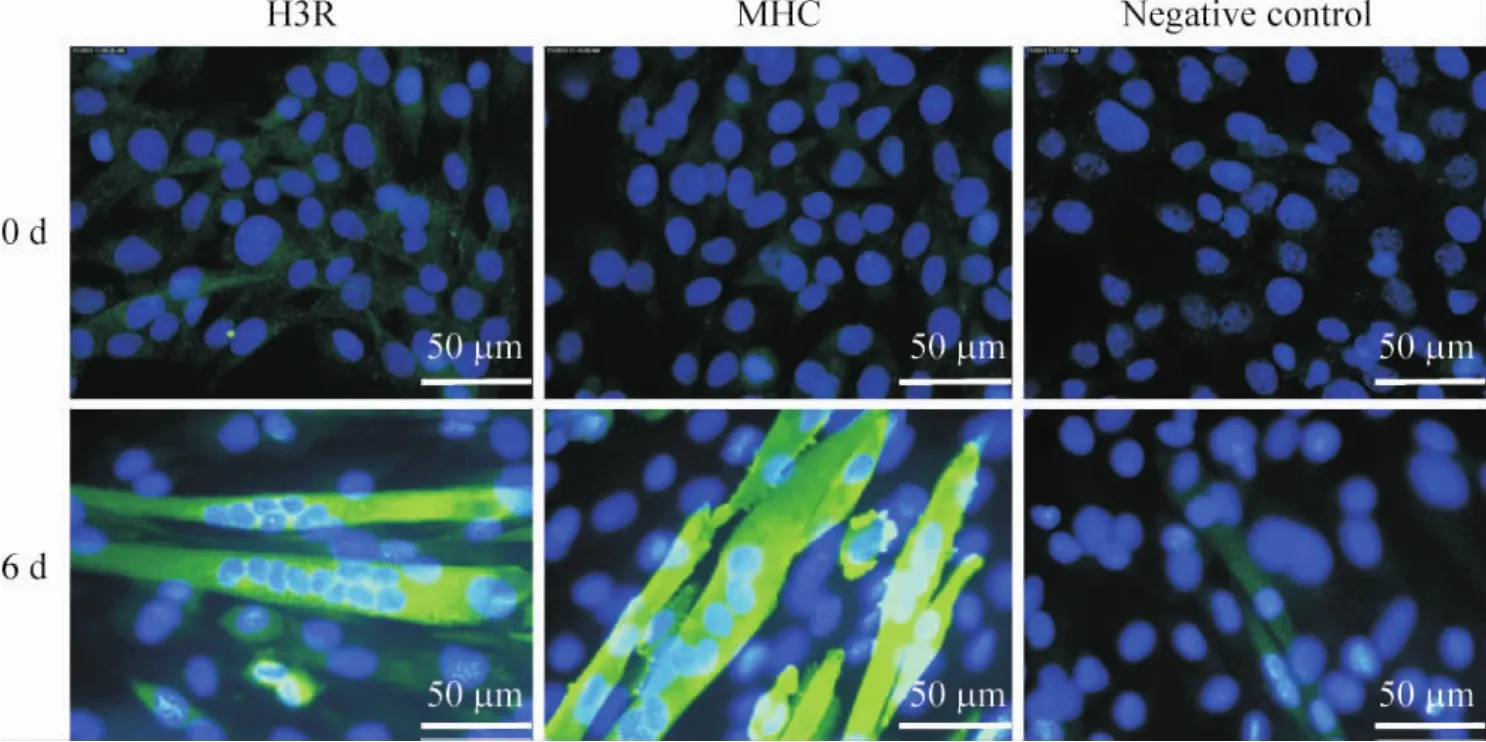
Figure 2.Immunofluorescence staining of H3R and MHC at 0 and 6 d.图2 H3R与MHC的免疫荧光染色
2 H3R拮抗剂不影响成肌分化过程中标志物的表达
H3R拮抗剂ciproxifan加入C2C12细胞成肌分化6 d后,早期标志物desmin、中期标志物myogenin 和MHC的mRNA表达与对照组无明显差异,见图3。
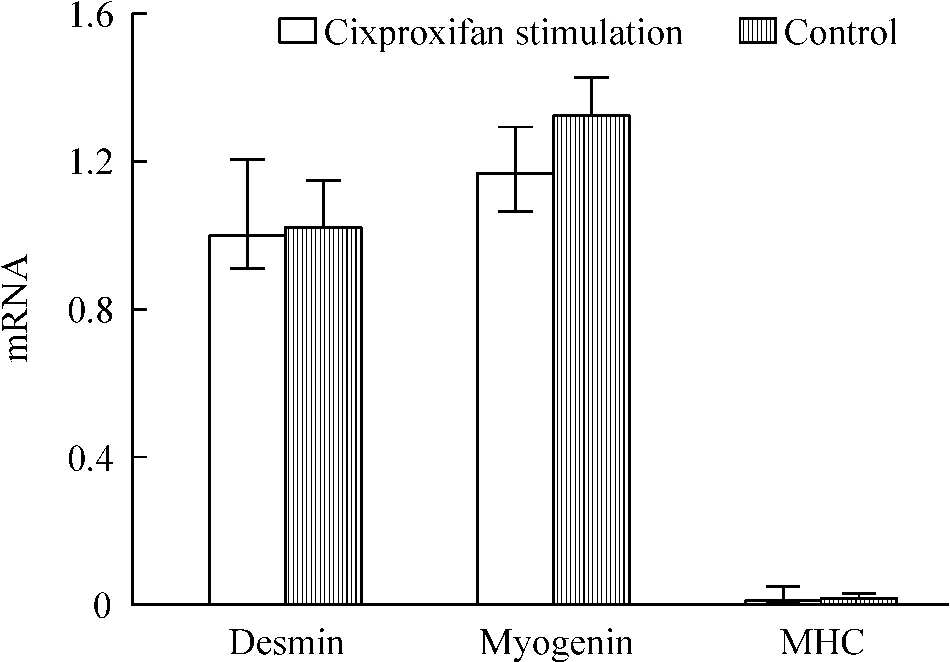
Figure 3.The effect of ciproxifan on the mRNA expression of myogenesis markers in the 6 d differentiated C2C12 cells.Mean±SD.n=3.图3 Ciproxifan加入C2C12细胞成肌分化6 d后早中晚期标志物mRNA的表达
3 H3R激动剂RMeHA对收缩的肌肉细胞肌浆中钙离子峰值的影响
阴性对照组及低浓度RMeHA (1 nmol/L)组中细胞胞浆中钙离子浓度峰值在电刺激5 min、10 min、20 min均未见明显差异。当RMeHA浓度为10 nmol/L~100 μmol/L时,刺激5 min、10 min和20 min均能明显降低胞浆中钙离子峰值,而浓度为100 nmol/L的RMeHA在10 min和20 min对电刺激细胞中Ca2+的抑制百分率最高。整体看来,同一浓度的RMeHA对Ca2+的抑制效果,在20 min内,随着时间的增加而稍有增加,即在20 min时所见到的抑制效果比在5 min时有所增加,但差异无统计学意义,见图4。
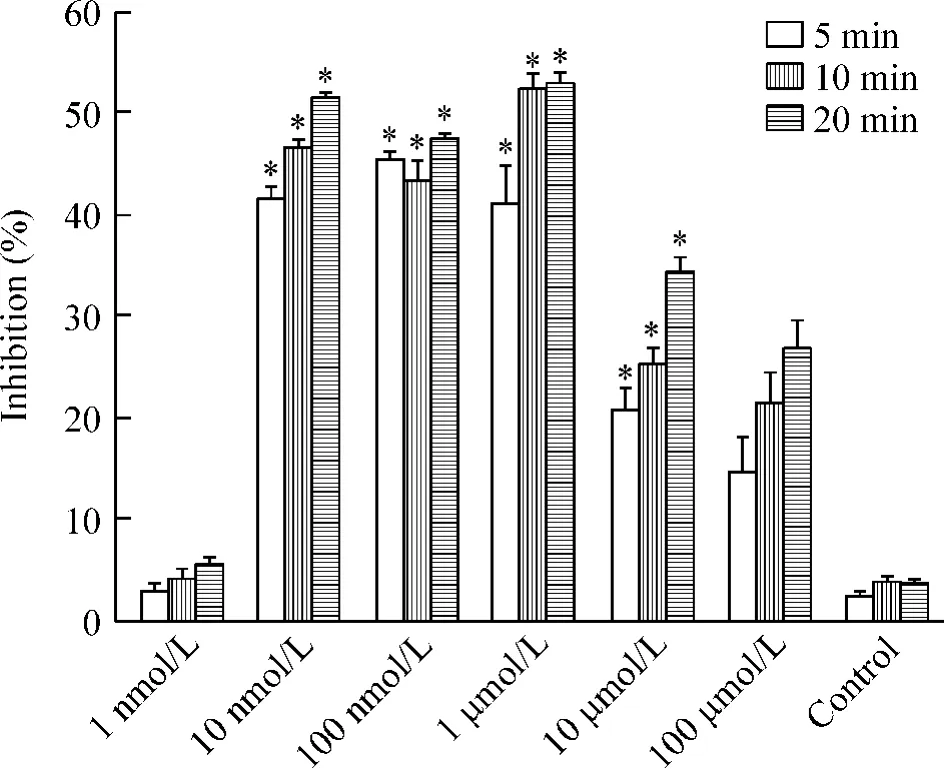
Figure 4.The inhibitory effects of R-(a) -methylhistamine (RMeHA) on the cytoplasma calcium concen-tratior under the electrical stimulation.Mean±SD.n=3.*P<0.05 vs control group.图4甲基组胺对电刺激下的肌细胞胞浆中钙离子浓度的抑制百分率
讨论
我们的研究率先发现了C2C12成肌干细胞分化为横纹肌的过程中,能够表达H3R的mRNA及其蛋白质,并且H3R的表达与MHC一致,随着分化过程呈百倍增加。我们随后又对H3R做了功能的初步测试,首次探讨H3R在成肌分化过程中是否影响分化标志物的表达,以及在分化后的横纹肌细胞中是否参与调节胞浆中钙离子浓度。在C2C12成肌分化过程中,我们采用H3R拮抗剂ciproxifan刺激分化中的细胞,发现3种分化标志物的mRNA表达与对照组无差异,从而初步验证了H3R可能在分化过程中作用不大。因此H3R的作用很可能是在分化后的横纹肌细胞中发挥功能。由于横纹肌细胞最突出的特点是由钙离子启动的收缩-舒张功能,因此我们测试了H3R对收缩的横纹肌细胞胞浆中钙离子的影响。以往的研究报道也证实我们的设想是合理的,如H3R在脑内参与多种神经递质的调控,被活化后,通过Gi蛋白抑制腺苷酸环化酶,减少环磷酸腺苷(cyclic adenosinemonophosphate,cAMP)的生成,或经Gi蛋白抑制N型Ca2+通道,降低神经细胞Ca2+内流量,从而减少组胺的释放[8];在外周器官中,如心脏交感神经细胞突出前膜中,活化的H3R可以降低细胞中cAMP,抑制钙离子内流,减低细胞内钙离子浓度,从而抑制去甲肾上腺素的胞吐[3];在豚鼠十二指肠、回肠和结肠纵肌标本上,RMeHA浓度依赖性抑制电场刺激诱发的乙酰胆碱(acetylcholine,ACh)释放所致的肠管平滑肌收缩[9]; RMeHA浓度依赖性抑制电场刺激诱发的豚鼠和人离体气管平滑肌胆碱能性收缩[10]; H3R受体在外周血管有分布,作用是松驰血管平滑肌,降低血管通透性[11]; H3R在膀胱逼尿肌细胞中影响钙离子的活动[7]。
人体细胞内的游离钙主要储存于内质网内,内质网钙库作为胞内最大的Ca2+储存库,对维持胞内Ca2+动态平衡起关键作用[12]。一般认为横纹肌细胞内质网上的兰尼受体和三磷酸肌醇受体影响钙的流动。当细胞膜上的G蛋白偶联受体激活,可以引起细胞内cAMP改变,导致磷酸化酶的活性升高或者降低,进而使下游的受体或者效应单位(如兰尼受体)磷酸化或者去磷酸化,进而开放或者关闭肌浆网的钙离子通道,改变胞浆中的Ca2+浓度。cAMP可以通过cAMP依赖性蛋白激酶(cAMP-dependent protein kinase,PKA)促进平滑肌松弛,降低胞浆内钙浓度[13]。另有研究证明激活或者抑制三磷酸肌醇受体同样可以动员或者阻止肌浆网释放钙离子,使胞浆中Ca2+增加或者减少[14-15]。H3R早已经被证实为G蛋白偶联受体,可以通过Gi蛋白抑制腺苷酸环化酶,减少cAMP的生成,因此横纹肌细胞中H3R被活化后,很有可能降低了细胞cAMP合成,并从而抑制兰尼受体或者三磷酸肌醇受体,降低内质网中Ca2+流入胞浆中。
在我们的研究中,采用了Fluo-4指示剂动态测量细胞的Ca2+浓度,Elliot缓冲液作为阴性对照,测试时间从加入缓冲液1 min到60 min,每隔5 min作为1个时点,刺激细胞和测量细胞内钙离子浓度变化,发现大部分细胞在30 min前,指示剂的衰减很少,几乎所有细胞在加入缓冲液20 min前无衰减。因此我们选用了加入刺激试剂20 min前测试其对细胞中钙的影响,并且设置了5 min、10 min、20 min 3个时点,大体测试RMeHA发挥作用的最佳时点。结果发现同一浓度的RMeHA对Ca2+的抑制效果,在20 min内,随着时间的增加而稍有增加,即加入RMeHA 20 min后是RMeHA抑制作用的最佳时点。我们发现最低浓度(1 nmol/L)的H3R激动剂RMe-HA,对收缩细胞胞浆中钙离子峰值无明显影响,这主要是由于该浓度过低,可能低于了RMeHA能发挥作用的最低浓度。RMeHA 100 μmol/L对收缩细胞胞浆中钙离子峰值的抑制作用反而较中等浓度100 nmol/L低,可能由于与H3R功能相反的通路被激活(如H1R或者H2R),抵消了RMeHA对钙离子的抑制作用。
总之,我们的研究发现H3R在成肌分化过程中可能对分化作用不大,而在分化成熟细胞中可以降低电刺激引起的胞浆钙离子浓度的升高,说明其可能减低成熟细胞的收缩作用,维持细胞的抗疲劳或松弛作用。
[参考文献]
[1]Drutel G,Peitsaro N,Karlstedt K,et al.Identification of rat H3 receptor isoforms with different brain expression and signaling properties[J].Mol Pharmacol,2001,59(1) :1-8.
[2]Morisset S,Rouleau A,Ligneau X,et al.High constitutive activity of native H3 receptors regulates histamine neurons in brain[J].Nature,2000,408(6814) : 860-864.
[3]Silver RB,Poonwasi KS,Seyedi N,et al.Histamine H3-receptor-induced attenuation of norepinephrine exocytosis: a decreased protein kinase a activity mediates a reduction in intracellular calcium[J].Proc Natl Acad Sci U S A,2002,99(1) :501-506.
[4]Schneider E,Rolli-Derkinderen M,Arock M,et al.Trends in histamine research: New functions during immune responses and hematopoiesis[J].Trends Immunol,2002,23 (5) :255-263.
[5]Cardell LO,Uddman R,Edvinsson L.Evidence for multiple endothelin receptors in the guinea-pig pulmonary artery and trachea[J].Br J Pharmacol,1992,105(2) : 376-380.
[6]Neuhaus J,Oberbach A,Schwalenberg T,et al.Cultured smooth muscle cells of the human vesical sphincter are more sensitive to histamine than are detrusorsmooth muscle cells[J].Urology,2006,67(5) :1086-1092.
[7]Neuhaus J,Weimann A,Stolzenburg JU,et al.Histamine receptors in human detrusor smooth muscle cells: physiological properties and immunohistochemical representation of subtypes[J].World J Urol,2006,24(2) : 202-209.
[8]Raddatz R,Hudkins RL,Mathiasen JR,et al.CEP-26401 (irdabisant),a potent and selective histamine H3 receptor antagonist/inverse agonist with cognition-enhancing and wake-promoting activities[J].J Pharmacol Exp Ther,2012,340(1) :124-133.
[9]Zavros Y,Mesiwala N,Waghray M,et al.Histamine 3 receptor activation mediates inhibition of acid secretion during Helicobacter-induced gastritis[J].World J Gastrointest Pathophysiol,2010,1(5) :154-165.
[10]Jung SY,Shin SY,Eun YG,et al.Changes of histamine receptors and CC chemokines in nasal epithelial cells and fibroblasts after respiratory syncytial virus infection[J].Am J Rhinol Allergy,2013,27(1) : e17-e21.
[11]Hossen MA,Fujii Y,Sugimoto Y.Histamine H3 receptors regulate vascular permeability changes in the skin of mast cell-deficient mice[J].Int Immunopharmacol,2003,3(12) :1563-1568.
[12]Carrasco MA,Jaimovich E,Kemmerling U,et al.Signal transduction and gene expression regulated by calcium release from internal stores in excitable cells[J].Biol Res,2004,37(4) :701-712.
[13]Sanborn BM,Ku CY,Shlykov S,et al.Molecular signaling through G-protein-coupled receptors and the control of intracellular calcium in myometrium[J].J Soc Gynecol Investig,2005,12(7) :479-487.
[14]Ebashi S,Lipmann F.Adenosine triphosphate-linked concentration of calcium ions in a particulate fraction of rabbit muscle[J].Biochem Biophys Res Commun,2008,369 (1) :1-12
[15]Blaauw B,Del Piccolo P,Rodriguez L,et al.No evidence for inositol 1,4,5-trisphosphate-dependent Ca2+release in isolated fibers of adult mouse skeletal muscle [J].J Gen Physiol,2012,140(2) :235-241.
通讯作者△Tel: 0371-66295215; E-mail: chenyan.abby@163.com
*[基金项目]国家自然科学基金资助项目(No.U1304804)
[收稿日期]2014-11-07
[文章编号]1000-4718(2015)06-1115-06
[中图分类号]R337.2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.026

