金黄色葡萄球菌表面蛋白nEBPS抗体的制备和纯化
锡林高娃, 薛晓阳, 吴金花, 布日额
(1.内蒙古民族大学生命科学学院,内蒙古 通辽 028400;2.内蒙古民族大学乳源性致病菌研究所,内蒙古 通辽 028400)
金黄色葡萄球菌(Staphylococcus aureus)是一种 重要的人畜共患致病菌。人感染该菌可引发肺炎、盆腔炎、心包炎、产褥感染等,甚至是脓毒症、败血症等全身性感染[1-2]。在动物则引发奶牛乳腺炎,其检出率可达到30%以上[3],导致牛奶产量减低,乳中含有致病菌及其毒素,乳腺纤维化和奶牛淘汰等后果,从而给奶牛业带来巨大经济损失[4-7]。目前我国奶牛乳腺炎尚未引起重视,缺乏快速检测预警机制和技术支持[8]。因此研究和建立牛乳中致病性金黄色葡萄球菌的快速分子检测方法,对于该病菌的预警性监测、溯源和传播机制研究等都具有十分重要意义。
致病性金黄色葡萄球菌弹性纤维结合蛋白(EBPS)是其致病机制中的关键因子,该致病菌主要是通过其菌体表面的EBPS与宿主的细胞外基质相结合,继而引起宿主感染[9]。EBPS基因组全长基因序列含有1 486 bp,所编码的EBPS蛋白质分为N端、3个疏水区和C端,其中N端的59个氨基酸全部暴露在细胞膜外,在侵染宿主的过程中起配体作用,与金黄色葡萄球菌的致病性密切有关[10]。因此,我们选择该基因N端的粘附配体序列作为靶标片段,通过对靶片段序列的外源性表达,制备相应抗体,为研究其致病机制以及建立快速分子检测方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒、血清及动物 pET30a-nEBPS重组质粒由内蒙古民族大学乳源性致病菌研究所构建并提供,表达宿主菌株BL21(DE3)、牛源金黄色葡萄球菌阳性血清均由内蒙古民族大学乳源性致病菌研究所保存。新西兰白兔购自青岛康大兔业发展有限公司。
1.1.2 主要试剂 辣根过氧化物酶(HRP)标记兔抗牛IgG抗体、辣根过氧化物酶(HRP)标记山羊抗兔IgG抗体、弗氏完全佐剂、弗氏不完全佐剂为Sigma公司产品,多功能DNA纯化回收试剂盒、细菌基因组DNA提取试剂盒、高纯度质粒小量制备试剂盒为北京百泰克生物技术有限公司产品,双色预染蛋白Marker为天根生化科技(北京)有限公司产品。HiTraPTM抗体纯化柱购自GE公司。
1.2 方法
1.2.1 pET30a-nEBPS的诱导表达 将pET30anEBPS重组质粒转化表达菌BL21感受态细胞,以终浓度为0.8 mmol/L的IPTG进行诱导表达,同时设立未诱导菌对照。诱导6 h后,收集菌体,进行SDS-PAGE电泳分析。
1.2.2 nEBPS重组蛋白的纯化 超声波破碎6 h的菌体,收集离心后的上清液和沉淀进行 SDSPAGE电泳分析,鉴定目的蛋白质的表达形式。对以可溶形式表达的重组蛋白按Ni NTA Purification System使用说明进行纯化。
1.2.3 nEBPS重组蛋白的鉴定 纯化的重组蛋白经SDS-PAGE后,转印至硝酸纤维素膜,以5%脱脂奶粉37℃封闭2 h,以牛源金黄色葡萄球菌阳性血清(1∶100稀释)为一抗,37℃孵育1 h,以辣根过氧化物酶(HRP)标记兔抗牛IgG抗体(1∶5 000稀释)为二抗,37℃孵育50 min,在二氨基联苯胺(DAB)溶液中显色。
1.2.4 兔抗nEBPS蛋白多克隆抗体的制备 取纯化的nEBPS蛋白2 mg,与等体积的弗氏完全佐剂进行乳化,背部皮下多点免疫新西兰白兔,14 d后取纯化的蛋白质与弗氏不完全佐剂乳化后进行第2次免疫,14 d后进行第3次免疫,14 d后注射不加佐剂的抗原2 mg进行加强免疫,7 d后经心脏采血,分离血清备用。每次免疫前均采集血清,间接ELISA法检测血清效价。
1.2.5 兔抗nEBPS蛋白抗体效价的测定
1.2.5.1 间接ELISA方法 以纯化的nEBPS重组蛋白包被酶标板,以免疫前兔血清作为阴性对照血清,将抗nEBPS兔血清和阴性对照血清同时进行1∶100~1∶51 200倍比稀释,以HRP标记的山羊抗兔IgG(1∶5 000稀释)为二抗,进行间接ELISA试验,以免疫血清OD值与阴性对照血清OD值的比值大于2.1判为阳性。
1.2.5.2 凝集试验 将抗nEBPS兔血清进行1∶2~1∶512倍比稀释,分别与同一金黄色葡萄球菌菌体进行凝集试验,同时以免疫前兔血清作为阴性对照,判定能够凝集的最高稀释度。
1.2.6 多克隆血清的纯化 将兔抗nEBPS蛋白多克隆血清8倍稀释样品以12 000 r/min离心5 min,取上清液经0.45 μm微孔滤膜过滤。参照HiTraPTM抗体纯化柱子说明书进行纯化。平衡柱子:流速1 ml/min,用5~10倍柱体积的平衡液平衡柱子;上样:流速1 ml/min,上样后用5~10倍柱体积的上样缓冲液洗杂,流速1 ml/min;洗脱:流速1.5 ml/min,用洗脱缓冲液直接洗脱;调pH值:将洗脱样品用中和缓冲液调pH值为中性备用。
1.2.7 纯化抗体的鉴定 采用Bradford法测定纯化后抗体的浓度。取纯化后的抗体进行SDS-PAGE电泳分析,检测纯度。间接ELISA法检测效价,以纯化的nEBPS重组蛋白包被酶标板,以免疫前兔血清作为阴性对照血清,检测纯化后的兔抗nEBPS兔血清效价。
2 结果与分析
2.1 pET30a-nEBPS的诱导表达与纯化
以终浓度为0.8 mmol/L的 IPTG对 pET30anEBPS诱导表达6 h后,超声波破碎细胞,经SDSPAGE电泳分析发现目的蛋白质大部分以可溶形式表达(图1)。采用镍离子亲和层析法纯化蛋白质,Bradford法测定纯化后的蛋白质浓度为2.16 mg/ml。
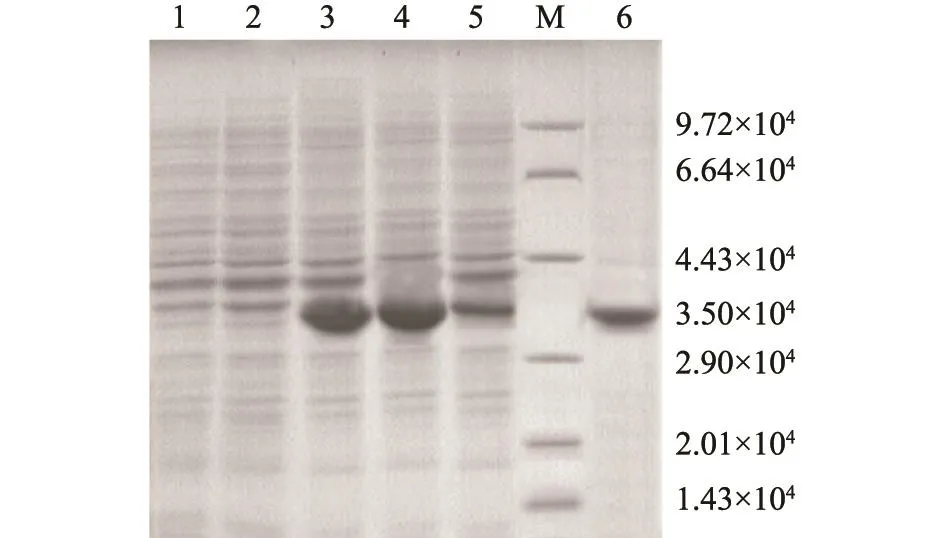
图1 nEBPS重组蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of recombinant protein nEBPS
2.2 nEBPS重组蛋白的活性
取纯化的nEBPS重组蛋白,经SDS-PAGE电泳后,转印至硝酸纤维素膜,与牛源金黄色葡萄球菌阳性血清作用。结果表明,该nEBPS蛋白能与牛源金黄色葡萄球菌阳性血清发生特异性反应,而空载体菌表达蛋白与牛源金黄色葡萄球菌阳性血清不发生反应(图2)。
2.3 兔抗nEBPS蛋白多克隆抗体的效价
纯化后的nEBPS重组蛋白经过4次免疫新西兰白兔后,血清效价已明显升高(图3)。心脏采血分离血清,以间接ELISA和凝集试验测定最后分离的高免血清效价。结果表明,间接ELISA检测到的最低效价达1∶25 600(图4),凝集试验测定的凝集效价达1∶128。
2.4 多克隆血清的纯化及纯化抗体的鉴定

图2 表达产物的免疫印迹分析Fig.2 Western blot of expressed products
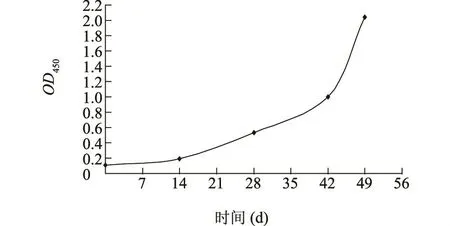
图3 间接ELISA检测的抗nEBPS蛋白血清抗体增长曲线Fig.3 Growth curve of anti-nEBPS antibodies by indirect ELISA

图4 抗nEBPS蛋白的高免兔血清抗体间接ELISA检测Fig.4 Antibody detection of rabbit serum immunized with nEBPS protein by indirect ELISA
利用HiTraPTM抗体纯化柱子纯化血清,收集处于峰值的纯化抗体,共计10 ml(图5)。用Bradford法测得纯化抗体的浓度为1.5 mg/ml。兔多克隆抗体SDS-PAGE分析结果(图6)显示:IgG抗体是具有4条多肽链的对称结构,其中2条较长的为相对分子量较大的相同重链(H链约5.5×104),2条较短的为相对分子量较小的相同轻链(L链约2.5× 104)。链间由二硫键和非共价键联结形成一个由4条多肽链构成的单体分子,经煮沸处理后重链、轻链分开,SDS-PAGE电泳检测结果表明获得了高纯度的抗体,重链清晰可见,轻链有点弥散。间接ELISA检测,纯化抗体效价可达0.686(OD450值),阴性血清对照为0.102,P/N值达6.7。

图5 兔多克隆抗体紫外吸收曲线Fig.5 The UV absorption curve of rabbit polyclonal antibody

图6 兔多克隆抗体SDS-PAGE分析Fig.6 SDS-PAGE analy sis of rabbit polyclonal antibody
3 讨论
弹性蛋白是由细胞分泌的原弹性蛋白单体交错形成的,生理状态下的弹性蛋白(如间质胶原蛋白质以及其他基质)是不溶的聚合纤维形式,原因可能是分泌的原弹性蛋白交错结构中的赖氨酸迅速被赖氨酰氧化酶氧化所致[11]。弹性纤维结合蛋白(EBPS)在结构上不同于哺乳动物细胞表面的弹性结合蛋白[12]。统计分析发现金黄色葡萄球菌感染的绝大多数组织为富含弹性结合蛋白的组织,所以有研究者开始探索金黄色葡萄球菌是否是通过特异性结合弹性结合蛋白来感染宿主。本试验结果表明,金黄色葡萄球菌确实通过其表面分子量为4.5 ×104的EBPS蛋白结合到弹性结合蛋白的N-端结构域上,该结构域中并没有VGVAPG六肽识别序列[13],且结合位点与弹性纤维结合蛋白相关的极性C-末端也不相同,这就表明弹性蛋白中与EBPS结合的位点特异性是针对金黄色葡萄球菌的[14]。由此可以看出EBPS在金黄色葡萄球菌感染宿主的过程中,起到至关重要的作用。
内蒙古自治区是中国乳品业主产区,奶牛乳腺炎的控制和原料乳致病菌的检测对于保证乳品安全有着重要意义。本试验将乳源性致病性金黄色葡萄球菌EBPS基因编码的膜表面蛋白质在体外获得高效表达,并研究其抗原性,为利用其高效表达蛋白质免疫动物制备的高效亚单位抗体,研发检测牛乳中致病性金黄色葡萄球菌的快速、高效、特异检测试剂盒奠定基础,具有重要的公共卫生学及民生意义,也具有巨大的开发应用价值及潜在的市场前景。
[1] 宋 娟,楚雍烈.金黄色葡萄球菌基因调节系统研究进展[J].生命科学,2012(5):463-469.
[2] BABA-MOUSSA L,ANANI L,SCHEFTEL J M,et al.Virulence factors produced by strains of Staphylococcus aureus isolated from urinary tract infections[J].J Hosp Infect,2008,68(1):32-38.
[3] TALBOT B G,LACASSE P.Progress in the development of mastitis vaccines[J].Livestock Production Science,2005,98(1/2): 101-113.
[4] WATTS A,KE D,WANG Q,et al.Staphylococcus aureus strains that express serotype 5 or serotype 8 capsular polysaccharides differ in virulence[J].Infect Immun,2005,73(6):3502-3511.
[5] THAKKER M,PARK J S,CAREY V,et al.Staphylococcus aureus serotype 5 capsular polysaccharide is antiphagocytic and enhances bacterial virulence in a murine bacteremia model[J].Infect Immun,1998,66(11):5183-5189.
[6] KARAKAWA W,SUTTON A,SCHNEERSON R,et al.Capsular antibodies induce type-specific phagocytosis of capsulated Staphylococcus aureus by human polymorphonuclear leukocytes[J].Infect Immun,1988,56(5):1090-1095.
[7] SANTOS J E P,CERRI R L A,BALLOU M A,et a1.Effect of timing of first clinical mastitis occurrence on lactation and reproductive performance of Holstein dairy cows[J].Animal Reproduction Science,2004,80(122):31-45.
[8] SHRIVER-LAKE L C,SHUBIN Y S,LIGLER F S.Detection of Staphylococcal enterotoxin B in spiked food samples[J].J Food Prot,2003,66(10):1851-1856.
[9] NAKAKIDO M,TANAKA Y,TSUMOTO K.The N-terminaldomain of elastin-bindingprotein of Staphylococcus aureus changes its secondary structure in a membrane-mimetic environment[J].J Biochem,2007,142(2):131-134.
[10]李传芬,胡成进.金黄色葡萄球菌膜蛋白EBPS[J].生命的化学,2009,29(1):112-114.
[11]KAGAN H M,TRACKMAN P C.Properties and function of lysyl oxidase[J].Am J Respir Cell Mol Biol,1991,5(3):206-210.
[12]PYONG W P,JOEL R,WILLIAM R A,et al.Molecular cloning and expression of the gene for elastin-binding protein(EBPS)in Staphylococcus aureus[J].The Journal of Biological Chemistry,1996,271(28):15803-15809.
[13]PARK P W,BROEKELMANN T J,MECHAM B R,et al.Characterization of the elastin binding domain in the cell-surface 25-kDa elastin-binding protein of Staphylococcus aureus(EBPS)[J].Journal of Biological Chemistry,1999,274(5):2845-2850.
[14]DOWNER R,ROCHE F,PARK P W,et al.The elastin-binding protein of Staphylococcus aureus(EBPS)is expressed at the cell surface as an integral membrane protein and not as a cell wall-associated protein[J].J Biol Chem,2002,277(1):243-250.

