基于NP基因的新城疫病毒Class I实时荧光定量RTPCR方法的建立及验证
曹军平, 王晓泉, 程 汉, 刘晓文, 刘秀梵
(1.扬州大学兽医学院,江苏 扬州 225009;2.江苏农牧科技职业学院,江苏 泰州 225300)
新城疫(Newcastle disease,ND)是唯一分布于五大洲的OIE A类传染病。中国ND疫情十分严重,是养鸡业发展最直接的威胁[1],已给家禽生产造成严重损失[2]。
新城疫病毒(NDV)是新城疫的病原,属禽副粘病毒1型(AMPV-1),有囊膜,基因组为单股负链RNA,大小约15 kb,编码6种蛋白质,包括RNA聚合酶(L)、血凝素-神经氨酸酶蛋白质(HN)、融合蛋白质(F)、基质蛋白质(M)、磷蛋白质(P)和核蛋白质(N)。新城疫病毒分离株根据对鸡致病严重程度可分为3个主要致病型(毒力型)[2]:Lentogenic株是低致病力型,可造成鸡轻微呼吸道或肠道感染;Mesogenic株是中等致病力型,主要引起呼吸系统疾病;Velogenic株是高致病力型,造成高死亡率,基于病理表现被进一步分为嗜神经或嗜内脏型。高毒力型NDV属于必须报告的OIE A类传染病,它的发生可导致检疫和贸易禁运。
NDV只有1个血清型,但根据亲缘关系可以划分为两大类:Class I、Class II,绝大多数常见的都是Class II,可分成Ⅰ~Ⅹ10个基因型。Class I于2006年被证实存在,当前可被细分为9个基因型(1~9)。Class I所有自然分离株均为无毒株或弱毒株,但有经人工传代返强的报道,由于其分布广泛,数量庞大,对养禽业有巨大的潜在威胁[3]。为了更好地了解Class I新城疫毒株的生物学特性,为研究Class I提供参考,建立一种快速特异的检测方法很有必要。
目前,用鸡胚进行病毒分离,然后用新城疫特异性抗体做血凝抑制试验代表病毒检测的参考标准[4]。虽然病毒分离是一个敏感和特异性的方法,但由于NDV毒力差异大,低毒和无毒株普遍存在,加之弱毒疫苗的普遍使用,对分离毒株血凝抑制试验结果必须结合毒力鉴定才能确诊,一般需要数天才能完成[1]。更快速毒力分型方法基于逆转录聚合酶链(RT-PCR)反应后进行琼脂糖凝胶电泳,RT-PCR产物测序,限制性内切酶分析扩增产物以及使用荧光探针[2]。实时荧光逆转录聚合酶链反应(RRT-PCR)技术,灵敏度高,特异性好,避免了传统RT-PCR检测后处理步骤,节省了试验时间和材料[2,4-6]。本研究拟建立针对禽新城疫病毒Class I核衣壳蛋白(NP)基因的RRTPCR检测方法,为快速定量检测Class I新城疫病毒及进一步明确该病毒对禽的致病作用和致病机理奠定基础。
1 材料与方法
1.1 病毒
鸡新城疫病毒(NDV)由扬州大学农业部畜禽传染病重点开放实验室(BSL-3)分离鉴定和保存(表1)。所有NDVs分别以磷酸盐缓冲液(PH 7.2) 10-5倍稀释接种于9~10日龄SPF鸡胚尿囊腔,接种后24 h内死亡鸡胚舍弃,及时收集24~120 h死亡鸡胚尿囊液,-70℃保存备用。禽流感病毒(AIV)、鸡传染性支气管炎病毒(IBV)、鸡传染性法氏囊炎病毒(IBDV)、鸡传染性喉气管炎病毒(ILTV)、鸡痘病毒(FPV)等常见禽病病毒均由扬州大学兽医学院保存。
1.2 主要试剂和仪器
TaqMan Universal PCR Master Mix Kit为美国ABI公司产品;7300型实时定量PCR扩增仪为美国ABI公司生产。
1.3 引物及探针的设计与合成
根据GenBank上5株Class I NDV NP基因序列,结合扬州大学农业部畜禽传染病重点开放实验室分离鉴定测序的8株Class I NDV NP基因序列,GenBank登录号见表1,选取保守区(靠近5′端)设计引物。采用LASERGENE软件包(DNASTAR Inc.,Madison,WI,USA)和Primer Premier 5.0软件设计和分析引物,合成NDV的1对特异引物及相应的探针,并在NCBI上进行了BLAST比对验证。扩增片段位于NDV Class I国际标准分离株DE-R49-99 NP基因的800~1 086 bp,长度为287 bp,探针位于 NP基因 970~990 bp。上游引物:5′-CCTCAACTTATTACAACCTC-3′(800~819 bp);下游引物:5′-TACAGATGCCATACCCATTGC-3′(1 066~1 086 bp);TaqMan探针:5′-CGGATGAAAGGGGAGAATGCC-3′(970~990 bp)。5′端标记的荧光报告基团是 JOE,3′端标记的荧光猝灭基团为TAMRA,探针命名为:CNPIP。引物由上海生工生物工程技术有限公司合成,探针由大连宝生物工程有限公司合成。
1.4 标准品模板的制备
1.4.1 NP基因阳性质粒构建 NP基因保守区764 bp(JS-18-05株[7])阳性重组质粒由曹军平构建鉴定并保存,载体为 PCR2.1(Invitrogen,USA)。常规法提取质粒纯化后送上海生工生物工程技术有限公司进行序列测定,以确定没有变异。
1.4.2 标准品模板的稀释 用紫外分光光度计分别测定阳性重组质粒在260 nm和280 nm处的吸光度,并根据公式计算重组质粒的DNA浓度与纯度。将重组质粒进行10倍梯度稀释,以1μl 102、103、104、105、106、107、108拷贝作为标准品模板,用于荧光定量PCR反应条件的优化、标准曲线的建立。
1 ml分子拷贝数(个)=DNA质量浓度/DNA分子量
DNA分子量=DNA碱基数×324.5
DNA质量浓度=260 nm吸光度×50×稀释倍数×6.02×1023
1.5 荧光定量PCR反应标准曲线的建立
用引物扩增NP基因阳性质粒,分别以10倍拷贝系列稀释的重组质粒为标准品模板,加入探针,采用实时荧光定量PCR试剂盒(ABI公司)进行反应,反应总体积为25 μl。在实时荧光定量PCR仪中检测荧光信号,分别对引物和探针浓度、循环参数、样本用量等进行优化。利用随机软件进行分析,建立标准曲线。
特异性试验:以AIV、EDS76、IBDV、IBV、ILTV、FPV等常见其他禽病病毒及NDV Class II核酸(表1)和健康鸡组织 RNA、水为模板,进行荧光定量PCR。
灵敏度试验:将阳性重组质粒进行10倍梯度稀释,以1 μl 102、103、104、105、106、107、108拷贝作为标准品模板,用于荧光定量PCR反应条件的优化、标准曲线的建立并计算灵敏度。
重复性试验:批内重复性试验,即分别取等量的3份不同滴度(1 μl 102拷贝、104拷贝、106拷贝)的重组质粒进行荧光定量PCR检测,每份样品做5个重复;批间重复性试验:取以上3份样品,在同一反应条件下进行5次独立的荧光定量PCR检测。
1.6 验证试验
用表1毒株接种 SPF鸡胚,收集尿囊液进行血凝试验(Hemagglutination test,HA)和NDV血凝抑制试验(Hemagglutination inhibition test,HI),同时用样品做RRT-PCR试验,计算2种方法的符合率。
2 结果
2.1 荧光定量PCR反应条件的优化
通过多个批次的重复试验,证明在25 μl体系中,探针浓度为 0.5 μmol/L、引物浓度为 0.5 μmol/L、模板量3 μl,退火温度为60℃时,本底反应最小、Ct值最小、扩增效率最高。将25 μl体系小心放入RRT-PCR仪中,记录样本摆放顺序,在96孔板内填写被检样品、阳性对照、阴性对照、定量标准品孔,设置反应程序。95℃预变性10 min,然后95℃ 15 s,60℃ 1 min,43个循环。荧光信号的收集及数据的采集定在60℃。将以10倍拷贝系列稀释的重组NP基因阳性质粒为标准品模板,加入体系中。检测结束,根据噪音情况设定和调整基线及阈值,并利用随机软件进行分析,建立标准曲线。根据荧光曲线和循环数(Ct)判断结果。
2.2 标准曲线的建立
按上述优化的反应条件 ,取1 μl 102、103、104、105、106、107、108拷贝浓度的重组质粒作为标准品模板,分别加入RRT-PCR反应体系中进行扩增,系统自动分析软件显示Ct值与标准品浓度的对数之间存在良好的线性关系(图1、图2)。
2.3 特异性试验
以AIV、EDS76、IBDV、IBV、ILTV、FPV等常见其他禽病病毒及NDV Class II核酸(表1)和健康鸡组织RNA、水为模板,进行荧光定量PCR,没有发现有效扩增。NDV Class I光信号明显。
2.4 灵敏度试验
从图1可见,当1 μl标准质粒浓度≥1.0拷贝数时仍可出现典型扩增曲线。从图2可见,在较广的范围内(1 μl 1.0×102~1.0×108拷贝数),Ct值与质粒拷贝数的对数之间呈现很好的线性关系,决定系数R2=0.99。将其检测限的Ct值通过标准曲线换算成初始模板拷贝数约为1 μl 1拷贝,相当于1个NDV颗粒。
2.5 重复性试验
批内重复性试验:分别取等量的3份不同滴度(1 μl 102拷贝、104拷贝、106拷贝)的重组质粒进行荧光定量PCR检测,每份样品做5个重复;批间重复性试验:取以上3份样品,在同一反应条件下进行5次独立的荧光定量PCR检测。结果显示,批内变异系数为0.43%~0.99%,批间变异系数为0.95%~1.39%(表2),表明误差都非常小,重复性好。

表1 NDV标准参考分离株及其他禽病病毒株Table 1 NDV standard reference isolates and other avian viruses isolates
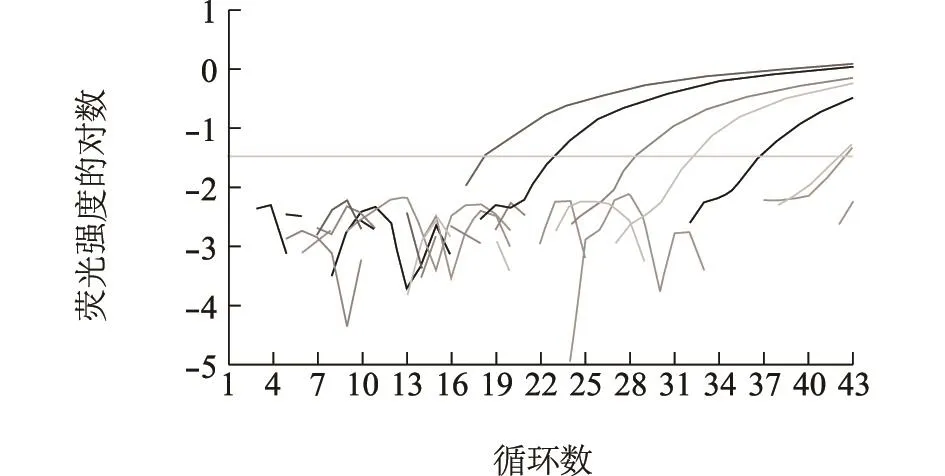
图1 荧光定量RT-PCR扩增动力学曲线Fig.1 Dynamic curve of real-time fluorescent quantitative RTPCR

图2 RRT-PCR标准曲线Fig.2 Standard curve of real-time RT-PCR
2.6 验证结果
RRT-PCR与病毒分离结果见表1,结果显示,2种方法检测33株NDV,阴性和阳性结果完全符合,符合率为100%。
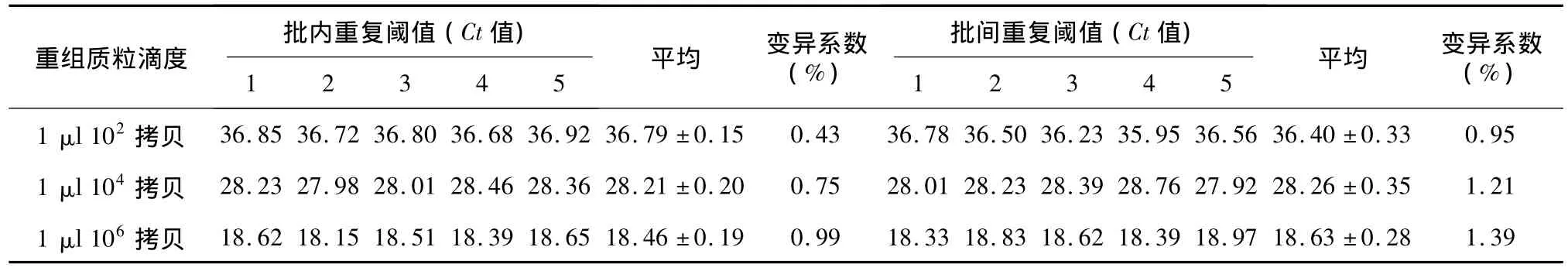
表2 用荧光定量RT-PCR检测3份不同病毒含量标准品的批内和批间重复检测结果Table 2 Intra-and inter-assay reproducibility of fluorescent quantitative RT-PCR for 3 standard samples
3 讨论
本研究的目的是制定一个快速﹑实时RT-PCR方法检测和区分禽临床样本中所有的新城疫病毒。众所周知,由于新城疫病毒基因组序列之间的高异质性[6],设计可以扩增每个新城疫病毒分离株的PCR引物,已被证明存在一些困难[7]。大多数努力集中于F基因[7]。
将荧光定量RT-PCR应用于新城疫病毒的检测已有报道。Mark等[2]建立了RRT-PCR技术检测鸟类临床标本新城疫病毒。检测采用单管水解探针,引物和探针根据M基因保守区序列设计,可检测到大约1 000拷贝病毒基因组RNA和10 EID50病毒。Beate等[8]建立了高通量的检测外来NDV的RRTPCR方法。Mia等[9]建立了基于新城疫病毒L基因基础上的RRT-PCR技术,对Mark等建立的新城疫病毒M基因RRT-PCR是一个有力的补充。Sheau等[10]报道 NP基因相对比 F基因更保守。刘晓文[11]研究结果表明Class I分离株NP基因之间氨基酸序列的同源性为93.0%~99.5%,Class I毒株与 Class II毒株 NP蛋白质同源性为 88.2%~92.5%。本研究选取Class I NP基因保守区设计引物和探针,首次建立了一种新的基于NP基因的检测新城疫病毒Class I的RRT-PCR方法,对Mark等建立的新城疫病毒M基因RRT-PCR也是一个重要的补充。这两个方法结合可以快速检测所有Class I和Class II新城疫病毒并进行初步分群。随着NDV分子生物学研究的不断深入,NDV基因序列及功能得到不断的揭示,ND分子生物学检测技术将得到进一步的补充和完善。
[1] 崔治中.我国家禽新城疫的流行现状[J].中国家禽,2002,24 (4):426.
[2] MARK G W,DAVID L S,BRUCE S S,et al.Development of a real-time reverse-transcription PCR for detection of Newcastle disease virus RNA in clinical samples[J].Journal of Clinical Microbiology,2004,42:329-338.
[3] 金仕强,孟春春,仇旭升,等.Class I新城疫病毒概述[J].动物医学进展,2012,33(4):102-106
[4] Office of International Epizootes.Manual of standards for diagnostic tests and vaccines[M].4th ed.Paris:Office of International Epizootes,2000.
[5] WATZINGER F,EBNER K,LION T.Detection and monitoring of virus infections by real-time PCR[J].Molecular Aspects of Medicine,2006,27:254-298.
[6] LOMNICZI B,WEHMANN E,HERCZEG J,et al.Newcastle disease outbreaks in recent years in western Europe were caused by an old(virus isolation)and a novel genotype(VII)[J].Arch Virol, 1998,143:49-64.
[7] ALDOUS E W,ALEXANDER D J.Detection and differentiation of Newcastle disease virus(avian paramyxovirus type 1)[J].A-vian Pathol,2001,30:117-128.
[8] BEATE M C,SHARON K H,LIU-MEI S,et al.High-throughput real-time RT-PCR assay to detect the exotic Newcastle disease virus during the California 2002-2003 outbreak[J].J Vet Diagn Invest,2005,17:124-132.
[9] MIA K L,DANIEL J K,DAVID L S,et al.Characterization of Class I Newcastle disease virus isolates from Hong Kong live bird markets and detection using real-time reverse transcription PCR[J].Journal of Clinical Microbiology,2007(45):1310-1314.
[10]TAN S W,IDERIS A,OMAR A R,et al.Detection and differentiation of velogenic and lentogenic Newcastle disease viruses using SYBR Green I real-time PCR with nucleocapsid gene-specific primers.Journal of Virological Methods,2009,160(1-2):149-56.
[11]刘晓文.家鸭中弱毒新城疫病毒的分子流行病学和以弱毒为骨架表达强毒F和/或HN基因对重组病毒毒力的影响[D].扬州:扬州大学,2009.

