水牛透明带3基因启动子克隆及转录活性检测
庞春英, 陆杏蓉, 朱 鹏, 邓廷贤, 段安琴, 陈明棠, 杨炳壮, 梁贤威
(中国农业科学院广西水牛研究所广西水牛遗传繁育重点实验室,广西 南宁 530001)
水牛具有适应性强、耐高温高湿、耐粗饲、抗病力强、使用年限长、静默发情、繁殖力低和产奶量低等生物学特点,非常适合于中国南方农村饲养[1-2]。据联合国粮食与农业组织(FAO)2013年统计数据,2011年底中国水牛存栏量达2.338 2×107头,仅次于印度的1.129 16×108头和巴基斯坦的3.172 6×107头,位居世界第3。水牛在中国畜牧业产业中占有重要地位,是重要的肉、乳和役兼用畜种资源,水牛奶更有“奶中之王”之称。但是,当前繁殖力低是制约水牛养殖业发展的瓶颈。水牛性成熟晚,属季节性发情动物,产后卵巢长时间不活动,发情症状不明显,怀孕率低,各地调查的繁殖率为30%~60%;通过超数排卵结合活体采卵技术(O-vum pick up,OPU)每个水牛卵巢可以获得2.25枚卵母细胞[3-4],而黄牛平均卵母细胞数则高达30.84±0.88枚[5]。因此,深入阐明水牛繁殖调控的机理,了解其卵泡发生模式,尤其是关键基因的表达和作用方式,对于提高水牛的繁殖力具有重要意义,但是当前关于水牛繁殖分子机制的研究较少[6-10]。
透明带蛋白对于脊椎动物的精卵识别、多精受精的防控以及胚胎的保护起着关键性的调节作用。透明带蛋白家族,由透明带蛋白1(Zona pellucida 1,ZP1)、透明带蛋白2(Zona pellucida 2,ZP2)、透明带蛋白3(Zona pellucida 3,ZP3)和透明带蛋白4(Zona pellucida 4,ZP4)组成。小鼠的透明带由ZP1~ZP3组成,其中ZP3蛋白是小鼠主要的精子受体,能够诱发小鼠精子的顶体反应[11]。人的透明带由ZP1~ZP4组成,其中ZP1、ZP3和ZP4与精子结合并诱发顶体反应[12]。猪和牛的透明带由ZP2、ZP3和ZP4组成,其中ZP3与ZP4形成异源二聚体,然后与精子结合[13]。ZP3基因特异表达于动物的初级卵母细胞中[14],已被成熟地应用于基因的时空特异性敲除[15]。但当前关于水牛ZP3基因的表达调控机制研究较少,鉴于此,本研究旨在克隆水牛ZP3基因5′侧翼序列,对其序列特征进行生物信息学分析,并构建pZP3-EGFP-1真核表达载体,转染HEK-293T细胞和CHO细胞,分析ZP3启动子的组织表达特异性。
1 材料与方法
1.1 试验材料
试验用水牛选自中国农业科学院广西水牛研究所水牛养殖基地。
1.2 主要试剂
水牛血液基因组提取试剂盒TIANamp Marine Animals DNA Kit、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒和DH5a感受态细胞均购自天根生化科技有限公司,去内毒质粒提取试剂盒购自OMEGA公司,LA Taq酶、BamH I和EcoR I限制性内切酶、pMDl8-T Vector均购自大连TaKaRa公司,T4连接酶购自Fermentas公司,DMEM高糖基础液体培养基(GIBCO)、胎牛血清(FBS,Hyclone)、胰酶和脂质体转染试剂盒(Life 3000,Invitrogen)等购自Life公司。倒置荧光显微镜(Nikon)、0.22 μm过滤器(Millipore)、其他试剂无特殊说明的均购自Sigma公司。试验所用载体、细胞均为中国农业科学院广西水牛研究所保存。引物由上海生工生物工程有限公司合成。
1.3 试验方法
1.3.1 引物设计 以奶牛ZP3基因序列(DQ489319.1)为参考,进行同源比对,根据In-Fusion引物设计特点,应用Oligo 6.0软件针对ZP3的同源保守区域设计了1对引物,扩增ZP3基因5′端3 081 bp。引物 ZP3-F序列为5′-CTCAAGCTTCGAATTCTCTAGACAACCCCACCCTACTCCCAG-3′,ZP3-R序列为5′-CATGGTGGCGACCGGTCGGTGCCGAAAAGGTCTTTG-3′,下划线处为In-Fusion引物同源区域,退火温度为55℃。
1.3.2 水牛血液基因组DNA的提取及PCR扩增按照血液基因组提取试剂盒TIANamp Marine Animals DNA Kit操作说明书提取水牛基因组DNA。PCR反应体系20 μl:模板1 μl,上、下游引物(各20 μmol/L)各1 μl,PrimeSTAR Max Premix(2×)10 μl,ddH2O补至20 μl。PCR反应条件为:98℃预变性3 min;98℃变性10 s,55℃退火15 s,72℃延伸15 s,35个循环;72℃延伸7 min,4℃终止反应。PCR产物用1%琼脂糖凝胶电泳检测,胶回收并进行TA克隆。
1.3.3 生物信息学分析 应用NCBI数据BLAST程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对沼泽型水牛ZP3测序结果进行同源序列比对,用MEGA5.0软件进行分子进化树构建,用Promoter (http://www.fruitfly.org/seq_tools/promoter.html)、Softberry(http://linux1.softberry.com/berry.phtml? topic=fprom&group=programs&subgroup=promoter)预测启动子,用Gpminer(http://gpminer.mbc.nctu.edu.tw/index.php)预测启动子和转录因子,用Jaspar(http://jaspar.genereg.net/cgi-bin/jaspar_db.pl? rm=browse&db=core&tax_group=vertebrates)预测转录因子,用Methprimer(http://www.urogene.org/ cgi-bin/methprimer/methprimer.cgi)预测CpG岛。
1.3.4 载体构建 应用Bgl II和Age I双酶切骨架载体pEGFP-1,酶切体系及方法参照试剂说明书。酶切3 h后进行1%琼脂糖凝胶电泳检测和胶回收,并于4℃保存用于后续In-Fusion连接。In-Fusion连接体系:5×In-Fusion HD Enzyme Premix 2 μl,PCR胶回收产物6 μl,线性化骨架载体2 μl。反应条件为:50℃15 min,之后4℃保存。转化、质粒提取、去内毒质粒提取等严格按照试剂盒的操作说明书进行。重组质粒送至上海生工生物工程有限公司进行测序。
1.3.5 细胞培养及转染 HEK-293T和CHO细胞系用含有10%进口胎牛血清(FBS)的DMEM培养基,于37℃、5%CO2浓度下培养,隔天传代。转染按照Life 3000转染试剂盒的操作说明书进行。48 h后在倒置荧光显微镜下检测绿色荧光蛋白(EGFP)的表达情况。
2 结果与分析
2.1 水牛ZP3基因的克隆与鉴定
以水牛血液基因组为模板,应用设计的特异性引物扩增ZP3基因,经PCR成功扩增获得3 081 bp的特异性条带(图1),与预期结果一致。

图1 水牛ZP3基因的扩增与亚克隆Fig.1 Amplification and subcloning of buffalo ZP3 gene
2.2 水牛ZP3基因序列分析
对获得的阳性重组质粒进行测序分析,获得水牛ZP3基因序列。应用NCBI的BLAST软件进行相似性比对分析,结果显示,广西本地水牛ZP3核酸序列与河流型水牛、黄牛、绵羊和山羊的相似性分别为99%、96%、92%和92%,表明ZP3基因在不同哺乳动物中具有较高的序列保守性。
2.3 水牛ZP3基因系统进化树
选择所克隆得到的广西本地水牛ZP3基因序列与黄牛、小鼠和人相关序列进行多重序列比较,结果表明广西本地水牛ZP3基因序列与黄牛具有较高的相似性,与小鼠和人的序列差别较大。进一步应用MEGA5.0软件,用NJ法构建系统进化树(图2)。由图2可知,水牛与黄牛的相应序列聚为一支,与绵羊的遗传距离相对较近,进化树的形态与分类学具有较高的一致性,进一步说明克隆的序列为水牛ZP3基因。
2.4 水牛ZP3基因启动子和转录因子的生物信息分析
选取广西本地水牛ZP3基因5′侧翼2 000 bp序列,进行启动子及转录因子反式作用元件等分析。Gpminer在线网站预测结果显示,在-147 bp至-196 bp区域存在启动子特征序列(TATA box),序列为 TCATCAGGGGTATAAGACGGTGGGTGGTGCCTGCCCAGGAGTCACAGTGG。经Jaspar和Gpminer软件预测发现本地水牛ZP3基因5′侧翼序列2 000 bp内存在2个潜在核心启动子区,其中一处为-50 bp至-409 bp区域,此区域存在 TBP(-187 bp……-173 bp)、SP1(-60 bp……-50 bp)、CEBPA (-409 bp……-399 bp)和USF1,2(-126 bp……-116 bp)等结合位点,分别结合 TATA box、GC box、CAAT box和 E box;另一处为 -1 031 bp至-1 248 bp处,此区域存在TBP(-1 069 bp……-1 031 bp)、SP1(-1 248 bp…… -1 226 bp)、CEBPA(-1 122 bp…… -1 112 bp)和 USF1,2 (-1 105 bp……-1 095 bp)等转录因子结合位点。此外在广西本地水牛ZP3基因5′侧翼序列2 000 bp内,也存在Foxo3、Nobox、Stat3、Stat5a、Stat5b、Stat6、YY1和Gata家族等反式作用元件结合位点,其中Stat家族基因在ZP3基因启动子区存在多个结合位点,且ZP3同一位点处存在多个Stat家族基因结合的情况(图3、图4、图5)。通过Methprimer预测发现在ZP3基因翻译起始位点上游不存在CpG岛。

图2 水牛与其他物种ZP3基因核苷酸序列的系统进化树Fig.2 Phylogenetic tree of ZP3 gene among buffalo and other species based on nucleotide sequence
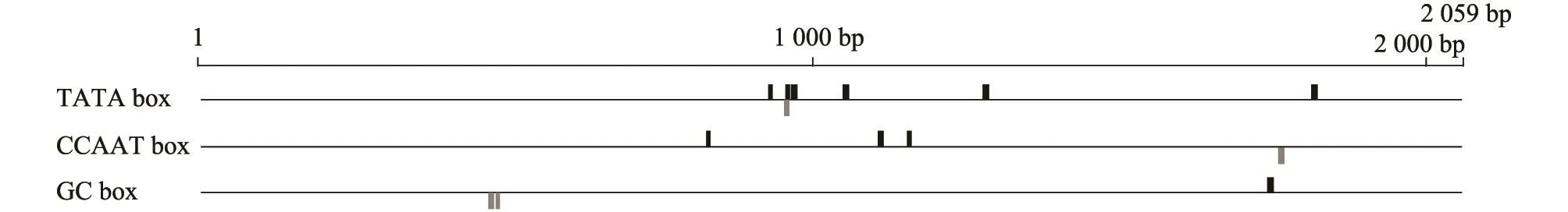
图3 水牛ZP3基因启动子的预测Fig.3 Prediction of the promoter of buffalo ZP3 gene
2.5 pZP3-EGFP-1真核表达载体构建及转录活性检验
应用In-Fusion技术构建pZP3-EGFP-1真核表达载体,电泳及测序结果表明所构建载体正确(图1)。应用脂质体Life 3000,将阳性对照质粒pEGFPN1转染HEK-293T和CHO细胞系,阴性对照质粒pEGFP-1转染HEK-293T和CHO细胞系,所构建的pZP3-EGFP-1质粒转染HEK-293T和CHO细胞系,48 h后进行荧光观察。结果表明:阳性对照载体pEGFPN1在HEK-293T和CHO细胞系中有EGFP蛋白表达,且在HEK-293T中荧光信号显著强于CHO细胞系;阴性对照载体pEGFP-1在HEK-293T和CHO细胞系中均无EGFP蛋白表达;试验载体pZP3-EGFP-1在HEK-293T细胞系中无EGFP蛋白表达,在CHO细胞系中有EGFP蛋白表 达(图6)。
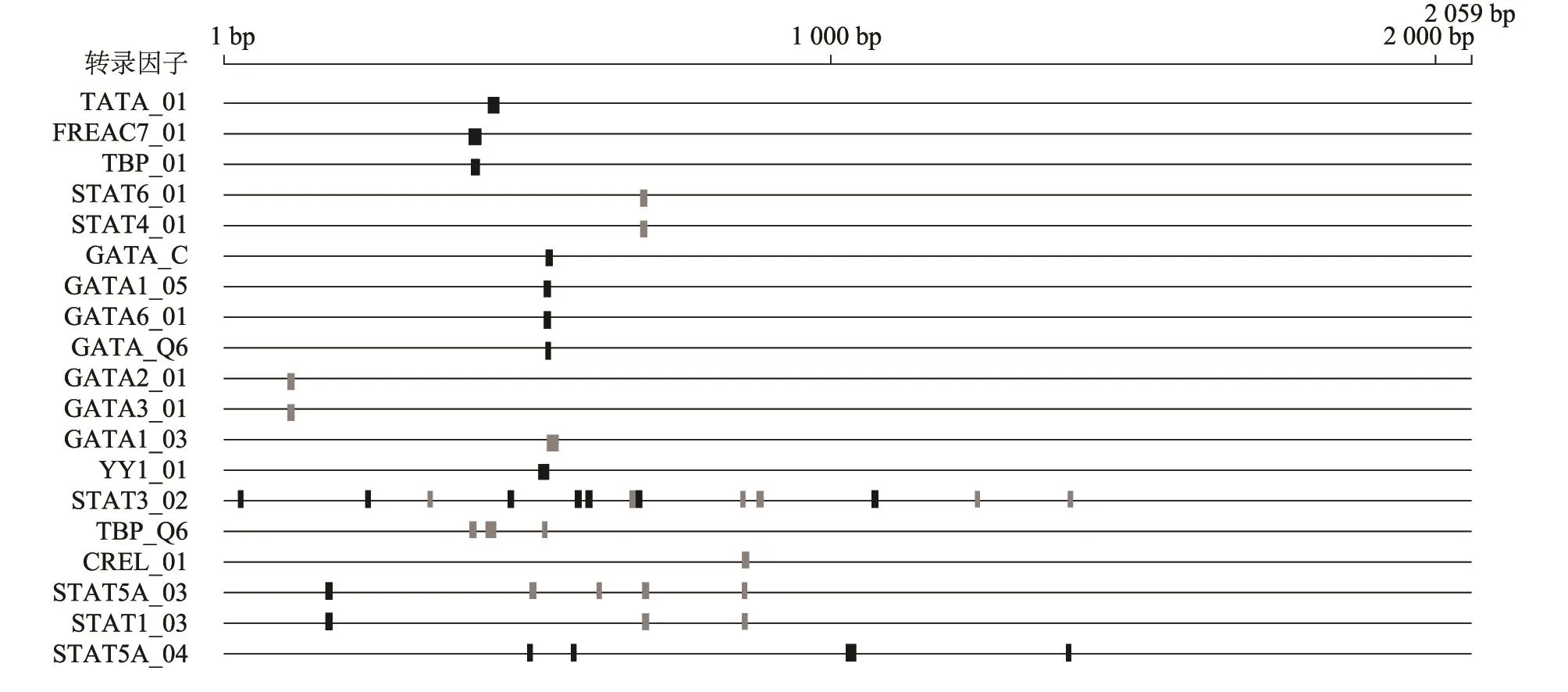
图4 水牛ZP3基因启动子区转录因子的预测Fig.4 The prediction of transcription factor of buffalo ZP3 promoter

图6 水牛ZP3基因启动子的转录活性Fig.6 The transcriptional activity of promoter of buffalo ZP3 gene
3 讨论
小鼠透明带由ZP1、ZP2和ZP3 3种糖蛋白组成,三者的含量比值为1∶4∶4[16]。其中ZP3基因特异表达于初级卵泡阶段及其之后的卵母细胞中[17]。ZP3的缺失,一方面致使透明带不能形成,另一方面致使胚胎发育不能跃过2细胞期[18]。人的ZP3基因位于7号染色体上,含有7个可变剪切体,其中4个可以编码蛋白质,分别编码373 aa、424 aa、248 aa和258 aa。编码区最长的可变剪切体含有8个外显子和7个内含子。小鼠的ZP3基因位于5号染色体上,含有2个可变剪切体,仅有1个可以编码蛋白质,含有5个外显子和4个内含子。黄牛的ZP3基因位于25号染色体上,编码421 aa。对透明带基因表达调控研究发现,位于透明带蛋白质翻译起始位点上游 200bp处存在 E-box (CANNTG),能够与反式作用因子Figla和USF1等结合,从而促进透明带蛋白质基因的表达[19]。Shi等[20]研究发现,鲫鱼的ZP1、ZP2和ZP3基因聚集在一起,其跨度为10 855 bp,其中ZP2和ZP3间的1 097 bp具有双向启动子的特性,能够同时调节ZP2和ZP3基因的表达。本研究成功克隆获得沼泽型水牛ZP3 5′侧翼序列及部分外显子序列,共3 081 bp,同源性分析结果表明其与河流型水牛和黄牛的序列相似性较高。
本研究通过信息学分析发现,在水牛ZP3启动子区内存在2个潜在核心启动子区,其中一处为-50 bp至-409 bp区域,此区域存在 TBP、SP1、CEBPA和USF1,2等结合位点,与文献[21]报道的一致;另一处为-1 031 bp至-1 248 bp处,此区域存在TBP、SP1、CEBPA和USF1,2等转录因子结合位点。此外还存在 GATAs、Foxo1、Foxo3、Stats和YY1等反式作用元件结合位点,且存在Stat3、Stat4、Stat5a、Stat5b以及Stat6同时结合的位点,提示Stats可能通过形成二聚体的形式调控ZP3的表达。通过构建pZP3-EGFP-1表达载体转染HEK-293T和CHO细胞,发现ZP3 5′侧翼序列能够启动绿色荧光蛋白表达于 CHO细胞中,但不能启动其表达于HEK-293T细胞中,表明所克隆获得的沼泽型水牛ZP3 5′侧翼序列具有组织表达特异性。总之,本研究成功克隆了广西本地水牛ZP3 5′侧翼区域,并验证了其转录活性,但对其转录调节机制还需进行进一步研究。
[1] NANDI S,RAGHU H M,RAVINDRANATHA B M,et al.Production of buffalo(Bubalus bubalis)embryos in vitro:premises and promises[J].Reprod Domest Anim,2002,37(2):65-74.
[2] ZICARELLI L,ESPOSITO L,CAMPANILE G,et al.Effects of using vasectomized bulls in artificial insemination practice on the reproductive efficiency of Italian buffalo cows[J].Anim Reprod Sci,1997,47(3):171-180.
[3] MANJUNATHA B M,RAVINDRA J P,GUPTA P S,et al.Oocyte recovery by ovum pick up and embryo production in river buffaloes(Bubalus bubalis)[J].Reprod Domest Anim,2008,43 (4):477-480.
[4] DI FRANCESCO S,NOVOA M V,VECCHIO D,et al.Ovum pick-up and in vitro embryo production(OPU-IVEP)in Mediterranean Italian buffalo performed in different seasons[J].Theriogenology,2012,77(1):148-154.
[5] PONTES J H,MELO STERZA F A,BASSO A C,et al.Ovum pick up,in vitro embryo production,and pregnancy rates from a large-scale commercial program using Nelore cattle(Bos indicus) donors[J].Theriogenology,2011,75(9):1640-1646.
[6] 崔奎青,刘庆友,李秀林,等.基于线粒体控制区变异的水牛群体遗传分析[J].华南农业大学学报,2013,34(1):76-82.
[7] 崔奎青,张会娜,刘 帅,等.沼泽型水牛NANOG基因5′调控序列克隆与功能分析[J].畜牧兽医学报,2013,44(3): 387-394.
[8] 邓彦飞,刘真真,李云芳,等.不同逆转录载体系统应用于水牛胎儿成纤维细胞转基因的探索[J].华南农业大学学报,2013,34(4):558-563.
[9] 龚 云,乔树叶,林 浪,等.水牛YY1基因克隆及其shRNA片段的筛选[J].畜牧兽医学报,2014,45(1):62-68.
[10]苏 节,刘庆友,朱 鹏,等.沼泽型水牛CYP19A1基因克隆、序列分析及组织表达研究[J].畜牧兽医学报,2013,44(4): 514-521.
[11]SHI J W,SHENG J Q,PENG K,et al.Expression pattern of the zona pellucida 3(ZP3)gene during ovarian development and the location of ZP3 protein in oocytes in a natural,wild triploid crucian carp mutant,Carassius auratus var.Pingxiangnensis[J].Genet Mol Res,2013,12(4):5640-5650.
[12]GUPTA S K,BHANDARI B,SHRESTHA A,et al.Mammalian zona pellucida glycoproteins:structure and function during fertilization[J].Cell Tissue Res,2012,349(3):665-678.
[13]YONEZAWA N,KANAI-KITAYAMA S,KITAYAMA T,et al.Porcine zona pellucida glycoprotein ZP4 is responsible for the sperm-binding activity of the ZP3/ZP4 complex[J].Zygote,2012,20(4):389-397.
[14]LAN Z J,XU X,COONEY A J.Differential oocyte-specific expression of Cre recombinase activity in GDF-9-iCre,Zp3cre,and Msx2Cre transgenic mice[J].Biol Reprod,2004,71(5):1469-1474.
[15]DE VRIES W N,BINNS L T,FANCHER K S,et al.Expression of Cre recombinase in mouse oocytes:a means to study maternal effect genes[J].Genesis,2000,26(2):110-112.
[16]LIANG L,SOYAL S M,DEAN J.FIGalpha,a germ cell specific transcription factor involved in the coordinate expression of the zona pellucida genes[J].Development,1997,124(24): 4939-4947.
[17]EPIFANO O,LIANG L F,FAMILARI M,et al.Coordinate expression of the three zona pellucida genes during mouse oogenesis[J].Development,1995,121(7):1947-1956.
[18]LIU C,LITSCHER E S,MORTILLO S,et al.Targeted disruption of the mZP3 gene results in production of eggs lacking a zona pellucida and infertility in female mice[J].Proc Natl Acad Sci USA,1996,93(11):5431-5436.
[19]EPIFANO O,LIANG L F,DEAN J.Mouse Zp1 encodes a zona pellucida protein homologous to egg envelope proteins in mammals and fish[J].J Biol Chem,1995,270(45):27254-27258.
[20]SHI J,PENG K,SHENG J,et al.A specific genomic organization and a novel promoter sequence for both ZP2 and ZP3 gene expressions in the Pingxiang red transparent crucian carp,Carassius auratus var.pingxiangnensis[J].Comp Biochem Physiol Part D Genomics Proteomics,2013,8(4):275-282.
[21]LEWANDOSKI M,WASSARMAN K M,MARTIN G R.Zp3-cre,a transgenic mouse line for the activation or inactivation of loxP-flanked target genes specifically in the female germ line[J].Curr Biol,1997,7(2):148-151.

