茅苍术挥发油及主要组分对3种病原菌和2种内生菌的抑菌活性
陈 飞, 李 蕾, 周佳宇, 戴传超
(南京师范大学生命科学学院/江苏省微生物资源产业化工程技术研究中心/江苏省微生物与功能基因组学重点实验室,江苏南京210023)
茅苍术(Atractylodes lancea)为菊科苍术属多年生草本植物,是中国重要的药用植物,主要分布于江苏、湖北和河南等省份,而江苏茅山一带是茅苍术道地药材的产区。茅苍术根茎是著名的道地药材,具有燥湿健脾、祛风散寒、明目等功效。近年来国内外学者对茅苍术的研究日趋深入,尤其是对其挥发油的化学成分进行了大量的研究。茅苍术挥发油中主要为倍半萜类的苍术酮、β-桉叶醇和茅术醇及聚乙炔类的苍术素。茅苍术的道地性则主要表现为挥发油中各成分呈现出特定配比关系,道地产区苍术挥发油含量较非道地产区低而苍术酮、苍术素高于非道地产区[1]。由于道地药材成分的特殊性,野生茅苍术资源的严重破坏,加上茅苍术体内丰富的内生真菌资源[2],因此利用内生真菌生产道地性药材被视为解决茅苍术资源短缺问题的一条有效途径。本课题组之前的研究结果表明,在悬浮细胞水平,添加内生真菌诱导子可以使β-桉叶醇有效转化为苍术酮、茅术醇和苍术素[3];组培苗水平下添加内生真菌小菌核菌AL3、小克银汉霉AL4和孔球孢霉AL12均可提高苍术酮相对含量而降低β-桉叶醇含量[4]。
内生真菌能与宿主建立稳定共生关系,并赋予宿主一些优良的性状,如促进植物生长,增强植物对不良环境的抗性,抗病虫害,促进植物次级代谢产物的产生等[5-9]。宿主植物也能通过产生相关防御酶系(几丁质酶和β-1,3-葡聚糖酶)水解真菌细胞壁抑制真菌的生长[10],说明内生真菌能激发宿主的防御反应,但这种反应相比于病原菌侵染是温和的[11]。内生菌与病原菌之间的转变是一个连续的过程,二者的平衡一旦被打破,植物就会显现出病征[12]。
挥发油作为植物组成型次生代谢产物是一种进化形成的抵抗外界病原物的机制。病原菌为了成功侵染植物分泌解毒酶分解利用次级代谢产物以克服植物的防御系统[13]。内生真菌能够从体外侵入植株,本身就具有植物病原菌的某些特性,因此内生真菌也有类似的分解利用次级代谢产物的机制。研究发现内生真菌生赤壳属Bionectria ochroleuca ALG-13可利用挥发油为唯一碳源[14],并增加道地成分(苍术酮和苍术素)相对含量而降低非道地成分(β-桉叶醇和茅术醇)相对含量。但是茅苍术挥发油有很强的抑菌活性,内生真菌如何与这种抑菌物质达成平衡不使植物致死,同时使自身生长受到植物调节的拮抗平衡机制还没有系统的研究。目前,尚没有文献报道植物次级代谢产物与其内生真菌、病原真菌建立拮抗平衡过程的区别。本研究拟通过茅苍术挥发油及各组分对其内生真菌和病原真菌抑菌活性的研究,以期发现挥发油对内生真菌、病原真菌不同的抑制作用,并试图找出宿主植物与内生真菌建立拮抗平衡的关键物质,从而更好地理解内生真菌与宿主植物之间拮抗平衡的共生关系。
1 材料与方法
1.1 试验材料
茅苍术根茎购于陕西地道药材有限公司。病原真菌选择茅苍术3种常见的病原菌:尖孢镰刀菌(Fusarium oxysporum)、腐皮镰刀菌(Fusarium solani)和茅苍术黑斑病病菌交链孢(Alternaria solani),以上菌株由本实验室分离保存。内生真菌选择课题组从茅苍术中筛选出的2株内生真菌:菌株AL11,为镰刀菌属(Fusariium sp.);菌株AL12,为孔球孢霉属(Gilmaniella sp.)。
1.2 试验方法
1.2.1 茅苍术挥发油及其主要组分的制备 将茅苍术根打碎成粉末状,称取1 000 g的粉末,加适量水,用水蒸气蒸馏法提取,得到蒸馏液和残渣。把残渣重新提取2次,浓缩滤液,加适量乙醇,把蒸馏液和滤液混合,用乙醚萃取2次。萃取液自然挥发干燥,即得黄棕色半固体状,具有特殊浓郁香味的挥发油。挥发油4种主要组分由本课题组分离制备[15]。
1.2.2 菌株活化及菌悬液制备 将所有供试菌株分别挑取小块,于PDA试管斜面中,28℃培养48 h,加入无菌水,刮取菌丝体制成初始菌悬液。取适量菌悬液,加入无菌水,将其稀释成含菌(孢子)量1×107~1×108CFU/ml的菌悬液备用。
1.2.3 真菌抑制率及IC50测定 称取2.5 g挥发油,加入5%(体积比)吐温20,用灭菌蒸馏水定容至50 ml作为母液,分别吸取母液25 μl、50 μl、100 μl、200 μl、400 μl、600 μl、800 μl、1 600 μl加入8支10 ml的容量瓶中,用无菌蒸馏水定容,得到125 μg/ml、250 μg/ml、500 μg/ml、1 000 μg/ml、2 000 μg/ml、4 000 μg/ml、6 000 μg/ml和8 000 μg/ml的8个浓度。采用生长速率法,取1 ml药液,加入9 ml已经熔化的PDA培养基混匀,迅速倒入9 cm的培养皿内制成平板,药剂浓度相应缩小10倍,在培养皿中央相应放入直径为0.5 cm的菌饼一块,无菌蒸馏水加等量吐温20为空白对照,每个处理设置3个重复,28℃恒温培养。当对照组菌丝生长至平板边缘,取出平板计算抑制率。抑制率(%)=(CT)/T×100%(C:对照组真菌菌丝直径;T:不同处理组下真菌菌丝直径)。半抑制浓度IC50则根据真菌抑制率和抑制浓度对数的关系计算得出[16]。
1.2.4 挥发油及各组分抑菌活性的测定 将无菌滤纸片(直径6 mm,高压蒸气灭菌后烘干)浸泡在挥发油及各组分中30 min,在平皿边缘将滤纸片上多余液体沥干,贴于涂布孢子悬液的PDA平板上,28℃培养48 h。以平板中贴有乙酸乙酯的滤纸片为空白对照。48 h后记录形成的抑菌圈大小。每组试验设3个重复,试验结果取平均值。
1.2.5 病原菌孢子萌发率测定 采用悬滴法,将挥发油和各组分分别添加到含5 ml PDA的试管中得终浓度为0.1 mg/ml、0.2 mg/ml、0.3 mg/ml、0.4 mg/ml、0.5 mg/ml,同时每管中添加100 μl的孢子悬液(每1 ml 1×107个孢子)。28℃培养,6 h后镜检(每个重复检查孢子数100个以上),之后隔2 h镜检1次,记录各处理组孢子萌发个数和检查孢子总数,计算孢子萌发率(%)=孢子萌发个数/检查孢子总数×100%。
1.2.6 苍术酮和苍术素对菌丝分支的影响 用接种针挑取苍术酮和苍术素处理的菌落边缘菌丝分别制片,观察不同处理下菌丝体生长情况、菌丝直径和主菌丝上相邻分支菌丝间的距离(μm),每个处理随机挑取12个视野,统计菌丝粗细和菌丝分支间距[17]。图像采用MetaMorph/MetaFluor软件(West Chester)分析,菌丝形态拍摄采用 Sensicam QE Cooled Digital Camera System(Cooke Corp)。将苍术酮和苍术素分别配成0.1 mg/ml、0.2 mg/ml、0.3 mg/ml、0.4 mg/ml和0.5 mg/ml 5个浓度,分别吸取上述溶液10 μl与受试菌孢子悬液10 μl置于3 ml的PDA试管中,10 μl乙酸乙酯为空白对照,28℃培养,3个重复。2 h后镜检(每个重复检查孢子数100个以上),之后隔2 h检查一次,待对照孢子萌发率达80%以上时计算孢子萌发率。
1.2.7 扫描电镜(SEM)观察苍术酮和苍术素对真菌的影响 在含有苍术酮和苍术素的PDA平板上分别接种AL11和交链孢,对照组添加相同含量乙酸乙酯,28℃培养72 h,在菌落边缘取5~10 mm见方的菌块,双蒸水洗涤30 min,然后浸泡于2.5%戊二醇(pH 7.4)中4℃固定过夜。固定好的样品再用磷酸缓冲液(pH 7.4)洗涤30 min。用1%锇酸室温固定2 h后磷酸缓冲液洗涤 30 min。再用系列梯度为3%、50%、70%、80%、90%和100%的乙醇脱水,其中100%乙醇的脱水时间为30 min,其他梯度乙醇的脱水时间均为20 min。脱水后的菌丝冷冻真空干燥1 h,最后镀膜。在加速电压 15 kV的条件下用扫描电镜(Vantage VJSM-5610LV)观察菌丝形态。
1.3 数据处理
用SPSS 17.0软件进行统计分析。采用单因素方差分析挥发油及各组分对供试菌抑制效率,不同组分下菌丝分支间距等,采用S-N-K方差分析差异显著性,数据均以平均数 ±方差表示。
2 结果与分析
2.1 茅苍术挥发油对各供试真菌的抑制作用
利用平板生长速率法测定挥发油对3种病原真菌、2种内生真菌的抑制率。由图1可知,随着挥发油浓度增加,其对真菌的抑制率逐渐提高,在低浓度(12.5 μg/ml和25.0 μg/ml)下,腐皮镰刀菌和交链孢的生长抑制大于AL12。当挥发油浓度增加到200 μg/ml以上时,3种病原真菌受抑制程度均大于2种内生真菌,表明高浓度挥发油虽然可在一定程度上抑制内生真菌的生长,但其对于病原真菌的抑制作用更强烈。当挥发油浓度为800 μg/ml时,交链孢、腐皮镰刀菌、尖孢镰刀菌的抑制率分别达到77.56%、71.75% 和70.07%,而AL11和AL12的抑制率分别为61.90%和23.57%。
挥发油对各供试菌菌丝生长的毒力测定结果(表1)表明,挥发油对交链孢、腐皮镰刀菌、尖孢镰刀菌、AL11和AL12菌丝的生长抑制活性依次降低。挥发油对病原真菌中的茅苍术自身病原菌交链孢的毒力最强,其 IC50最低,为159.050 9 μg/ml,而对内生真菌AL11和AL12的毒力都明显低于所有病原菌,IC50分别为422.766 1 μg/ml、782.039 3 μg/ml。

图1 不同浓度挥发油对供试真菌菌丝的抑制率Fig.1 Growth inhibitory effect of Atractylodes lancea volatile oil on tested strains
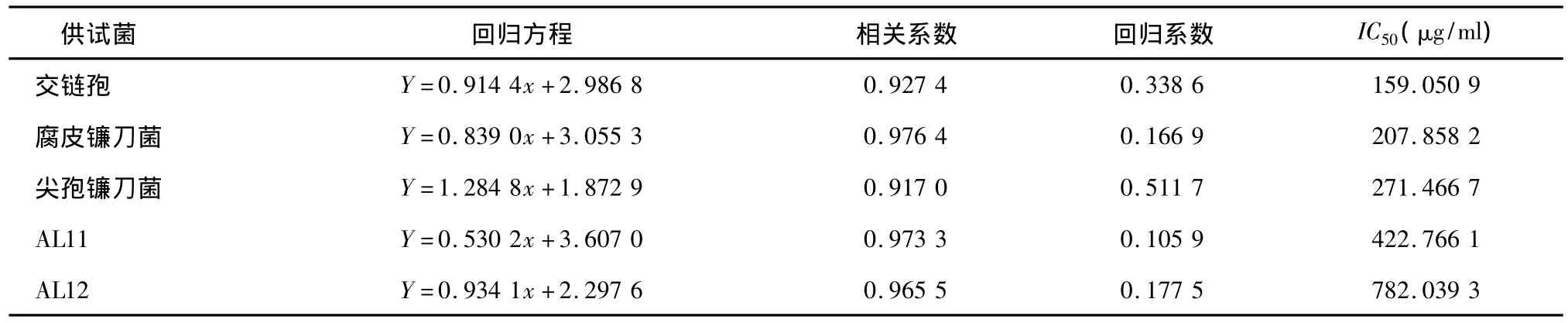
表1 挥发油对供试真菌生长毒力分析Table 1 The virulence of A.lancea volatile oil to tested strains
通过平板滤纸片扩散法测定挥发油及各组分对3种病原真菌、2种内生真菌的抑菌圈直径。从表2可以看出,挥发油对5种供试菌均可形成抑菌圈。β-桉叶醇和茅术醇滤纸片对5种供试真菌均未形成抑菌圈,菌落紧贴滤纸片边缘。苍术酮和苍术素对交链孢、腐皮镰刀菌形成的抑菌圈直径大于尖孢镰刀菌,苍术酮对AL12无抑制作用,对AL11形成较小的抑菌圈。和苍术酮相比,苍术素对病原真菌、内生真菌形成的抑菌圈直径较大。
挥发油及其两种组分苍术酮和苍术素对病原真菌都显示出较强的抑菌效果,对内生真菌的影响较小。这可能是内生真菌适应了宿主体内高浓度挥发油的环境,而这种适应能力在更高浓度的挥发油2种组分苍术酮和苍术素的胁迫下会在一定程度上被破坏,从而显示出一定程度的抑制。挥发油和各组分对尖孢镰刀菌的次级代谢物的产生有抑制能力,尖孢镰刀菌试验组对照培养基中初始菌落为白色,1 d后迅速产生紫色的代谢物,而添加挥发油和各组分后,2 d后才产生紫色代谢物且颜色较对照组浅。
2.2 挥发油各组分对病原真菌孢子萌发的影响
既然β-桉叶醇和茅术醇对内生真菌、病原真菌均无抑制作用,说明苍术酮和苍术素可能是茅苍术与其内生真菌建立拮抗平衡的关键物质,因此后续试验有必要以苍术酮和苍术素为材料进一步具体考察其对病原真菌和内生真菌的影响。由表3可知,当苍术素浓度为0.1 mg/ml时,交链孢和尖孢镰刀菌的孢子萌发率分别为56.69%和70.64%,与对照有显著差异,而腐皮镰刀菌在苍术素浓度达到0.3 mg/ml时才受到显著影响,此时其孢子萌发率降至75.27%。当苍术酮浓度为0.2 mg/ml时,交链孢和尖孢镰刀菌的孢子萌发率才显著降低,分别为33.44%和66.92%,腐皮镰刀菌的孢子萌发率在苍术酮浓度为0.5 mg/ml时才受到影响,为69.94%。综合分析,苍术素对病原真菌孢子萌发的抑制效果大于苍术酮,并且对于交链孢、尖孢镰刀菌、腐皮镰刀菌孢子萌发率的影响呈依次降低趋势。

表2 茅苍术挥发油及各组分对供试菌的抑菌圈直径Table 2 Inhibition zone diameters of A.lancea volatile oil and its components to tested strains
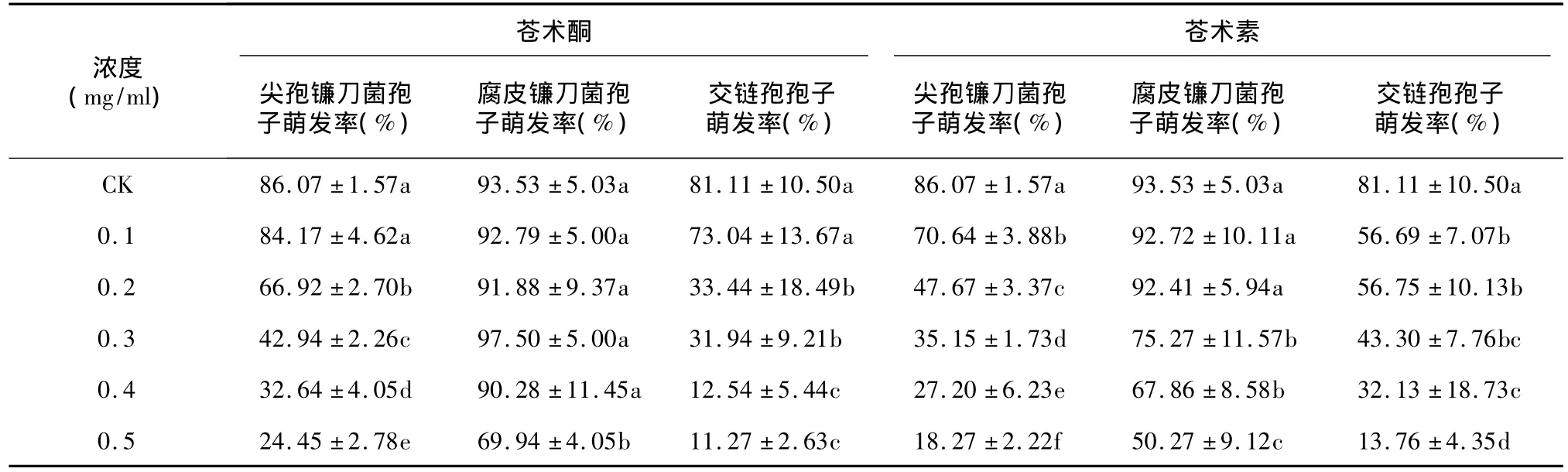
表3 苍术酮和苍术素对供试菌孢子萌发的影响Table 3 Effect of different concentrations of atractylon and atractydin on sporulation of tested strains
2.3 苍术酮、苍术素对供试菌菌丝形态的影响
在添加苍术酮、苍术素的PDA培养基上,以5种供试菌作为试验材料,显微观察(×20)其菌丝生长情况。交链孢、AL11和AL12的菌丝分支增多(图2),菌丝分支间距离明显变短,而对尖孢镰刀菌和腐皮镰刀菌的菌丝分支影响不明显(表4)。从图2可以看出,在0.2 mg/ml的苍术酮和0.1 mg/ml的苍术素条件下,内生真菌AL11(图2 A1,图2 A2)和病原菌交链孢(图2 B1,图2 B2)的菌丝分支较其对照(图2A,图2B)多,分支间距离较短;但上述浓度的苍术酮和苍术素处理的AL12的菌丝分支间距离(图2C1、图2C2)与对照(图2C)相比并无显著差异。

表4 不同挥发油组分下供试菌菌丝分支间距Table 4 Distance between hyphal branches of pathogenic fungi exposed to different components of volatile oil
以病原菌交链孢和内生真菌AL11作为试验材 料,扫描电镜观察其菌丝在苍术酮和苍术素下生长情况。对照组中菌丝形态光滑,呈线状(图3E,3F)。苍术酮处理交链孢后,菌丝异常断裂(图3A)或明显断痕(图3B)导致细胞内物质的流失;苍术素处理后,交链孢菌丝表面有疣状突起(图3C)和菌丝异常褶皱(图3D)。对于内生真菌AL11,在苍术酮试验组中的菌丝与对照无显著差异(图3I),而在苍术素试验组中菌丝表面也呈现类似的疣状突起(图3G)或者在菌丝表面有发疱现象(图3H)。

图2 苍术酮、苍术素下菌丝生长情况Fig.2 Growth of hyphae exposed to atractlon and atractydin
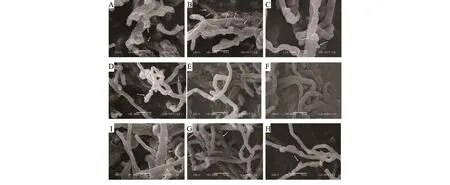
图3 苍术酮、苍术素对供试真菌菌丝扫描电镜结果Fig.3 Scanning electron microscopy of hyphae exposed to atractylon and atractydin
3 讨论
由于内生菌在植物体内普遍存在,因而内生菌与宿主植物之间的互作研究已经成为教科书中微生物介导植物与草食动物之间关系的一种“模型”。内生菌一般分为两类,一类来源于种子,称为垂直传播型;另一类来源于外界随机的感染,称为水平传播型[18]。大部分内生菌属于后者,和前者相比,后者增加了传染性传播的机会和毒力[19],而宿主产生的次级代谢物是平衡内生菌与宿主的关键物质。根据传播方式和生殖方式,内生菌与植物关系从对抗进化为互惠共生[20]。这种互惠共生关系不仅表现为内生菌促进宿主植物生长(生理生化指标的提高)、次级代谢物的积累[21],还表现在宿主受到生物胁迫时,内生菌产生能抑制病原菌的物质[22]。内生菌拥有某些与病原菌相类似的结构,这些结构都是引发植物排斥反应的信号分子。内生菌从体外侵入植物必然伴随着植源性活跃诱导子的释放,因此,内生菌在长期进化中形成了克服宿主非特异性防御的机制维持自身在宿主体内的生态位并保持宿主细胞完整性。虽然内生菌能够适应宿主体内环境,但宿主植物也通过某种机制严格限制内生菌的生长,研究发现高浓度茅苍术挥发油限制内生真菌的生长,导致菌丝分支增多,菌丝生长减慢,气生菌丝不发达[23]。
药用植物产生的活性物质通常具有抑菌、抗病毒、抗肿瘤等功效,其体内的内生真菌存在某种适应机制以应对植物体内产生的有毒物质。茅苍术挥发油是宿主植物代谢产生的限制内生真菌过度生长的因子。本研究抑菌试验发现茅苍术挥发油对于土传病原真菌尖孢镰刀菌和腐皮镰刀菌均有良好的抑菌效果。研究发现茅苍术与花生间作时,根系分泌的挥发油抑制了土壤病原菌的生长,促进有益微生物的生长从而提高了花生的产量[24]。挥发油4种主要成分中苍术酮和苍术素对病原真菌的孢子萌发有强烈抑制能力。Zhen等[25]发现苍术酮可以有效减缓由CCL4引起的小鼠肝中毒,Jeong等[26]的研究结果也表明苍术酮对关节炎、支气管炎、呼吸道感染等疾病有一定的药理活性。苍术素对大肠杆菌和金黄色葡萄球菌有抑制作用[27],但是对真菌的抑制作用鲜有文献报道,我们首次发现挥发油及其组分苍术酮和苍术素对植物病原真菌有极强的抑制作用,可以应用于对该病害的防治。病原真菌在含有苍术酮和苍术素的培养基上生长导致菌丝褶皱、断裂,可能是由于菌丝特定位点上囊泡的缺失引起,从而影响了病原菌胞吐过程[28],阻断了病原菌代谢,限制其生长。
茅苍术挥发油对内生真菌生长的限制作用弱于病原真菌,体外试验结果证明茅苍术挥发油对内生真菌生长的抑制率较低,但苍术酮和苍术素能导致内生真菌菌丝分支增多,在一定程度上抑制菌体生长,这与课题组之前的研究结果[23]一致。说明内生真菌在茅苍术体内生长受到苍术酮和苍术素的抑制,苍术酮和苍术素很可能是内生真菌与宿主建立拮抗平衡的关键物质。
[1] 周 洁,郭兰萍,黄璐琦,等.基于道地药材标准的炮制苍术挥发油变化规律研究[J].中国中药杂志,2009,44(8): 567-570.
[2] 陈佳昕,戴传超,李 霞.茅苍术内生真菌的分离鉴定及在组培苗中的回接[J].广西植物,2008,28(2):256-260.
[3] 方 芳,戴传超,王 宇.一氧化氮和过氧化氢在内生真菌小克银汉霉属AL4诱导子促进茅苍术细胞挥发油积累中的作用[J].生物工程学报,2009,25(10):1490-1496.
[4] 张 波,戴传超,方 芳,等.三种内生真菌对茅苍术组培苗的生长及主要挥发油成分的影响[J].生态学杂志,2009,28 (4):704-709.
[5] RODRIGUEZ R J,WHITE J F,ARNOLD A E,et al.Fungal endophytes:diversity and functional roles[J].New Phytologist,2009,182(2):314-330.
[6] LI Y C,TAO W Y,CHENG L.Paclitaxel production using coculture of Taxus suspension cells and paclitaxel producing endophytic fungi in a co-bioreactor[J].Applied Microbiology and Biotechnology,2009,83(2):233-239.
[7] 李 霞,王 超,任承刚,等.植物内生真菌B3和不同施氮量对水稻生长和产量的影响[J].江苏农业学报,2009,25(6): 1207-1212.
[8] 王兰英,廖凤仙,骆焱平.九里香内生真菌HBS-1的鉴定及其对芒果采后病害的防效[J].江苏农业学报,2012,28(1): 41-45.
[9] RAHMAN M H,SAIGA S.Endophytic fungi(Neotyphodium coenophialum)affect the growth and mineral uptake,transport and efficiency ratios in tall fescue(Festuca arundinacea)[J].Plant and Soil,2005,272(1-2):163-171.
[10]WANG Y,DAI C C,CAO J L,et al.Comparison of the effects of fungal endophyte Gilmaniella sp.and its elicitor on Atractylodes lancea plantlets[J].World Journal of Microbiology and Biotechnology,2012,28(2):575-584.
[11]SUO Y Y,LEUNG D W M.Elevation of extracellular β-1,3-glucanases and chitinase activities in rose in response to treatment with acibenzolar-S-methyl and infection by D.rosae[J].Journal of Plant Physiology,2001,158(8):971-976.
[12]KOGEL K H,FRANKEN P,HÜCKELHOVEN R.Endophyte or parasite-what decides?[J].Current Opinion in Plant Biology,2006,9(4):358-363.
[13]BOUARAB K,MELTON R,PEART J,et al.A saponin-detoxif-ying enzyme mediates suppression of plant defences[J].Nature,2002,418(6900):889-892.
[14]李 蕾,刘付燕,任承钢,等.1株选择性降解茅苍术挥发油的内生真菌筛选与鉴定[J].中国中药杂志,2012,37(19): 2855-2862.
[15]赵翔宇.苍术挥发油指纹图谱研究及2株真菌对茅苍术组培苗的影响[D].南京:南京师范大学,2014.
[16]ZHAO J L,MOU Y,SHAN T J,et al.Antimicrobial metabolites from the endophytic fungus Pichia guilliermondii isolated from Pairs polyphylla var.yunnanensis[J].Molecules,2010,15 (11):7961-7970.
[17]CARDOSO C,CHARNIKHOVA T,JAMIL M,et al.Differential activity of Striga hermonthica seed germination stimulants and Gigaspora rosea hyphal branching factors in rice and their contribution to underground communication[J].PLoS ONE,2014,9 (8):e104201.
[18]YANG T,CHEN Y,WANG X X,et al.Plant symbionts:keys to the phytosphere[J].Symbiosis,2013,59(1):1-14.
[19]KARI S,SAARI S,HELANDER M.Defensive mutualism between plants and endophytic fungi?[J].Fungal Diversity,2010,41 (1):101-113.
[20]SAIKKONEN K,LEHTONEN P,HELANDER M,et al.Model systems in ecology:dissecting the endophyte-grass literature[J].Trends in Plant Science,2006,11(9):428-433.
[21]LUDWIG-MÜLLER J.Plants and endophytes:equal partners in secondary metabolite production?[J].Biotechnology Letters, 2015,37(7):1325-1334.
[22]ALY A H,DEBBAB A,KJER J,et al.Fungal endophytes from higher plants:a prolific source of phytochemicals and other bioactive natural products[J].Fungal Diversity,2010,41(1):1-16.
[23]王 宇,戴传超,陈 晏.茅苍术挥发油对三种内生真菌及其中外源真菌的抑菌活性[J].应用生态学报,2009,20(11): 2778-2784.
[24]戴传超,谢 慧,王兴祥,等.间作药材与接种内生真菌对连作花生土壤微生物区系及产量的影响[J].生态学报,2010,30 (8):2105-2111.
[25]ZHEN O Y,ZHANG L,ZHAO M,et al.Identification and quantification of sesquiterpenes and polyacetylenes in Atractylodes lancea from various geographical origins using GC-MS analysis[J].Revista Brasileira de Farmacognosia Brazilian Journal of Pharmacognosy,2012,22(5):957-963.
[26]JEONG S I,KIM S Y,KIM S J,et al.Antibacterial activity of phytochemicals isolated from Atractylodes japonica against methicillin-resistant staphylococcus aureus[J].Molecules,2010,15 (10):7395-7402.
[27]CHEN Y J,WU Y X,WANG H X,et al.A new 9-nor-atractylodin from Atractylodes lancea and the antibacterial activity of the atractylodin derivatives[J].Fitoterapia,2012,83(1):199-203.
[28]YAHYAZADEH M,OMIDBAIGI R,ZARE R,et al.Effect of some essential oils on mycelial growth of Penicillium digitatum Sacc[J].World Journal of Microbiology and Biotechnology,2008,24(8):1445-1450.

