氨基酸对7B50铝合金在1 mol/L NaCl+0.1 mol/L HCl溶液中缓蚀性能的影响
杨标标 ,孙擎擎,孙睿吉 ,邵首祺,刘 洋,陈康华
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;2. 中南大学 材料科学与工程学院,长沙 410083)
7×××系铝合金因其具有低密度、高强度、高塑性,以及优良的导电性、导热性和抗蚀性,在航空航天领域被广泛使用[1]。铝合金表面暴露在空气中或水中便会形成致密的氧化铝薄膜,从而阻止了腐蚀介质与铝原子的接触,但在含 Cl-的溶液中,Cl-的存在会破坏氧化膜,引起铝合金表面发生局部腐蚀[2]。众所周知,抑制金属腐蚀常用的方法是添加缓蚀剂[3]。在过去几十年的研究中,铝合金酸用缓蚀剂大致分为无机型缓蚀剂与有机型缓蚀剂,早期研究较多的是无机型缓蚀剂,如铬酸盐和钼酸盐等,然后发展到有机缓蚀剂[4]。同时,随着人们环保意识的不断增强,绿色天然缓蚀剂是高效的环境友好型缓蚀剂开发研究中的一个重要方向[5]。氨基酸类缓蚀剂由于其绿色环保、价格低廉、来源广泛等优点,得到了很多科研工作者的青睐,并已应用到某些腐蚀防护领域[6-13]。
氨基酸作为缓蚀剂主要是由于富电子元素或基团良好的吸附性能,因此,氨基酸大多是吸附型缓蚀剂。曲济方等[14]研究过由豆类水解所得复合氨基酸对 A3钢的缓蚀性能,发现豆类水解所得复合氨基酸缓蚀剂具有很高实用价值,该缓蚀剂在碳钢常温酸洗液中添加浓度为0.01mol/L时缓蚀效率大于90%。含有芳环结构的氨基酸(如色氨酸)由于离域 π键的作用,使其容易吸附在合金的表面,具有较好的缓蚀性能[15]。WANEES等[16-17]通过实验发现含S原子与N原子的有机化合物也显示出良好的缓蚀性能。有研究表明,含S氨基酸如蛋氨酸、半胱氨酸以及胱氨酸在低碳钢、碳钢和铝合金中具有优异的缓蚀性能[16-19]。半胱氨酸带有巯基,巯基上的氢离子能够在水中游离,而它的负离子与金属离子结合形成十分牢固的络合物保护膜,这一层十分紧密的保护膜层防止金属被进一步侵蚀。AMIN等[19]研究丙氨酸、半胱氨酸和甲基半胱氨酸对铁的缓蚀作用,发现半胱氨酸具有最高的缓蚀效率。含咪唑类化合物已经广泛应用于防腐领域[20]。组氨酸含有咪唑基团,咪唑环含有未配对电子元素N,是一个富电子的基团,容易吸附在金属表面。BOBINA等[21]研究了组氨酸在弱酸环境中对碳钢的缓蚀性能,发现组氨酸为混合型缓蚀剂,0.01 mol/L的组氨酸在室温下的缓蚀效率为81.6%。此外,外部因素如温度、pH值以及缓蚀剂浓度对缓蚀效率的影响也很大。2004年,ASHASSI-SORKHABI[22]等曾采用多种氨基酸作为缓蚀剂研究在混酸溶液中对铝的缓蚀能力,发现随着浓度升高,温度降低,缓蚀效率增加,且缓蚀效率的大小依次为色氨酸、蛋氨酸、脯氨酸、亮氨酸、缬氨酸、丙氨酸。然而,SILVA等[23]发现低浓度的半胱氨酸对 304不锈钢是缓蚀剂,但在较高浓度下(高于10-4mol/L)半胱氨酸促进不锈钢钝化膜的溶解。然而,与含特殊吸附基团的氨基酸在碳钢及不锈钢的缓蚀领域取得长足进展不同,氨基酸类缓蚀剂在铝合金尤其是7×××系铝合金的研究还较少。
本文作者以 7B50超高强铝合金为研究对象,以静态失重法、电化学阻抗谱法与SEM等方法为手段,研究了苯丙氨酸、蛋氨酸、半胱氨酸和组氨酸在含氯离子的酸性溶液中对 7B50铝合金的缓蚀作用,分析了缓蚀剂浓度和温度对缓蚀效率的影响,并初步探讨氨基酸的缓蚀机理。
1 实验
1.1 实验原料
实验材料为东北轻合金有限责任公司提供的7B50铝合金板材,合金成分如表1所示。固溶温度是480 ℃,保温 30 min;时效制度为回归再时效 T77(120 ℃,24 h,空冷+180 ℃,0.5 h,水冷+120 ℃,24 h,空冷)。腐蚀面为轧制面侧面。线切割加工成铝板或铝块,经打磨(依次用400号、800号、2000号的金相砂纸),抛光,超声清洗(依次为去离子水、乙醇、去离子水),冷风吹干待用。L-蛋氨酸(Met)、L-丙苯氨酸(Phe)、L-半胱氨酸(Cys)、L-组氨酸(His)为分析纯(国药集团化学试剂有限公司提供),各氨基酸的结构式如图1所示。

表1 7B50铝合金的合金成分Table 1 Composition of 7B50 Al alloy (mass fraction, %)
1.2 实验方法
实验溶液为1 mol/L NaCl+0.1 mol/L HCl溶液(空白溶液)以及添加了1、5和50 mmol/L上述氨基酸的溶液(缓蚀溶液),试验温度分别为25、35、45 ℃。铝片称取质量后静态悬挂于上述介质中18 h,然后将铝片取出,用蒸馏水冲洗,再经无水乙醇超声清洗,室温干燥后称质量。每个试验点的平行试样为3个。
缓蚀效率 (Inhibition efficiency, Ei)的计算通过公式:

式中:vfree代表铝合金空白溶液中的腐蚀速率;vadd为加入缓蚀剂后铝合金的腐蚀速率。
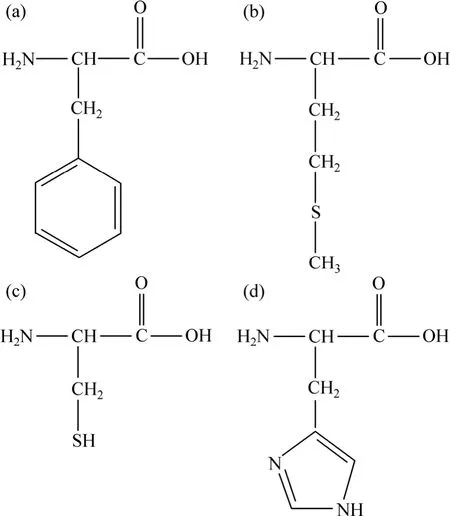
图1 氨基酸的结构式Fig. 1 Chemical structures of amino acids: (a) Phe; (b) Met;(c) Cys; (d) His
采用上海辰华生产的CHI 660C型电化学工作站进行电化学阻抗谱(Electrochemical impendence spectroscopy, EIS)的测量。试样的电化学测试采取三电极体系,试样本身为工作电极,对电极为Pt片电极,饱和甘汞电极 (SCE)为参比电极。工作电极放入特制腐蚀电极槽中,该电极槽可以确保电极裸露面积为0.5 cm2。电化学测试介质分别为含1、5和50 mmol/L上述氨基酸的1 mol/L NaCl + 0.1 mol/L HCl溶液,实验温度为25、35、45 ℃。实验测试前的浸泡时间为1 h。待电位稳定后在开路电位下进行电化学阻抗谱的测试,采用的频率是1 Hz~10 kHz,正弦信号幅值相对于开路电位为10 mV。所有的EIS测试均在法拉第电笼中进行。用ZView2软件对EIS数据进行拟合。
将处理好的铝合金片分别置于空白溶液和4种缓蚀溶液 (氨基酸浓度均为0.05 mol/L)中,实验温度分别为25和45 ℃,放置2 h后取出进行金相表征,金相设备型号为LEICA NEOPHOT-21。

表2 经失重法计算得出的腐蚀速率Table 2 Corrosion rates calculated by mass loss measurements

表3 经失重法计算得出的缓蚀效率Table 3 Inhibition efficiencies calculated by mass loss measurement
2 结果与讨论
2.1 失重法
在不同温度的1 mol/L NaCl+0.1 mol/L HCl溶液中,测量在上述空白溶液(表2中表示为None)以及缓蚀溶液中铝合金样品质量的减少,所得样品腐蚀速率(vrate)如表2所示。根据式(1),可得氨基酸的缓蚀效率随温度和浓度的变化,如表3所示。结果表明:随着氨基酸浓度的增大,腐蚀速率逐渐减小;随着温度的升高,试样的腐蚀速率逐渐增大;4种氨基酸均可降低铝合金的腐蚀速率,具备一定的缓蚀作用;铝合金的缓蚀效率随温度的升高逐渐减小,随氨基酸浓度增大逐渐增大;苯丙氨酸的缓蚀效率较低;含硫氨基酸,即半胱氨酸和蛋氨酸的缓蚀性能优异;组氨酸在低浓度下缓蚀能力相对较差,高温高浓度的条件下性能相对优良。
根据Arrhenius方程,可计算出铝合金腐蚀反应的表观活化能Ea

式中:k为速率常数;R为理想气体常数;A为前置常数。以lgv作纵坐标,T-1作横坐标,可得阿伦尼乌斯图,如图2所示。直线的斜率即为-Ea/(2.303R),线性拟合求得表观活化能Ea,如表4所列。
表观活化能又被称为化学反应的能垒,表观活化能越大,反应越难以进行。从表4可以得出,添加氨基酸后,铝合金腐蚀反应的表观活化能均不同程度地增大,提高了腐蚀反应的能垒,反应速率降低。表观活化能由高到低依次为蛋氨酸(Met)、半胱氨酸(Cys)、丙苯氨酸(Phe)、组氨酸(His)、不加氨基酸(None)。含硫氨基酸较高的表观活化能与它们的优异缓蚀性能相对应。此外,表观活化能还有另外一层物理意义,即其值越小,反应速率随温度变化越缓慢。从表3可以看出,45 ℃的组氨酸介质中铝合金的腐蚀速率最小,缓蚀效率达到最高(77.5%),这是由于铝合金在组氨酸介质中的表面活化能较小,腐蚀速率不随温度升高而剧烈增大,故与其他几种氨基酸相比,其缓蚀性能在温度升高时逐渐变得相对优异。

图2 经失重法计算的7B50铝合金在不同缓蚀剂中的阿伦尼乌斯曲线Fig. 2 Arrhenius plots for 7B50 Al alloy calculated by mass loss measurements in different corrosion inhibitors
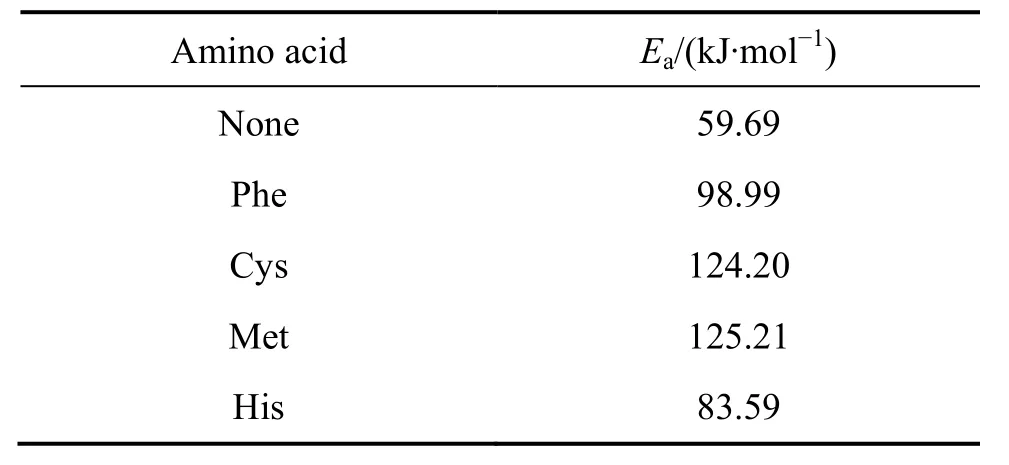
表4 铝合金在含不同氨基酸介质中的表观活化能Table 4 Apparent activation energy of aluminum alloys for different amino acids
2.2 电化学阻抗谱
为了深入了解氨基酸的缓蚀能力和机理,进行电化学阻抗谱测量。图3所示为铝合金在不同氨基酸浓度以及不同温度下的电化学阻抗谱图。采取的等效电路如图4所示[24-25]。从图3(c2)可以看出,25 ℃时0.05 mol/L的His与Met的Nyquist图均出现两个容抗弧,且对应的Bode图上可观测到两个峰。二者EIS曲线所对应的等效电路如图 4(a)所示。两个容抗弧分别对应双电层和吸附层,只有在常温、高浓度的条件下才可以观测到吸附层对应的容抗弧,说明此时的吸附层最为致密、缓蚀效率最佳。其余曲线的拟合等效电路如图5(b)所示,此时吸附层薄弱或疏松,只出现了对应于双电层的容抗弧。其中:Rs是溶液电阻;Rpit是点蚀坑电阻;Rct代表电荷转移电阻;0ctR 代表空白溶液的电荷转移电阻;CPE为常相角元件,当电容指数CPEP为1时,该元件是纯电容,其值为0对应的是纯电阻元件;CPEpit为双电层对应的常相角元件;CPEp为吸附层对应的常相角元件。低频区没有出现Warburg阻抗,说明在该测试条件下铝合金的腐蚀反应受电子转移动力学控制,而非扩散控制,故可以利用Rct来表征铝合金腐蚀速率的快慢。相应的缓蚀效率通过式(3)得到。

分别以25 ℃和45 ℃的高浓度Met为例,以图4(a)和(b)所示的等效电路拟合,如图5所示,这表明上述等效电路的拟合效果良好。

图3 7B50铝合金在不同温度、含不同氨基酸浓度的0.1 mol/L NaCl+0.1 mol/L HCl溶液中的Nyquist图和Bode图Fig. 3 Nyquist and Bode plots for 7B50 Al alloy in 0.1 mol/L NaCl + 0.1 mol/L HCl solution with different concentrations of amino acids at various temperatures: (a1), (a2), (a3) 25 ℃, 1 mmol/L; (b1), (b2), (b3) 25 ℃, 5 mmol/L; (c1), (c2), (c3) 25 ℃, 50 mmol/L; (d1), (d2), (d3) 35 ℃, 50 mmol/L; (e1), (e2), (e3) 45 ℃, 50 mmol/L
图 6所示为电荷转移电阻 Rct与氨基酸浓度和介质温度的关系,表5显示经式(3)计算出来的缓蚀效率。显然,氨基酸浓度越高、温度越低,电荷转移电阻的值越大,说明腐蚀反应的速率越小,这与失重法的结果完全一致。根据图6可知,浓度升高,Rct变大;温度升高,Rct变小。在 5 mmol/L、25 ℃的条件下,4种氨基酸的缓蚀能力由高到低依次为半胱氨酸(Cys)、蛋氨酸(Met)、组氨酸(His)、丙苯氨酸(Phe)。35 ℃与45 ℃下缓蚀性能由高到低依次为半胱氨酸(Cys)、组氨酸(His)、蛋氨酸(Met)、丙苯氨酸(Phe)。由此可见,半胱氨酸的缓蚀性能十分优越。而组氨酸在低浓度下的缓蚀性能相对较差,但较高温度下其缓蚀能力逐渐超越蛋氨酸的,与半胱氨酸接近。经阻抗谱计算的缓蚀效率与失重法相比有一定差异,且主要体现在较高温度(45 ℃)的介质中,这是由于铝合金在高于室温的空白溶液中的Rct过小的缘故。综上所述,阻抗谱的结果与静态失重法的结果基本吻合。
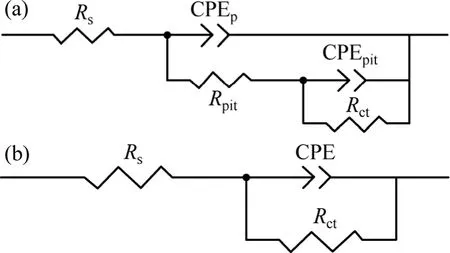
图4 不同条件下电化学阻抗谱等效电路Fig. 4 Equivalent circuits for EIS under different conditions:(a) High concentration and high temperature; (b) Other conditions
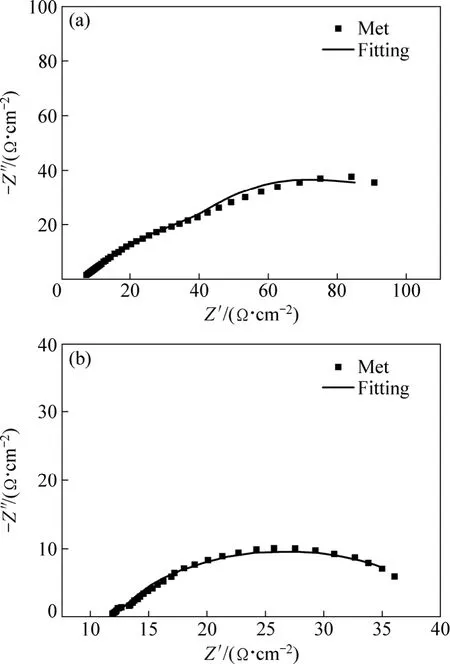
图5 拟合效果图Fig. 5 Fitting plots of EIS: (a) 50 mmol/L Met at 25 ℃; (b)50 mmol/L Met at 45 ℃

图6 电荷转移电阻Rct与氨基酸浓度和介质温度的关系Fig. 6 Relationships between charge transfer resistances of 7B50 and concentration of amino acids (a) and temperature (b)

表5 经电荷转移电阻计算所得缓蚀效率Table 5 Corrosion inhibition efficiencies calculated by charge transfer resistances
有机物可用作缓蚀剂,主要是由于此有机物中含有未配对电子元素、极性基以及其结构中疏水基和亲水基共同作用。这些基团是吸附型的,包括静电吸附、化学吸附和π键吸附。所研究的4种氨基酸中,苯丙氨酸是非极性氨基酸,吸附能力较差,故缓蚀效率相对较低。含N、S等杂原子的氨基酸的缓蚀效率较高,有人总结出杂原子的缓蚀效率由高到低顺序为P、S、N、O[19]。研究中发现,半胱氨酸和蛋氨酸的缓蚀能力较强,这归因于含硫基团的强大吸附作用。与半胱氨酸相比,蛋氨酸的缓蚀效率略差,这是由于蛋氨酸上与S相连的羟基的空间位阻效应,阻碍了富电子S的吸附。组氨酸中含咪唑基团,具有未配对元素N,对铝合金也有一定的缓蚀作用。
除了极性基团,氨基酸类物质同时具有亲水氨基、羧基及憎水—R基。具有一定的表面活性,这种表面活性使氨基酸类缓蚀剂能够在金属/溶液界面上比较活泼的地方产生吸附,结果使界面反应的活化能增大,也使界面的双电层结构发生变化,从而使腐蚀电池的共轭反应中的阴极或阳极受到强烈阻滞,使金属腐蚀的速率急剧降低。另外,极性基团氨基、羧基在金属表面吸附后,非极性基团—R一端在金属表面定向排列,形成疏水薄膜,阻止和腐蚀反应有关的电荷或物质转移,结果使得酸性介质被缓蚀剂分子排挤出来与金属表面隔开,减小了金属的腐蚀速率。
2.3 腐蚀形貌
图7所示为铝合金在含不同氨基酸的介质中不同温度下浸泡2 h并在同一放大倍数下的腐蚀形貌,所加氨基酸浓度均为 0.05 mol/L,温度分别是 25和45 ℃(分别对应图7的左侧部分与右侧部分)。对比图7(a1)、(b1)、(c1)、(d1)、(e1)可知,室温下介质中的铝合金腐蚀严重程度由大到小依次为空白液、Phe、His、Met、Cys,不加任何氨基酸的介质中的铝合金腐蚀最严重,如图7(a1)所示,并有轻微剥落腐蚀的痕迹。另外,添加氨基酸后,铝合金的腐蚀均得到不同程度的缓和。浸泡在含苯丙氨酸的介质中的样品相较于其他3个浸泡在含氨基酸的介质中的样品,腐蚀最为严重,且25 ℃时即出现明显的晶间腐蚀,如图7 (b1)所示,说明苯丙氨酸在这4种氨基酸中的缓蚀性能最差,这与失重法和电化学阻抗谱的结果一致。25 ℃下的蛋氨酸和半胱氨酸中的铝合金表面所受损伤较小,仅发生了轻微的点蚀,且半胱氨酸的稍好(见图 7(c1)及7(d1))。
同样,对比图 7(a2)、(b2)、(c2)、(d2)、(e2)可知,在 45 ℃高温条件下铝合金腐蚀严重程度由大到小依次为空白液、Phe、Met、Cys、His,铝合金在较高温度的空白溶液中发生严重的剥落腐蚀,如图 7(a2)所示,而在添加氨基酸的溶液中则只发生了点蚀和明显的晶间腐蚀,说明高温下氨基酸依旧具备较强的缓蚀作用。此外,在高温条件下,半胱氨酸中的合金表面明显比蛋氨酸中的好很多(见图7(c2)及7(d2))。与室温下的半胱氨酸和蛋氨酸相比,7B50铝合金在25 ℃的组氨酸中的点蚀坑稍微更大,如图 7(e1)所示。然而,当温度继续升高到45 ℃时,虽然组氨酸的点蚀坑进一步增大(见图7(e2)),但总体侵蚀情况好于蛋氨酸的,且与半胱氨酸的接近。这说明了组氨酸在高温条件下相对优异的缓蚀性能,与之前阻抗谱的结果吻合。
比较图7(a1)~(e2)可知,在同种介质条件下,升高温度后,5种介质中的铝合金表面的腐蚀均加剧,且晶间腐蚀更为明显。同时,铝合金的应力腐蚀性能与晶间腐蚀密切相关,合金一旦发生晶间腐蚀,在外加应力作用下极易引发沿晶断裂,从而给航空材料安全带来危害。添加氨基酸后,可以不同程度地减轻铝合金的晶间腐蚀,说明氨基酸的加入降低了 7B50铝合金的应力腐蚀敏感性。
3 结论
1) 随着氨基酸浓度增大和温度的降低,7B50铝合金的腐蚀速率逐渐变小,电荷转移电阻逐渐增大,缓蚀效率逐渐变大。
2) 含硫氨基酸(蛋氨酸和半胱氨酸)缓蚀能力较强,尤其是半胱氨酸在常温下的酸性介质中对 7B50铝合金的缓蚀作用最佳,缓蚀效率高达 94.7%;室温下组氨酸的缓蚀能力低于蛋氨酸和半胱氨酸的,但温度升高缓蚀能力逐渐超过蛋氨酸的并与半胱氨酸的持平;苯丙氨酸的缓蚀效率最差,室温下即发生严重的晶间腐蚀。
3) 室温下,7B50铝合金在空白溶液中发生了严重的晶间腐蚀,添加氨基酸后,铝合金主要发生点蚀,降低了合金的应力腐蚀敏感指数;在较高温度下,7B50铝合金在在空白溶液中出现剥落腐蚀现象,而添加氨基酸后只观测到晶间腐蚀和点蚀,说明所用氨基酸减轻了铝合金的腐蚀程度。腐蚀形貌表明:25 ℃下,氨基酸缓蚀能力由大到小依次为Cys、Met、His、Phe;45 ℃下,氨基酸缓蚀能力由大到小依次为His、Cys、Met、Phe。
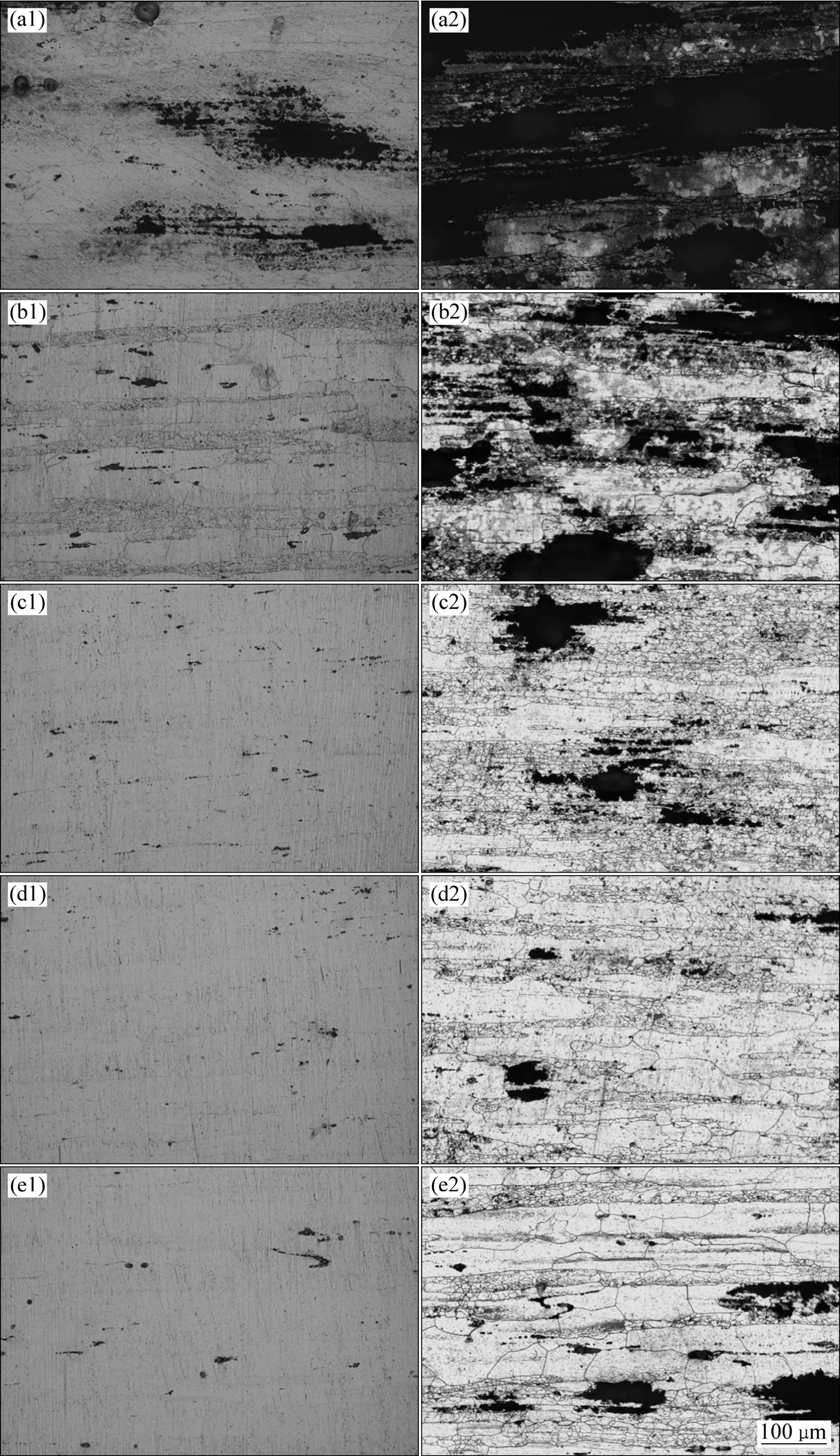
图7 铝合金在不同温度、50 mmol/L氨基酸中的腐蚀形貌Fig. 7 Corrosion morphologies of 7B50 Al alloy in electrolytes with different amino acids of 50 mmol/L at various temperatures:(a1) None, 25 ℃; (a2) None, 45 ℃; (b1) Phe, 25 ℃; (b2) Phe, 45 ℃; (c1) Met, 25 ℃; (c2) Met, 45 ℃; (d1) Cys, 25 ℃; (d2) Cys,45 ℃; (e1) His, 25 ℃; (e2) His, 45 ℃
[1] 廖文博, 刘心宇, 刘胜胆, 张新明. 剥落腐蚀对 7055铝合金板材力学性能的影响[J]. 中南大学学报(自然科学版), 2012,43(6): 2138-2141.LIAO Wen-bo, LIU Xin-yu, LIU Sheng-dan, ZHANG Xin-ming.Effect of exfoliation corrosion on mechanical properties of 7055 aluminum alloy sheet[J]. Journal of Central South University(Science and Technology), 2012, 43(6): 2138-2141.
[2] 张天胜. 缓蚀剂[M]. 北京: 化工出版社, 2002: 466-471.ZHANG Tian-sheng. Corrosion inhibitor[M]. Beijing: Chemical Industry Press, 2002: 466-471.
[3] 曹楚南. 腐蚀电化学[M]. 北京: 化学工业出版社, 1995:195-198.CAO Chu-nan. Electrochemical corrosion[M]. Beijing:Chemical Industry Press, 1995: 195-198.
[4] 鞠 虹, 李 焰. 金属锌、铝的缓蚀剂研究进展[J]. 腐蚀科学与防护技术, 2006(5): 353-356.JU Hong, LI Yan. State of the art on inhibition for zinc and aluminium[J]. Corrosion Science and Protection Technology,2006(5): 353-356.
[5] 曾宪光, 龚 敏, 罗 宏. 环境友好缓蚀剂的研究现状和展望[J]. 腐蚀与防护, 2007, 28(3): 147-150.ZENG Xian-guang, GONG Min, LUO Hong. Research and development of environmentally friendly corrosion inhibitors[J].Corrosion and Protection, 2007, 28(3): 147-150.
[6] KHALED K F. Electrochemical investigation and modeling of corrosion inhibition of aluminum in molar nitric acid using some sulphur-containing amines[J]. Corrosion Science, 2010, 52(9):2905-2916.
[7] LI X, DENG S, XIE X. Experimental and theoretical study on corrosion inhibition of o-phenanthroline for aluminum in HCl solution[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(4): 1865-1875.
[8] YOO S H, KIM Y W, CHUNG K, KIM N K, KIM J S.Corrosion inhibition properties of triazine derivatives containing carboxylic acid and amine groups in 1.0 M HCl solution[J].Industrial & Engineering Chemistry Research, 2013, 52(32):10880-10889.
[9] 张 军, 燕友果, 任振甲, 胡松青, 乔贵民. 氨基酸缓蚀剂缓蚀性能的实验评价与缓蚀机制分析[J]. 中国石油大学学报(自然科学版), 2010, 34(3): 152-156.ZHANG Jun, YAN You-guo, REN Zhen-jia, HU Song-qing,QIAO Gui-min. Experimental evaluation of inhibition performance and corrosion mechanism analysis of amino acid inhibitors[J]. Journal of China University of Petroleum (Edition of Natural Science), 2010, 34(3): 152-156.
[10] 吴伟明, 杨 萍, 杜海燕, 路民旭, 钟洪鸣. 绿色缓蚀剂氨基酸在抑制金属腐蚀方面的应用[J]. 表面技术, 2007, 35(6):51-52.WU Wei-ming, YANG Ping, DU Hai-yan, LU Min-xu, ZHONG Hong-ming. Application of amino acid in metal corrosion suppression[J]. Surface Technology, 2007, 35(6): 51-52.
[11] SHERIF E M. Comparative study on the inhibition of iron corrosion in aerated stagnant 3.5 wt % sodium chloride solutions by 5-Phenyl-1H-tetrazole and 3-Amino-1, 2, 4-triazole[J].Industrial & Engineering Chemistry Research, 2013, 52(41):14507-14513.
[12] YURT A, AYKIN Ö. Diphenolic Schiff bases as corrosion inhibitors for aluminium in 0.1 M HCl: Potentiodynamic polarisation and EQCM investigations[J]. Corrosion Science,2011, 53(11): 3725-3732.
[13] PRABHU D, RAO P. Coriandrum sativum L.—A novel green inhibitor for the corrosion inhibition of aluminium in 1.0 M phosphoric acid solution[J]. Journal of Environmental Chemical Engineering, 2013, 1(4): 676-683.
[14] 曲济方, 郭鲜竹, 罗锦超. 氨基酸对A 3钢的缓蚀作用及机理研究[J]. 山西大学学报(自然科学版), 1998, 21(4): 49-53.QU Ji-fang, GUO Xian-zhu, LUO Jin-chao. Study on the inhibiting action of complex amino-acid on the A3 steel[J].Journal of Shanxi University (Natural Science Edition), 1998,21(4): 49-53.
[15] 郭学辉, 王 康, 胡百顺, 石茂才, 周生杰, 余海棠. 氨基酸类缓蚀剂缓蚀机理研究进展[J]. 腐蚀科学与防护技术, 2013,25(1): 63-66.GUO Xue-hui, WANG Kang, HU Bai-shun, SHI Mao-cai,ZHOU Sheng-jie, YU Hai-tang. Recent development of the inhibitive mechanism amino acids[J]. Corrosion Science and Protection Technology, 2013, 25(1): 63-66.
[16] ABDELHALEEM S M, ABDELWANEES S, ABDELAAL E E,FAROUK A. Factors affecting the corrosion behaviour of aluminium in acid solutions. I. Nitrogen and/or sulphur-containing organic compounds as corrosion inhibitors for Al in HCl solutions[J]. Corrosion Science, 2013, 68: 1-13.
[17] ABDELAAL E E, ABDELWANEES S, FAROUK A, ABDEL HALEEM S M. Factors affecting the corrosion behaviour of aluminium in acid solutions. II. Inorganic additives as corrosion inhibitors for Al in HCl solutions[J]. Corrosion Science, 2013,68: 14-24.
[18] MORAD M. Corrosion inhibition of mild steel in sulfamic acid solution by S-containing amino acids[J]. Journal of Applied Electrochemistry, 2008, 38(11): 1509-1518.
[19] AMIN M A, KHALED K, MOHSEN Q, ARIDA H. A study of the inhibition of iron corrosion in HCl solutions by some amino acids[J]. Corrosion Science, 2010, 52(5): 1684-1695.
[20] 朱 镭, 于 萍, 罗运柏. 咪唑啉缓蚀剂的研究与应用进展[J]. 材料保护, 2003, 36(12): 4-7.ZHU Lei, YU Ping, LUO Yun-bai. Research progress in imidazoline as corrosion inhibitor[J]. Materials Protection, 2003,36(12): 4-7.
[21] BOBINA M, KELLENBERGER A, MILLET J P, MUNTEAN C,VASZILCSIN N. Corrosion resistance of carbon steel in weak acid solutions in the presence of L-histidine as corrosion inhibitor[J]. Corrosion Science, 2013, 69: 389-395.
[22] ASHASSI-SORKHABI H, GHASEMI Z, SEIFZADEH D. The inhibition effect of some amino acids towards the corrosion of aluminum in 1M HCl+1M H2SO4solution[J]. Applied Surface Science, 2005, 249(1): 408-418.
[23] SILVA A, AGOSTINHO S, BARCIA O, CORDEIRO G, D’ELIA E. The effect of cysteine on the corrosion of 304L stainless steel in sulphuric acid[J]. Corrosion Science, 2006, 48(11):3668-3674.
[24] CHEN S, CHEN K, PENG G, JIA L, DONG P. Effect of heat treatment on strength, exfoliation corrosion and electrochemical behavior of 7085 aluminum alloy[J]. Materials & Design, 2012,35: 93-98.
[25] 孙擎擎, 董朋轩, 孙睿吉, 陈启元, 陈康华. 时效制度对挤压 Al-6.2Zn-2.3Mg-2.3Cu 铝合金电化学腐蚀性能的影响[J].中国有色金属学报, 2015, 25(4): 866-874.SUN Qing-qing, DONG Peng-xuan, SUN Rui-ji, CHEN Qi-yuan,CHEN Kang-hua. Effect of ageing process on electrochemical corrosion property of Al-6.2Zn-2.3Mg-2.3Cu aluminium alloy[J].The Chinese Journal of Nonferrous Metals, 2015, 25(4):866-874.

