溶胶−凝胶法制备含锶生物玻璃及其溶解性
吕凝磊,尹 乒,夏 明,冯芳芳,李 锟,雷 霆
(1.中南大学粉末冶金国家重点实验室,长沙410083;2.中南大学湘雅医院,长沙410008)
骨组织是一种无机复合体,无机组分主要是骨磷灰石,其占骨量的65%左右;有机部分占25%左右,主要包括胶原蛋白、多糖和脂类;另外还有9%左右的水及粘连质等[1−3]。具有特定的生物或生理功能的生物陶瓷材料常常用于骨组织的替代和修复,羟基磷灰石是最早发展出来的一种陶瓷骨替代材料。自Hench在70年代初首先报道具有生物活性的生物玻璃(Na2O-CaO-P2O5-SiO2)以来,以SiO2-CaO-P2O5为主要成分的生物玻璃在生物陶瓷材料领域成为研究热点。目前生物玻璃的制备方法主要有熔融法和溶胶−凝胶法,与传统熔融法相比,溶胶−凝胶法制备的生物玻璃具有材料颗粒小、比表面积大、化学稳定性和生物相容性好的优点。
人体骨组织中还存在Sr、Zn、Mg、Si等微量元素,它们对骨细胞的增殖、骨矿化和提高骨强度等发挥着重要的作用[4−5],因此,将Sr、Zn、Mg等微量元素引入生物陶瓷材料中以增强其物理和生物学性能,成为目前主要的研究方向。BALAMURUGAN[6]和OKI[7]等分别将Mg2+和Zn2+引入生物玻璃中,研究了CaO-ZnO-SiO2-P2O5和CaO-MgO-SiO2-P2O5两种生物玻璃体系的生物学性能。杜瑞等采用质量分数为0.5%的氧化镁和0.5%的氧化锌以取代58S生物玻璃中的氧化钙,模拟体液浸泡试验表明,掺镁和掺锌的生物玻璃可降低羟基磷灰石的早期成核速度[8]。近几年的研究发现[9],锶作为人体重要微量元素,具有促进成骨细胞生长和抑制破骨的作用,Sr元素掺杂改性生物材料的研究已见诸于不少文献,但是文献中对锶改性生物玻璃的生物活性研究存在矛盾的报道。比如TOWLER等[10]研究熔融法制备的SrO-CaO-ZnO-SiO2体系生物玻璃后指出,该体系不能在模拟体液SBF中诱导形成磷灰石层[10],而SHAHRABI等[11]指出溶胶−凝胶法制备的SrO-CaO-SiO2生物玻璃对磷灰石的形成有促进作用。HESARAKI等[12]对摩尔分数高达10%的SrO取代CaO的CaO-SrO-SiO2-P2O5生物玻璃体系研究发现,锶掺杂能够滞迟磷灰石的形成;并且磷灰石晶体的数量随锶含量的增加而减少。该文作者同时指出模拟体液中的Ca2+浓度随锶含量增加而增加,但此结果无法解释高含量锶对磷灰石形成的抑制作用。
锶改性生物玻璃形成磷灰石的生物矿化能力与其自身的组成成分和结构以及溶解速率和溶解释放的离子浓度相关,以CaO-SiO2-P2O5为基础的58S生物玻璃是最常见的生物活性陶瓷材料,因此本实验采用溶胶−凝胶法制备以2%、5%和8%(质量分数)的SrO取代CaO的锶改性生物玻璃(CaO-SrO-SiO2-P2O5)并研究其溶解和生物矿化行为。
1 实验
1.1 样品制备
以58S生物玻璃为基础,分别掺入2%、5%和8%(质量分数)的SrO取代58S生物玻璃中的氧化钙,不同样品成分组成如表1所列。本文采用溶胶−凝胶法制备生物玻璃,将正硅酸乙酯(TEOS)溶于无水乙醇中制成0.8 mol/L的溶液,按TEOS:H2O=1:8的比例加入去离子水,用2N HNO3作为催化剂将pH调至2~4,室温下搅拌1h,再依次加入磷酸三乙酯(TEP)、硝酸钙Ca(NO3)2、硝酸锶Sr(NO3)2搅拌水解各1 h得到溶胶,溶胶在70℃下陈化3天得到凝胶。将凝胶干燥成粉末,然后经过700℃煅烧以除去残留的结晶水和硝酸根得到玻璃粉。最后,将玻璃粉以5%质量分数的聚乙二醇作为粘结剂,在20 MPa压力下压制成直径为14 mm,厚5 mm的片状样品再将样品经700℃煅烧后备用。采用同样的方法制备纯生物玻璃作为对比样。
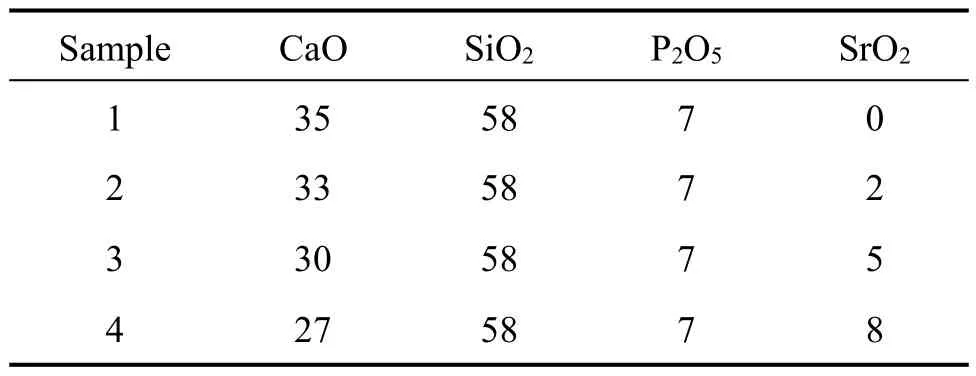
表1 不同样品中各成分的含量Table 1 Contents of samples(mass fraction,%)
1.2 样品的表征
采用X射线衍射仪(RIGAKU,D/MAX-2550型,Cu Ka射线,步长0.02°,扫描速度8(°)/min,管电压和管电流分别为40 kW和250 mA)检测粉末的相组成;采用Nova nanoSEM-230型扫描电镜(SEM)进行微观形貌观察,用Rontec型能谱分析仪(EDS)测定样品的元素含量。
将三羟甲基氨基甲烷(Tris(hydroxymethyl)aminomethane)配制成0.05 mol/L溶液,用1.00 mol/L HCl溶液调节其pH值至7.25,简称Tris缓冲液[13]。按照样品表面积与溶液体积比为1 cm2:20 mL[14],将样品浸泡在Tris缓冲溶液中,在36.8℃恒温10天观测pH值变化。按同样的样品表面积与溶液体积比另将样品浸泡于Hank’s模拟体液[15−16](Simulated body fluid,简称SBF。NaCl 8.0 g/L、KCl 0.4 g/L、CaCl20.14 g/L、NaHCO30.35 g/L、D-C6H12O60.35 g/L、Mg SO4·7H2O 0.2 g/L、KH2PO40.1g/L、Na2HPO4·12H2O 0.06 g/L)中,每天更换模拟体液,观测溶液的pH变化及样品的质量变化。用等离子发射光谱仪(ICP-OES,JOBYVON 70 plus)检测分析Tris缓冲溶液中的Ca2+、Sr2+和PO43−离子的浓度,以此表征样品的溶解速率。
2 结果与讨论
2.1 DSC热质量曲线
采用热质量分析考察锶改性生物玻璃从室温到800℃的热质量曲线,以确定生物玻璃的烧结温度。图1所示是含5%SrO生物玻璃的DSC曲线,从图1可见,生物玻璃在145℃左右出现显著的吸热峰,同时伴随凝胶大量质量损耗,这是因为凝胶内包裹了大量的溶剂和水,由干燥过程中残余的水分蒸发和结晶水分离产生;在306℃左右出现一个明显的放热峰并伴随凝胶质量损耗,推测是由于粉末中残存有机物的分解和燃烧所致。547℃和620℃出现的吸热峰和伴随的质量损耗是由于硝酸盐的分解。从热质量曲线可以看出,700℃以后样品质量损耗趋于平缓,说明凝胶结构不再发生变化,样品中已经不残存任何可分解物质,而据报道[17]CaO-SiO2-P2O5系生物玻璃的结晶温度为800℃左右,所以本实验采用700℃作为煅烧温度。

图1 样品粉末的DSC-TG图Fig.1 DSC-TG curves of powder samples
2.2 XRD物相分析
溶胶−凝胶法制备的纯生物玻璃和不同锶含量改性生物玻璃粉末经700℃煅烧后的XRD物相分析结果如图2所示,由图可见,经700℃煅烧的所有生物玻璃样品均没有明显的衍射峰出现,表现为非晶玻璃态,说明锶掺杂改性并没有改变生物玻璃的微观组织结构。
2.3 含锶生物玻璃的溶解行为和生物矿化
2.3.1 Tris溶液浸泡
用Tris缓冲液作为浸泡液来表征生物玻璃的溶解性能。Tris缓冲液能模拟人体生理环境的pH值,并且只存在H+一种阳离子和Cl−一种阴离子,不含有Ca2+、Sr2+、PO43-等其它离子,能够避免其他离子化学反应的影响,因此,浸泡实验结束后,Tris缓冲液中出现的其他离子都是来自生物玻璃的溶解,分析溶出离子的累积浓度,即可用于表征生物玻璃的溶解速率。

图2 样品粉末经700℃煅烧后的XRD衍射谱Fig.2 XRD patterns of different powder samples calcinated at 700℃
浸泡10天后的Tris溶液中Ca、Sr、P和Si等元素的浓度采用ICP测量的结果如图3所示。溶液中各元素的含量分析表明Ca2+的溶出量最大,并随生物玻璃中Sr含量增加而减小,其它各元素的溶出量均远小于Ca,其中Si元素的溶出几乎不受Sr含量的影响,而Sr元素的溶出量随生物玻璃中锶含量的增加略有增加,此外,P元素的溶出量最少。这一溶解结果表明锶的掺杂改性会显著影响生物玻璃的溶解性,并且随锶含量增加,生物玻璃的溶解速率逐步下降。这主要跟Sr的原子半径和生物玻璃的结构有关,由于Sr原子半径较大,可能会阻止其他离子的释放,从而降低材料的溶解性能[18]。因此,锶改性生物玻璃在Tris溶液中的溶解行为随Sr元素含量增加,溶解性降低,这一结论与Hesaraki等在模拟体液中所发现的Ca2+浓度随锶含量增加而增加的结果相反。
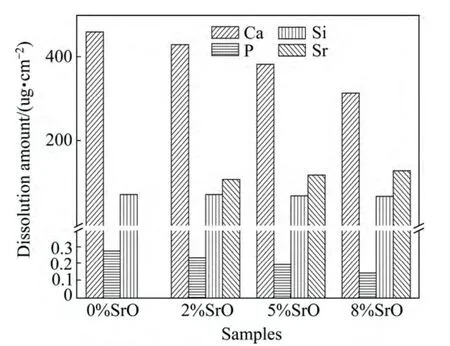
图3 Tris溶液中浸泡10天后不同样品各元素的溶解量Fig.3 Dissolution amount of samples in Tris solution after soaking for 10 days
各生物玻璃在Tris溶液浸泡过程中的pH值变化如图4所示。生物玻璃浸泡于Tris溶液中,首先在其表面发生析碱反应,即表层的碱土离子如Ca2+、Sr2+等在溶液中大量溶出,并与溶液中的H+及H3O+发生离子交换,如式(1)所示。因此,pH值随0H−浓度升高而迅速增大。从图4可以看出纯生物玻璃的pH变化最快,随锶含量增加,pH变化逐渐变慢。pH值的变化反映了生物玻璃的溶解快慢,其变化趋势与溶液中各溶出元素的含量分析结果一致。
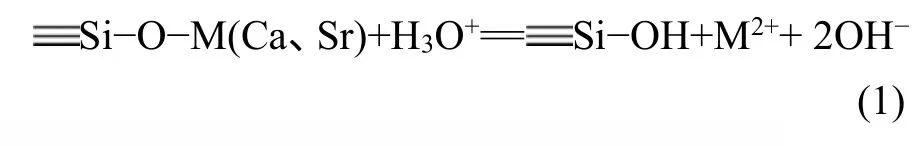
各生物玻璃在Tris溶液中浸泡10天后,用XRD分析表面物相的结果如图5所示。图5表明各生物玻璃样品的表面都有碳酸钙微晶析出。Tris溶液中并没有碳酸根成分,碳酸钙沉积物的析出可能是空气中的CO2溶解于Tris溶液生成的CO32−离子与生物玻璃样品中大量溶解释放的Ca2+反应而成。
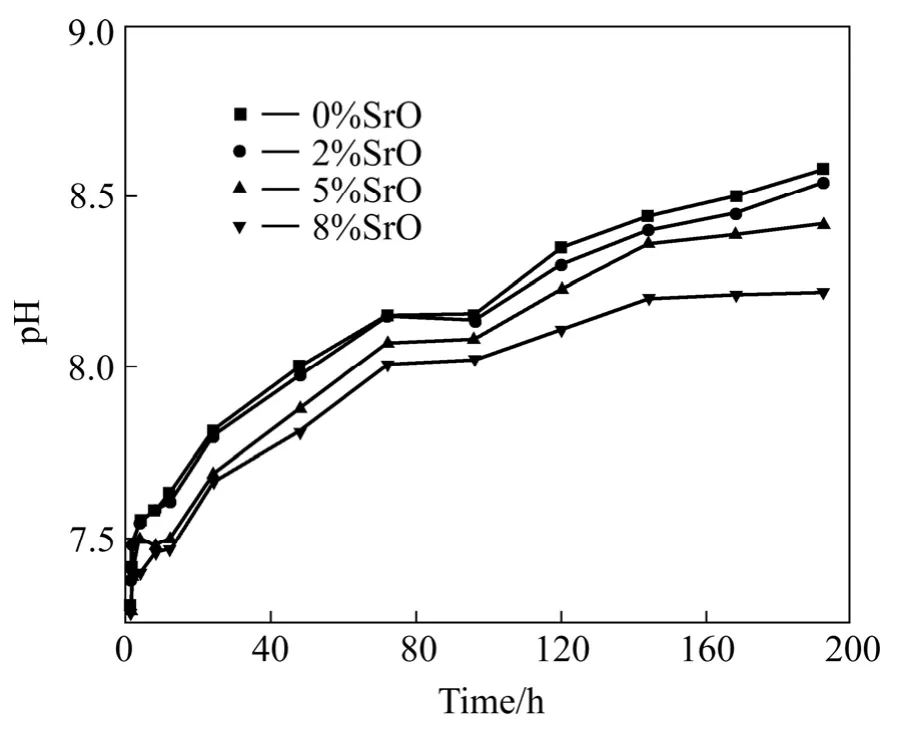
图4 不同样品在Tris溶液中浸泡的pH变化Fig.4 pH values of different samples soaking in various time periods
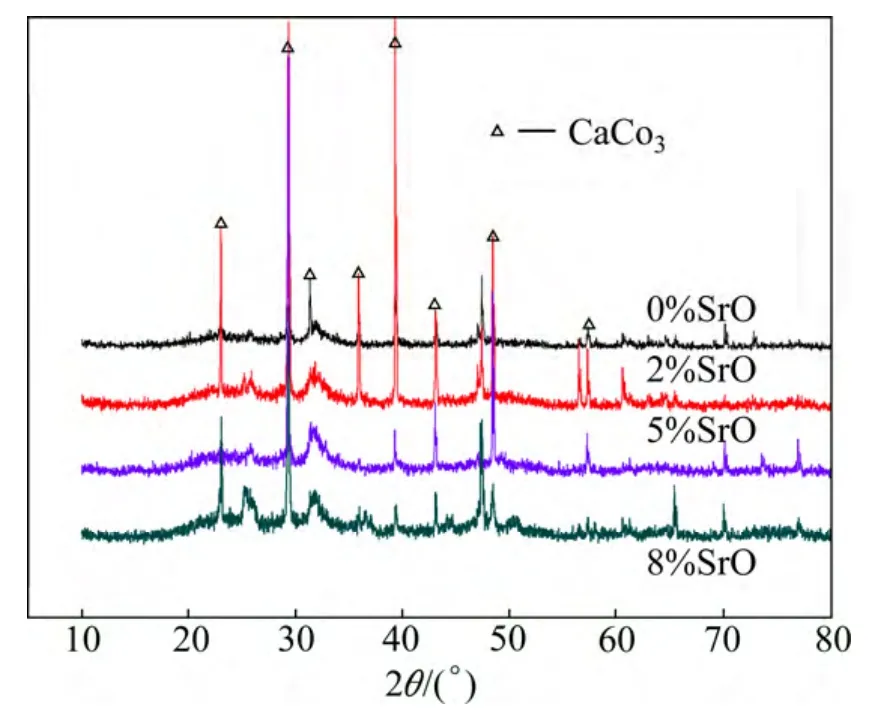
图5 Tris溶液浸泡10天后的生物玻璃XRD图Fig.5 XRD patterns of bioglass samples after soaking in Tris solution for 10 days
图6所示为纯生物玻璃和不同锶含量生物玻璃在Tris溶液中浸泡前和浸泡10天后的SEM显微形貌,从各插入图可见,所有生物玻璃样品浸泡前的表面都有裂纹而且粗糙,浸泡后表面裂缝大部分消失,并且纯生物玻璃和2%、5%SrO含量的生物玻璃样品的表面均出现了一层片状沉积物,图5的XRD分析结果指出,这些沉积物的主要成分是碳酸钙,由此推断,生物玻璃样品在浸泡过程中有一个溶解-再沉积的过程,浸泡初期,通过溶解释放出Ca、Sr元素,图3的溶解结果指出Ca元素的溶解最快,因此,当Ca2+达到一定浓度时,便会与溶液中溶解的CO32-离子结合形成沉淀析出,覆盖于样品表面并填补表面空隙。而与此相对照的是含8%SrO的生物玻璃在浸泡后表面沉积物不明显,但表面划痕消失并趋于平整,说明在浸泡过程中溶解-再沉积的过程较为缓慢,即高锶含量的生物玻璃具有较慢的溶解速率,SEM显微形貌结果与浸泡后Tris缓冲液中测得的各离子浓度表征的生物玻璃的溶解性结果一致。
2.3.2 SBF模拟体液中的生物矿化
图7为各生物玻璃样品在模拟体液浸泡过程中的pH随浸泡时间变化曲线,浸泡过程中保持每天更换新鲜模拟体液,故用ΔpH来表示样品的pH变化。由图可知在浸泡的前4天溶液体系的pH值变化很快,说明生物玻璃处于快速溶解状态,4天后pH变化趋于稳定,这可能是由于溶解−再沉积产生的大量羟基磷灰石覆盖在生物玻璃样品表面,阻碍了样品表面与模拟体液的进一步接触或者减缓了样品中各溶解离子向体相溶液的迁移速度,使溶解速度大大降低。图8为各生物玻璃样品在SBF溶液中浸泡后的质量损耗结果,从图中可以看出,纯生物玻璃表现出最大的质量损耗量,少量锶改性2%SrO含量的生物玻璃的质量损耗与之接近,而随SrO含量增加,生物玻璃的质量损耗量进一步减少,说明纯生物玻璃表现出最快的溶解速率,锶元素掺杂能够有效抑制生物玻璃的溶解,并且随锶含量增加,生物玻璃的溶解速率明显变慢。这一变化趋势与Tris溶液中浸泡的结果一致。

图6 不同生物玻璃样品在Tris溶液中浸泡前(插入图)与浸泡10天后的SEM图Fig.6 SEM images of different bioglass samples before(inset image)and after soaking in Tris solution for 10 days

图7 不同生物玻璃样品在模拟体液(SBF)中浸泡时pH值(ΔpH)随时间变化的曲线Fig.7 Variation of pH for different bioglasses after soaking in SBF for different days
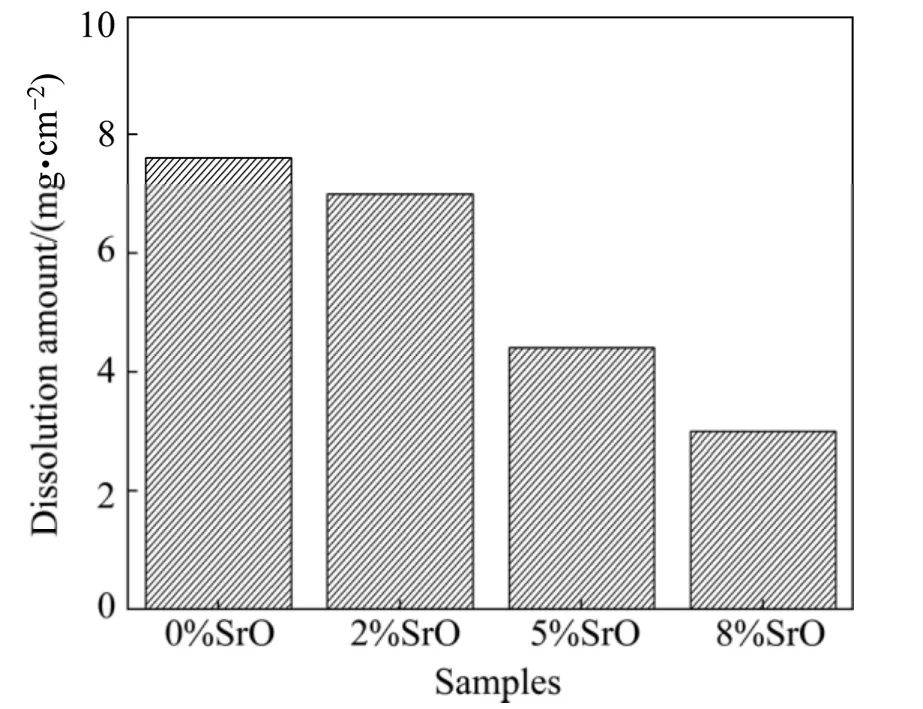
图8 不同生物玻璃样品在SBF溶液中浸泡7天后的质量损耗Fig.8 Mass loss of different bioglass(BG)samples after soaking in SBF for 7 days
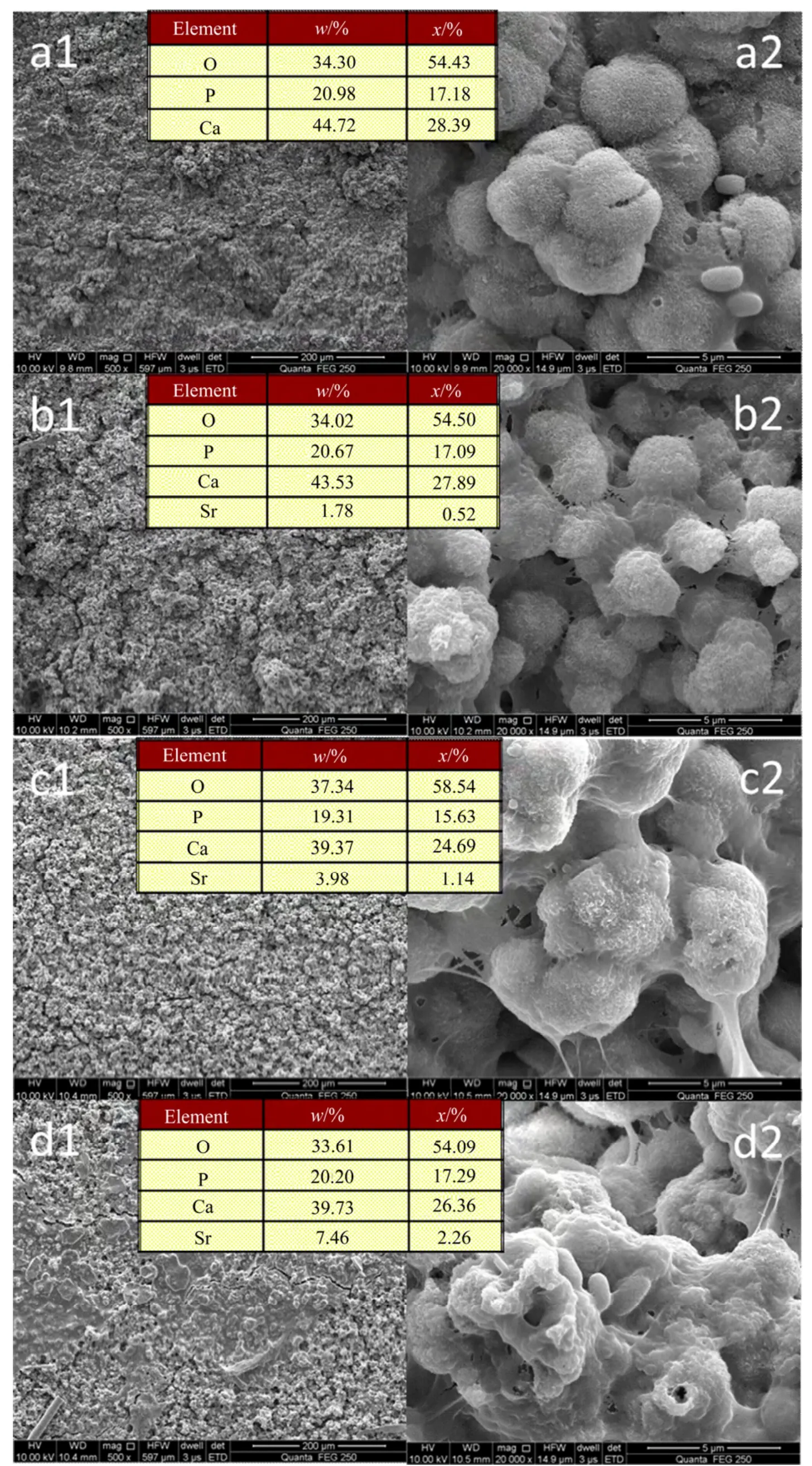
图9 样品浸泡模拟体液后的SEM图Fig.9 SEM images of bioglass samples after soaking in SBF for 7 days
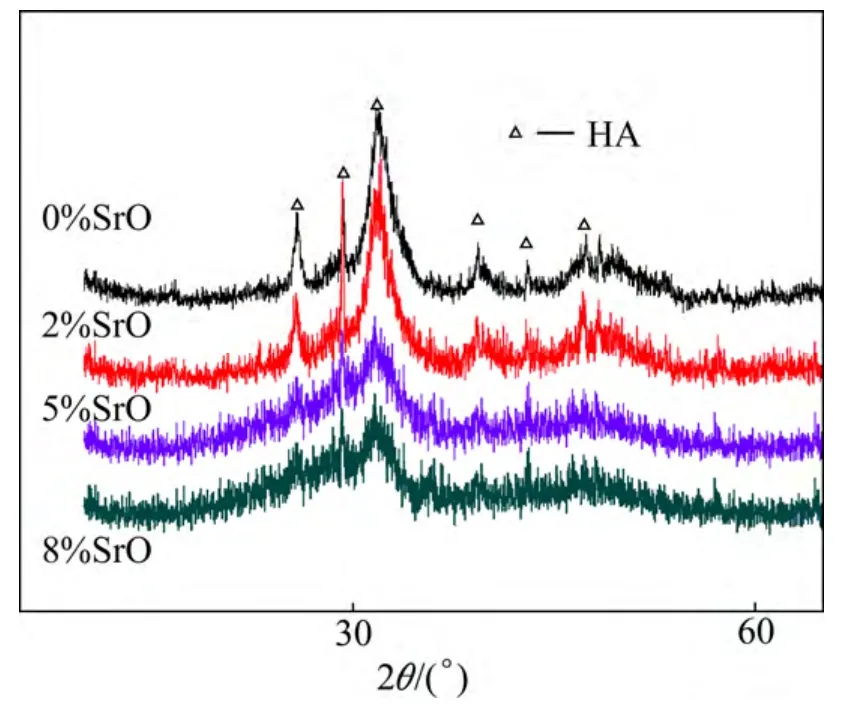
图10 不同样品经过模拟体液浸泡后表面的XRD谱Fig.10 XRD patterns of different bioglass samples after soaking in SBF for 7 days
图9 为各生物玻璃样品在模拟体液中浸泡7天后的SEM微观形貌图,从图中可以看出生物玻璃样品经浸泡后其表面都覆盖了一层沉积物,高倍下观察,这些沉积物成颗粒状堆积。EDS结果指出,沉积物富含Ca、P、Sr和O元素,其中(Ca+Sr)/P化学计量比约为1.65左右,非常接近于羟基磷灰石中Ca/P=1.67的化学计量比。将浸泡后样品表面进行XRD物相分析(图10),出现了明显的羟基磷灰石特征衍射峰(PDF#09-0432,羟基磷灰石标准谱),且峰的位置和强度都与标准衍射峰一一对应,不存在其它杂相,证明这些沉积物是生物矿化产生的羟基磷灰石。此外,通过EDS对沉积物进行成分分析时发现,沉积物中未发现玻璃成分中的Si元素,这可能是因为Si元素的溶解量很小(如前面Tris溶液中的溶解结果证实),溶出的Si元素浓度不足以参与磷灰石的形成。EDS分析还发现沉积物中有Sr元素,证明Sr元素参与了羟基磷灰石的形成,并且随生物玻璃样品中Sr含量增加沉积物中Sr含量逐渐增加。此外,从高倍SEM图可以看出,随Sr含量增加,沉积出的羟基磷灰石颗粒逐渐变大并呈不规则形貌,XRD结果也显示,随Sr含量增加,羟基磷灰石衍射峰峰形变宽,强度变弱,表明其颗粒变粗,结晶性变弱,由此可以推断出Sr元素的加入不仅减缓了生物玻璃的溶解速率,同时还影响羟基磷灰石生物矿化的形成,并弱化其结晶性。人体自然骨中的磷灰石无机相均为弱结晶物[19],因此锶改性生物玻璃不仅可以通过Sr元素的掺杂,调控生物玻璃的溶解速度,改善其作为植入体材料使用的稳定性,而且可进一步提高其生物活性。
3 结论
1)用锶部分取代钙制成的锶改性生物玻璃具有可以调控的溶解速率,锶的加入可以抑制生物玻璃的溶解,随锶含量增加其溶解速率进一步降低,主要原因为锶原子半径较大,阻碍了其他离子的溶解。
2)锶改性生物玻璃具有良好的生物活性,在模拟体液中,锶元素参与生物玻璃的生物矿化,并且随锶元素含量增加,羟基磷灰石的结晶性减弱。
[1]WANG M.Developing bioactive composite materials for tissue replacement[J].Biomaterials,2003,24:2133−2151.
[2]杨志明.组织工程[M].北京:化学工业出版社.2002:1−5.YANG Zhi-ming.Tissue Engineering[M].Beijing:Chemical Industry Press,2002:1−5
[3]SEPULVEDA P,JONES JR,HENCH LL.Bioactive sol-gel foams for tissue repair[J].Biomed Mater Res,2002,59:240−248.
[4]HODGSKIN R,CURREY JD.Young’s modulus,density and materials properties in cancellous bone over a large density range[J].Mater Sci:Mater Med,1992,3:377−381.
[5]TEITELBAUM S.Bone resorption by osteoclasts[J].Science,2000,289:1504−1508.
[6]BALAMURUGAN,BALOSSIER G,MICHEL J,et al.Sol gel derived SiO2-CaO-MgO-P2O5bioglass system-preparation and in vitro characterization[J].J Biomed Mater Res B Appl.Biomaterial,2007,83:546−553.
[7]OKI A,PARVEEN B,HOSSAIN S,et al.Preparation and in vitro bioactivity of zinc containing sol-gel-derived bioglass materials[J].Biomed Mater Res A,2004,69:216−221.
[8]杜 瑞,常 江.含Zn、Mg生物玻璃的制备及性能研究[J].无机材料学报,2004,19(6):1353−1357.DU Rui,CHANG Jiang.Fabrication and properties of bioactive glass contained Zn,Mg[J].Journal of Inorganic Materials,2004,19(6):1353−1357.
[9]GENTLEMAN E,FREDHOLM YC,JELL G,et al.The effects of strontium-substituted bioactive glasses on osteoblasts and osteoclasts in vitro[J].Biomaterials,2010,31(14):3949−3956.
[10]TOWLER M,BOYED D,FREEMAN C,et al.Comparison of in vitro and in vivo bioactivity of SrO-CaO-ZnO-SiO2glass grafts[J].Biomater Appl,2009,23(6):561−572.
[11]SHAHRABI S,HESARAKI S,MOEMENI S,et al.Structural discrepancies and in vitro nanoapatite formation ability of sol-gel derived glasses doped with different bone stimulator ions[J].Ceramics International,2011,37:2737−2746.
[12]HESARAKI S,GHOLAMI M,VAZEHRAD S.The effect of Sr concentration on bioactivity and biocompatibility of sol-gel derived glasses based on CaO-SrO-SiO2-P2O5quaternary system[J].Materials Science and Engineering C,2010,30:383−390.
[13]赵朝霞,翁文剑,曲海波.含氟羟基磷灰石薄膜的溶胶−凝胶制备和溶解特性研究[J].材料科学与工程学报,2005,23(2):226−229.ZHAO Zhao-xia,WENG Wen-jian,QU Hai-bo.Fabrication and in vitro properties of sol-gel derived FHA coatings[J].Journal of Materials Science and Engineering,2005,23(2):226−229.
[14]ASTM-G31-72:standard practice for laboratory immersion corrosion testing of metals.In:Annual book of ASTM standards[S].American Society for Testing and Materials,Philadelphia,PA,2004.
[15]LI Zi-jian,GU Xu-nan,ZHENG Yu-feng.The development of binary Mg-Ca alloys for use as biodegradable materials within bone[J].Biomaterials,2008,9:1329−1344.
[16]冯芳芳,尹 乒,雷 霆,等.钛表面FHA-SrHA双相生物陶瓷涂层的制备及性能[J].粉末冶金材料科学与工程,2013,18(7):72−77.FENG Fang-fang,YIN Ping,LEI Ting,et al.Fabrication and properties of FHA/SrHA biphasic coating on titanium substrate[J].Materials Science and Engineering of Powder Metallurgy,2013,18(7):72−77.
[17]陈晓峰,王迎军,赵娜如,等.溶胶−凝胶生物玻璃多孔材料显微结构和生物活性的扫描电镜及红外光谱分析[J].电子显微学报,2003,08(22):305−309.CHEN Xiao-feng,WANG Ying-jun,ZHAO Na-ru,et al.Microstructure and bioactivity of sol-gel derived porous bioactive glass[J].Journal of Chinese Electron Microscopy Society,2003,08(22):305−309.
[18]DONNELL M D O,HILL R G.Influence of strontium and the importance of glass chemistry and structure when designing bioactive glasses for bone regeneration[J].Acta Biomaterialia,2010,6(7):2382−2385.
[19]PETOLA T,JOKINEN M,RAHIALA H,et al.Calcium phosphate formation on porous sol-gel-derived SiO2and CaO-P2O5-SiO2substrates in vitro[J].Journal of Biomedical Materials Research,1999,44:12−21.

