顶空固相微萃取-气相色谱-质谱联用测定饮用水中的2-甲基异莰醇和土臭素
成建国, 刘开颖*, 白敏冬,2*, 程 超, 余忆玄, 周新颖
(1. 大连海事大学, 辽宁 大连 116026; 2. 厦门大学, 福建 厦门 361102)
研究论文
顶空固相微萃取-气相色谱-质谱联用测定饮用水中的2-甲基异莰醇和土臭素
成建国1, 刘开颖1*, 白敏冬1,2*, 程 超1, 余忆玄1, 周新颖1
(1. 大连海事大学, 辽宁 大连 116026; 2. 厦门大学, 福建 厦门 361102)
2-甲基异莰醇(2-methylisoborneol, 2-MIB)和土臭素(geosmin, GSM)在水源水中大量分泌排放是造成饮用水土霉异味突发事件、引发居民用水恐慌的重用因素之一。使用顶空固相微萃取(HS-SPME)与气相色谱-质谱联用技术(GC-MS)建立了水库水、水库附近土壤、居民自来水中2-MIB和GSM的测定方法。结合正交分析优化了加盐量、萃取温度、萃取时间条件,在电子轰击(EI)-选择离子扫描(SIM)模式下进行了目标物的定性定量分析。结果表明:在5~1 000 ng/L范围内,2-MIB和GSM的色谱峰面积与其质量浓度的线性关系良好(r2≥0.998), 2-MIB与GSM的检出限分别为0.72 ng/L和0.34 ng/L,定量限分别为2.40 ng/L和1.13 ng/L;目标物加标水平为10~600 ng/L时,平均回收率为93.6%~107.7%,相对标准偏差(RSD)≤6.1%(n=6)。基于上述方法,对辽宁省某地区水库水、水库附近土壤、居民自来水中的目标物进行检测,结果表明:水库水目标物质量浓度范围为3.0~3.6 ng/L,水库附近土壤中提取的2-MIB为8.1 ng/L、提取的GSM为17.8 ng/L,居民自来水中的目标物未检出。该方法操作简便、准确可靠,灵敏度高,无需有机溶剂,适合于饮用水中2-MIB和GSM的分析检测。
顶空固相微萃取;气相色谱-质谱;2-甲基异莰醇;土臭素;饮用水;正交分析
近年来,随着河流、湖泊等地表水富营养化加剧,一些藻、菌微生物过度繁殖生长分泌的嗅味物质所引起的饮用水质量问题已经成为环境领域的研究热点。在我国及世界范围内饮用水行业由土霉味物质2-甲基异莰醇(2-methylisoborneol, 2-MIB)和土臭素(geosmin, GSM)导致的水污染普遍存在,尤其是我国的南方水域,地表水极易产生土味、霉味[1,2]。例如,2007年无锡太湖蓝藻暴发,导致大范围自来水发臭,引发了罕见的供水危机,引起了国内外的广泛关注。
研究表明,2-MIB和GSM主要是由蓝绿藻、放线菌分泌产生的天然萜烯醇化合物,是目前已经确认的造成饮用水具有土霉嗅味的主要物质[3]。水中2-MIB和GSM的含量极低,但人的嗅觉对此极为敏感,痕量的这些物质便能使人觉察到令人厌恶的土霉味,从而引起居民用水恐慌。有研究报道人类对2-MIB和GSM的嗅阈值分别为10 ng/L和30 ng/L[4]。尽管目前尚无2-MIB、GSM致死生物的报道,但世界各地消费者对饮用水质量好坏先从色味方面进行评价[5],口感和味道不佳,常使人们误认为饮用水遭到污染而无法放心使用。由于存在对饮用水的感官特性和饮用者接受度的影响,水中2-MIB和GSM的鉴定、定量和去除已成为水质保障必不可少的环节。我国《生活饮用水卫生标准》(GB 5749-2006)[6]对2-MIB和GSM允许限值均为10 ng/L。因此,为了提高消费者对饮用水的安全信任度,保障居民用水安全,建立饮用水中痕量2-MIB和GSM嗅味物质同时检测的分析方法尤为必要。
目前,国内外对水中2-MIB和GSM的检测方法主要分为感官分析法和仪器分析法两大类。感官分析法凭借人的嗅觉进行嗅味分析,受主观因素影响大且无法实现准确定量分析[7]。相比而言,水中痕量2-MIB和GSM主要使用仪器分析,水样经过预处理后采用气相色谱(GC)分离结合质谱(MS)、氢火焰离子化检测器(FID)等完成定性和定量分析。由于2-MIB和GSM在实际样品中含量极低,同时为了降低分析过程中样品基底的干扰,在进行分析检测前必须进行合适的样品前处理。目前用于2-MIB和GSM分析的样品前处理过程主要包括:液-液萃取、静态顶空、吹扫捕集、顶空固相微萃取(HS-SPME)等。Shin等[8]报道了一种液-液萃取水样中嗅味物质的方法,对2-MIB、GSM的检出限不低于50 ng/L、回收率低于75%。Li等[9]建立了静态顶空富集测定水中土霉味物质的方法,能够检测2-MIB和GSM的质量浓度低至0.35 μg/L和0.7 μg/L。Manickum等[10,11]比较了不同吹扫捕集模式对嗅味物质检测灵敏度的影响,建立的吹扫捕集浓缩样品方法对2-MIB和GSM的检出限分别为4 ng/L和7 ng/L,线性范围为5~100 ng/L。Watson等[12]采用顶空固相微萃取结合GC-MS分析方法实现了水中痕量嗅味物质的检测,对水样中2-MIB和GSM的检出范围为1~1 000 ng/L,检测时间为70 min左右。Wu等[13]研究了废水及藻类土霉味物质对饮用水品质的影响,建立的顶空固相微萃取方法对2-MIB和GSM分析的质量浓度范围为1~300 ng/L。Wu等[14]报道了一种顶空固相微萃取结合GC-MS联用检测海洋沉积物中苯系物的方法,在0.500~20.0 ng/g范围内目标苯系物的线性关系良好,方法的检出限为0.081 8~0.175 ng/g (干重)。
尽管液-液萃取、吹扫捕集、静态顶空等方法在嗅味物质鉴别和定量分析方面一直发挥着重要的作用,但某些方面仍存在一定的局限性,如有机溶剂消耗量大、萃取富集效率低、操作复杂、检测灵敏度低,此外吹扫捕集还需要使用昂贵的仪器设备,无法满足特定的嗅味物质分析实验要求。相比较而言,顶空固相微萃取集吸附、浓缩、解吸、进样等功能于一体,是一种无有机溶剂、环境友好、易于实现自动进样的新型样品前处理技术,目前已被饮用水、食品、医药等行业广泛使用[15-17]。
本研究采用正交分析方法优化了顶空固相微萃取实验条件,使用气相色谱-质谱联用技术建立了水库水、水库附近土壤、居民自来水中痕量土霉味物质2-甲基异莰醇及土臭素SPME-GC-MS的测定方法,为饮用水中异味物质的测定及其去除工艺中机理机制的深入研究提供了必要的分析技术支持。
1 实验部分
1.1 仪器与试剂
Agilent 7890A气相色谱仪-5975C质谱检测器(美国Agilent公司), HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm),固相微萃取搅拌加热平台、手动SPME进样器、65 μm聚二甲基硅氧烷/二乙烯基苯(PDMS/DVB)固相微萃取纤维头、搅拌子(3.0 mm×10.0 mm)、40 mL带有聚四氟乙烯(PTFE)涂层硅橡胶垫的螺纹口玻璃样品瓶(美国Supelco公司)。
2-甲基异莰醇和土臭素标准物(100 mg/L甲醇溶液,北京百灵威科技有限公司),甲醇(色谱纯), NaCl(优级纯)经300 ℃灼烧6 h后密封贮存于干燥器内备用,超纯水(18.2 MΩ5cm)取自Milli-Q超纯水系统(法国密里博公司);高纯氦气(99.999%,大连特种气体有限公司)。
1.2 实验条件
1.2.1 固相微萃取条件
新萃取头使用前在250 ℃色谱进样口内活化30 min,顶空萃取瓶中加入20 mL水样和5 g NaCl;磁力搅拌器转速1 200 r/min;萃取温度65 ℃;平衡时间10 min;萃取时间60 min;解吸温度250 ℃,解吸时间3 min。
1.2.2 色谱条件
HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);高纯氦气(99.999%),采用恒流模式,载气流速1.0 mL/min;程序升温控制,初始温度40 ℃(保持2 min),以4 ℃/min升至140 ℃,再以10 ℃/min升至280 ℃; 280 ℃后运行3 min;进样口温度250 ℃,不分流进样。
1.2.3 质谱条件
电子轰击离子源(EI),离子源温度230 ℃,四极杆温度150 ℃,传输线温度280 ℃,电子能量70 eV。选择离子扫描(SIM)模式采集数据。2-MIB定量离子为m/z95,定性离子为m/z95、108和168; GSM定量离子为m/z112,定性离子为m/z112、125和182。
1.3 实验方法
1.3.1 标准溶液的配制
采用外标法定量。用甲醇将100 mg/L的2-MIB、GSM标准品原液逐级稀释配制成1 000 μg/L的混合标准溶液,取0.5 mL分装于1.5 mL离心管中,冷冻保存。准确量取1 000 μg/L标准溶液,使用超纯水逐级稀释配制成1 μg/L的混合标准储备溶液,再经超纯水逐级稀释后得到含2-MIB和GSM质量浓度分别为5、10、30、50、100、200、500、800、1 000 ng/L的系列标准溶液,仅限当日使用。
1.3.2 待测样品的采集
待测样品取自辽宁省某地区水库、水库附近土壤和居民自来水终端,取样时间为2015年4月。对于水库水,使用采水器从水库中央深入水面0.5 m直接取水1 L;对于水库附近土壤,在距离水库边沿100 m地点,去除表面5 cm植被土壤,使用无菌取样器垂直取土壤样品300 g;居民饮用水样则直接使用取水器从市区居民饮用水终端接取1 L。全部待测样品均满装于洁净的棕色玻璃采样瓶中,防止采样瓶顶端存在空气或者样品发生光解作用导致测定结果不准确。除此之外,为了保持样品的原始状态,降低其他不确定因素对测定结果的干扰,取样后需尽快将样品运回实验室,冷藏保存于4 ℃冰箱内,并于48 h内完成待测样品中2-MIB和GSM的测定分析。
1.3.3 待测样品预处理
对于水库水、居民饮用水水样,直接使用0.45 μm滤膜过滤处理,然后准确量取20 mL滤后水样于40 mL萃取瓶中进行顶空固相微萃取;对于土壤样品,取100 g当天采集的新鲜土壤,加入100 mL超纯水,振荡20 min后离心分离,取上层清液经0.45 μm滤膜后准确量取20 mL水样于40 mL萃取瓶中进行顶空固相微萃取。固相微萃取及气相色谱-质谱联用分析按照1.2节的实验条件进行。
2 结果与讨论
2.1 色谱-质谱条件的确定
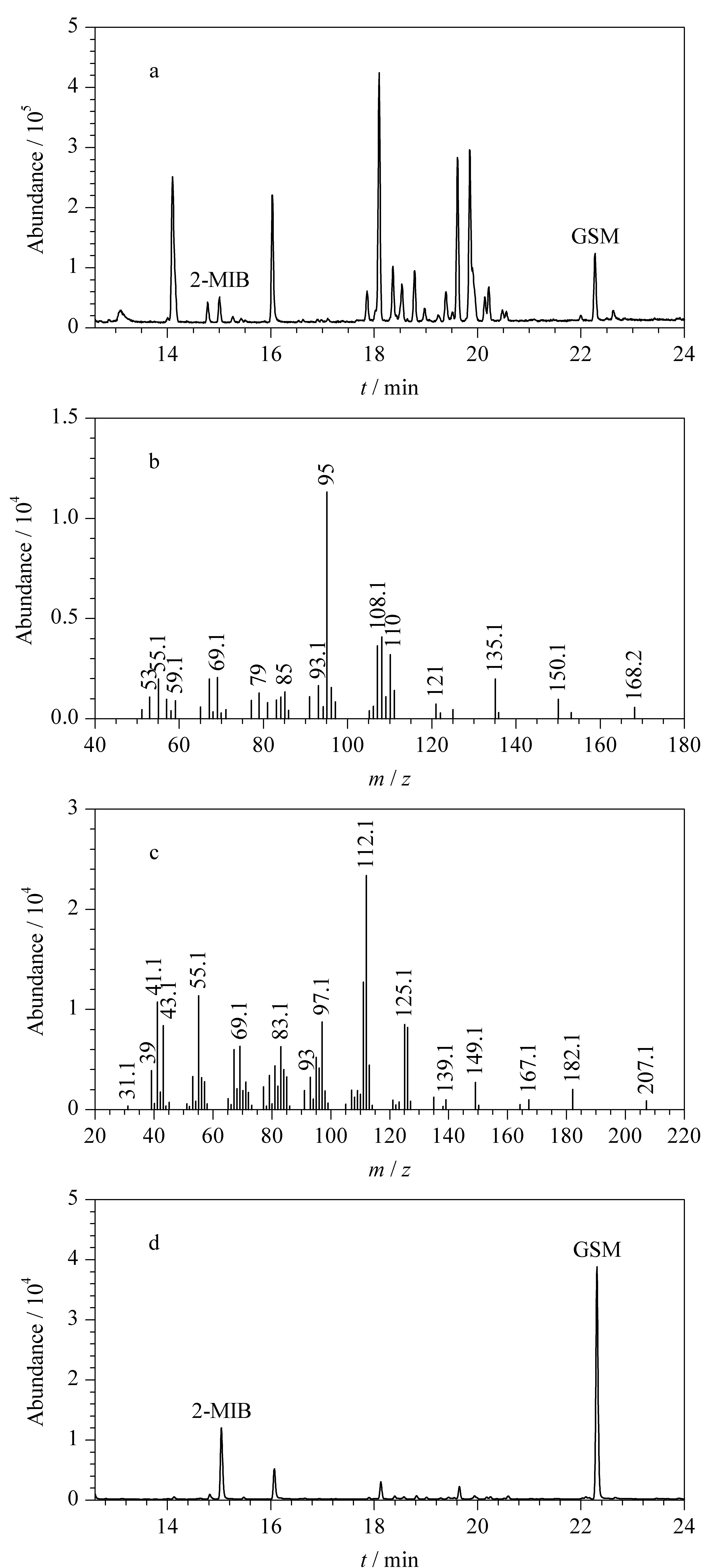
图 1 2-甲基异莰醇和土臭素的色谱图与质谱图Fig. 1 Chromatograms and mass spectra of 2-MIB and GSM a. full scan chromatogram (m/z 20-250); b. mass spectrum of 2-MIB; c. mass spectrum of GSM; d. SIM scan chromatogram (2-MIB m/z 95, GSM m/z 112).
在初步选定的固相微萃取条件下,考虑到顶空固相微萃取会提取到水样中其他多种挥发性组分,起始气相色谱柱温不宜过高,分析时间不宜太短。经大量的实验,建立了1.2节中的分析方法。使用此分析方法,对质量浓度为500 ng/L的2-MIB和GSM混合标准水样进行了分析测定,实验结果如图1所示,2-MIB、GSM以及其他挥发性组分实现了良好的谱峰分离,目标化合物母离子的提取离子谱图表现为单一的色谱峰。为了进行保留时间验证,对扫描范围在m/z20~250的所有离子进行了总离子流图的采集(见图1a)。由2-MIB的特征离子m/z95、108和168(图1b)分析可知保留时间为15.1 min的色谱峰应为2-MIB,由GSM的特征离子m/z112、125和182(图1c)分析可知保留时间为22.3 min的色谱峰应为GSM。采用选择性离子扫描模式(SIM),以2-MIBm/z95和GSMm/z112为特征离子进行数据采集分析,结果见图1d。可以看出,全扫描模式下色谱基线噪声相对较大、干扰峰相对较多,不利于低浓度目标物的检测分析;SIM模式下色谱基线噪声低,同时降低了其他挥发性组分的干扰,SIM模式更适合于痕量目标物的检测分析。
2.2 固相微萃取条件的优化
2-MIB和GSM是相对分子质量较大、不溶于水、易挥发的天然萜烯醇类化合物,根据有机物与溶剂“相似相溶”原则,选择可吸附物质极性范围宽、相对分子质量较大的PDMS/DVB涂层萃取头。由于2-MIB和GSM挥发性较大,适合采用顶空萃取法。另外,添加无机盐可以降低挥发性有机物在水中的溶解度,适当升高萃取温度、延长平衡时间可使目标物在液-气-固三相间充分平衡,从而提高萃取效果和样品前处理方法的稳定性。所以本节在萃取头种类、活化方法、水浴液面高度、搅拌器转速、解吸温度、解吸时间等其他条件固定的基础上,通过考察目标物峰面积的变化,结合正交分析,选取加盐量、萃取时间、萃取温度等主要因素,确定最佳的顶空固相微萃取条件。
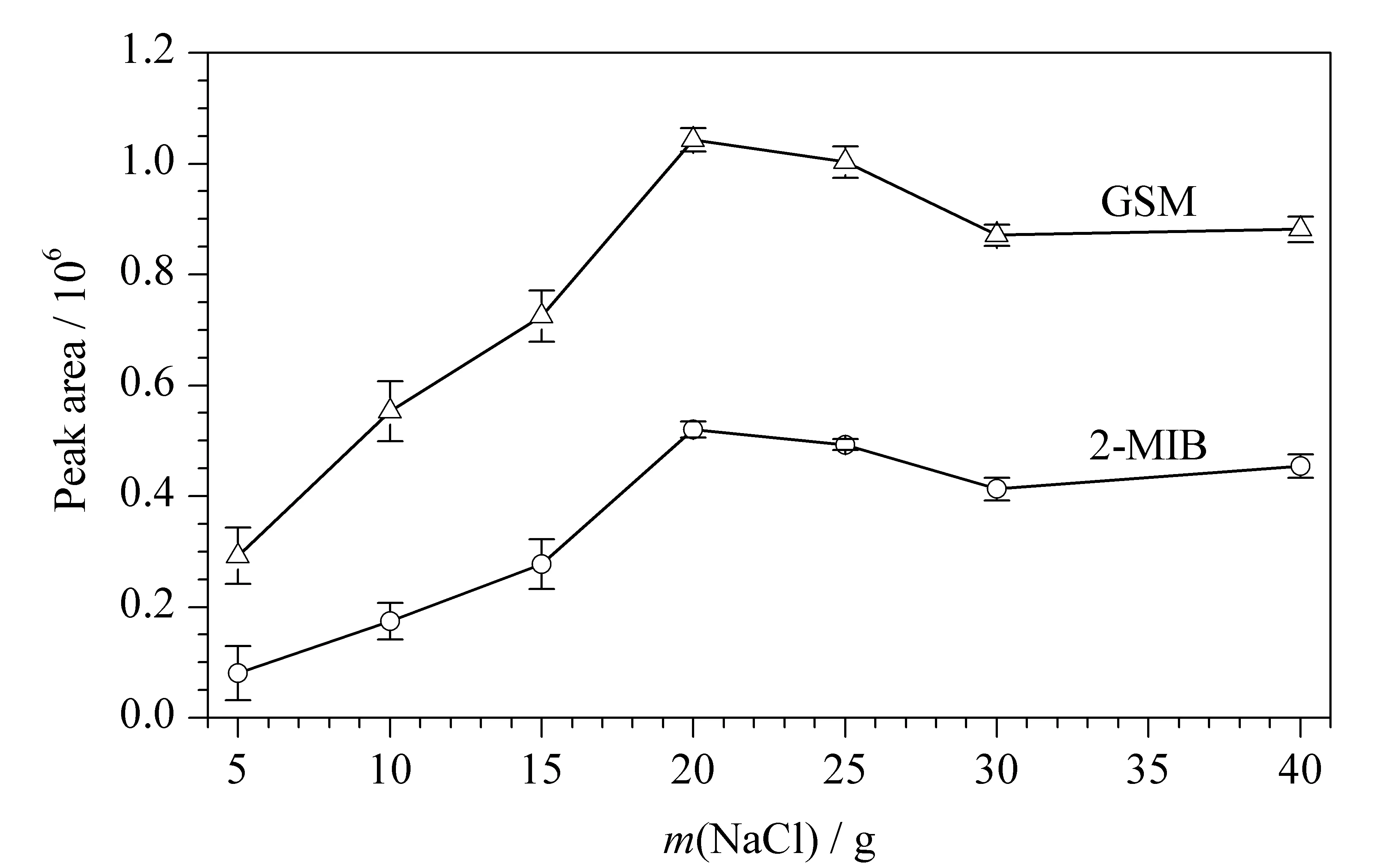
图 2 100 mL水样中加盐量对2-MIB、GSM萃取效果的影响(n=6)Fig. 2 Effect of salt amounts in 100 mL water sample on the extraction of 2-MIB and GSM (n=6)
2.2.1 NaCl用量的优化
无机盐的加入会降低目标物在液相中的溶解度,使得其更容易从液相中挥发出来,有利于萃取。在其他条件(萃取温度60 ℃、萃取时间30 min、搅拌速度1 200 r/min)不变的情况下,实验考察了每100 mL水样中NaCl添加量分别为5、10、15、20、25、30和40 g时对萃取效果的影响,如图2所示,结果发现NaCl加入量从5 g增加至20 g时,该萃取头对2-MIB和GSM的萃取量分别提高了5.4倍和2.5倍。当加盐量进一步增至25 g时,萃取头对这两种目标物的萃取效率均下降,可能是因为加盐量过大时无机盐的水合离子对2-MIB和GSM产生吸附作用导致其不易从液相中挥发出来造成萃取效率降低。这与李林等[18]的研究结果相似。因此,在样品进行顶空固相微萃取时,优化后的加盐量为每100 mL水样20 g。
2.2.2 萃取时间的优化
萃取时间是影响微萃取效率的关键因素。一般情况下,萃取时间的影响因素很多,如目标物扩散速度、分配系数、顶空体积、萃取温度等。在其他条件不变的情况下,设置萃取温度60 ℃,考察了不同萃取时间下目标物萃取量的变化,结果如图3所示。可以看出,50 min内萃取头对目标物的吸附量随萃取时间的增加而增大,60 min时已达到平衡,继续增加萃取时间至70 min,目标物组分中2-MIB的峰面积响应值未显著增加(数值在误差限值之内),考虑到节约分析时间方面的因素,选择60 min为优化的萃取时间。
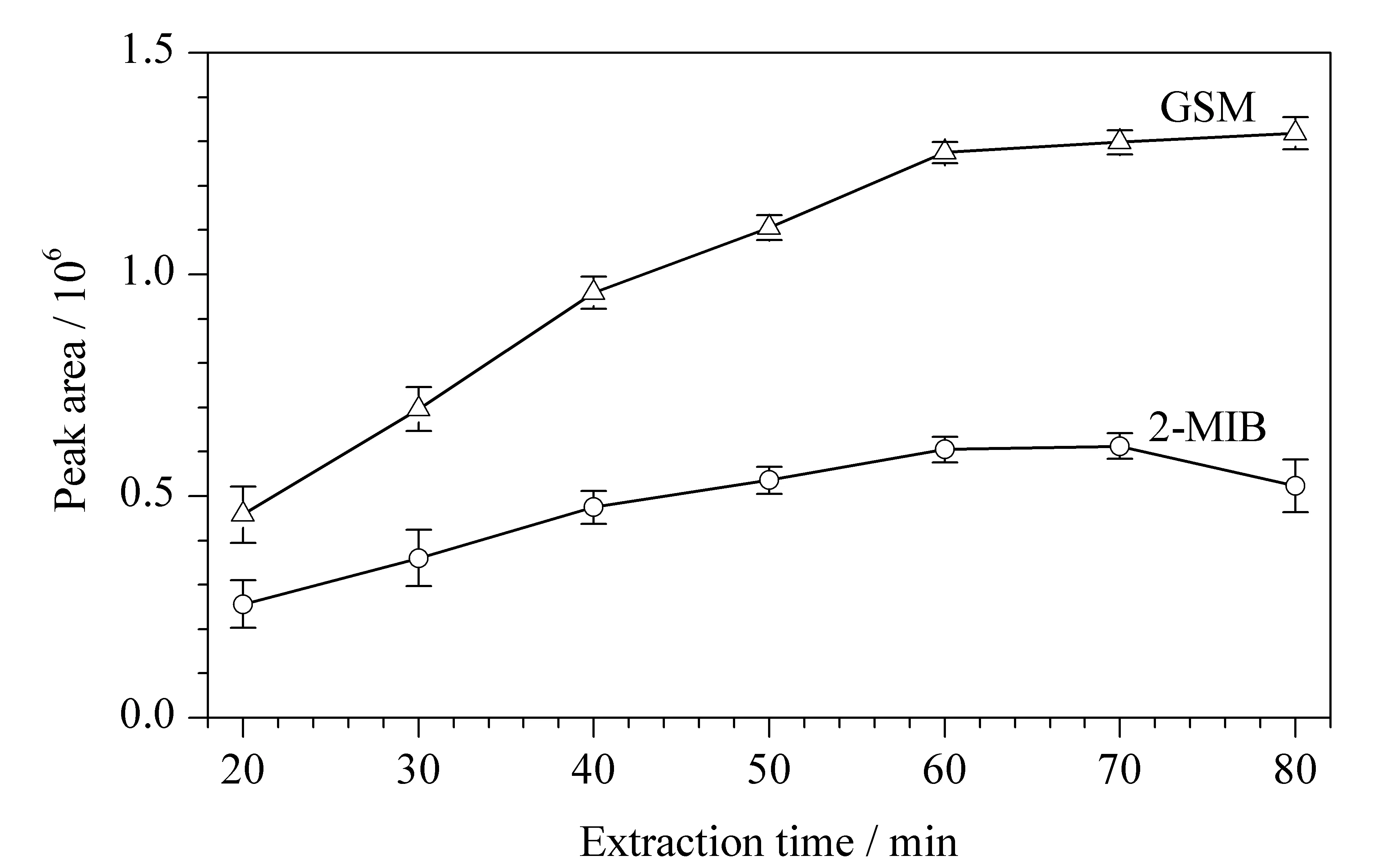
图 3 萃取时间对2-MIB、GSM萃取效果的影响(n=6)Fig. 3 Effect of extraction time on the extraction of 2-MIB and GSM (n=6)
2.2.3 萃取温度的优化
适当提高萃取温度可以促进目标物从液相中挥发出来,从而加速传质过程提高萃取效率,缩短固相微萃取平衡时间。因此,温度也是影响萃取速度和效率的一个重要因素。本实验在其他条件不变的情况下,研究了35、45、55、65和75 ℃时萃取头对目标物萃取量的变化,如图4所示。结果表明,65 ℃以内萃取头对目标物组分的萃取量随着温度的增加而逐渐增加,且对GSM的萃取量大于2-MIB。当温度超过65 ℃时,萃取头对GSM的萃取量增加,但对2-MIB的萃取量则开始减少。另外,实验发现萃取温度过高会使得顶空水蒸气在萃取头上凝结影响目标物分析。综合考虑,将萃取温度设定为65 ℃。
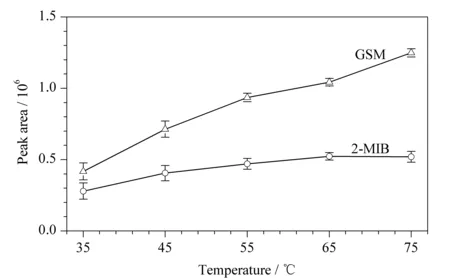
图 4 萃取温度对2-MIB、GSM萃取效果的影响(n=6)Fig. 4 Effect of temperature on the extraction of 2-MIB and GSM (n=6)
2.2.4 正交分析确定SPME条件
传统的单因素实验只以某单个因素为变量,在其他因素固定的情况下优化它对目标物的分析,忽略了多个因素的相互作用对目标物分析的影响[19]。本研究在上述单因素实验的基础上,按照“均匀分散,齐整可比”的原则选取上述单因素实验点,通过正交试验,综合考虑了多种因素的共同作用,验证确认了目标分析物2-MIB、GSM的最佳实验条件。根据上述单因素实验,选取温度(60、65和70 ℃)、加盐量(每100 mL水样分别为20、25、30 g)、萃取时间(40、50、60 min)作为正交因素进行三因素三水平的正交分析实验L9(33),结果如图5所示。由图5可以看出在萃取温度65 ℃、每100 mL水样加盐量NaCl 25 g、萃取时间60 min时,目标物2-MIB和GSM的色谱响应峰面积均达到最大值。

图 5 顶空固相微萃取2-MIB和GSM的正交实验结果(n=6)Fig. 5 Orthogonal experiment results for SPME extraction of 2-MIB and GSM (n=6) For salt amount, extraction time and extraction temperature are as follows: 1. 20 g NaCl, 40 min, 60 ℃; 2. 25 g NaCl, 50 min, 60 ℃; 3. 30 g NaCl, 60 min, 60 ℃; 4. 20 g NaCl, 50 min, 65 ℃; 5. 25 g NaCl, 60 min, 65 ℃; 6. 30 g NaCl, 40 min, 65 ℃; 7. 20 g NaCl, 60 min, 70 ℃; 8. 25 g NaCl, 40 min, 70 ℃; 9. 30 g NaCl, 50 min, 70 ℃.
综上所述,最佳的顶空固相微萃取条件为在40 mL萃取瓶中加入20 mL目标物水样和5 g NaCl,磁力搅拌器转速设为1 200 r/min,使用PDMS/DVB萃取头在水浴65 ℃平衡10 min后萃取60 min,于250 ℃色谱进样口中解吸3 min。
2.3 方法的标准曲线、检出限和回收率
在优化的固相微萃取和确定的GC-MS条件下,对按1.3.1节所述方法配制的2-MIB、GSM系列混合标准工作溶液进行SPME-GC-MS分析,以峰面积y为纵坐标、质量浓度x(ng/L)为横坐标绘制标准工作曲线,得到在5~1 000 ng/L范围内2-MIB的线性方程y=4 084x+28 643(r2=0.999)与GSM的线性方程y=11 724x+23 088(r2=0.998),表明各土霉嗅味物在其相应的质量浓度范围内线性关系良好。
采用在超纯水中添加目标化合物的方法,依据3倍信噪比确定检出限,10倍信噪比确定本方法的定量限[20]。以5 ng/L标准溶液的色谱峰为参照,实验结果显示,2-MIB和GSM的检出限分别为0.72 ng/L和0.34 ng/L,方法定量限分别为2.40 ng/L和1.13 ng/L,均低于人类对这两种土霉物质的嗅味阈值10 ng/L。
使用在超纯水中添加目标化合物的方法测定加标回收率,评价方法的可靠性。分别添加2-MIB低(10.0 ng/L)、中(130.0 ng/L)、高(600.0 ng/L)3个水平,GSM低(10.0 ng/L)、中(130.0 ng/L)、高(600.0 ng/L)3个水平,每个水平分别取6份样品进行平行实验,按照1.2节方法进行GC-MS测定,外标法定量。计算各目标化合物在空白样品中的加标回收率见表1。2-MIB低、中、高3个水平的加标回收率范围为94.8%~107.7%,相对标准偏差(RSD)低于6.1%; GSM低、中、高3个水平的加标回收率范围为93.6%~96.4%,相对标准偏差(RSD)低于5.8%。表明所建立的顶空固相微萃取-气相色谱-质谱联用测定水中2-MIB、GSM的方法比较稳定、准确、可靠,可以用于水中痕量土霉嗅味物质的检测。
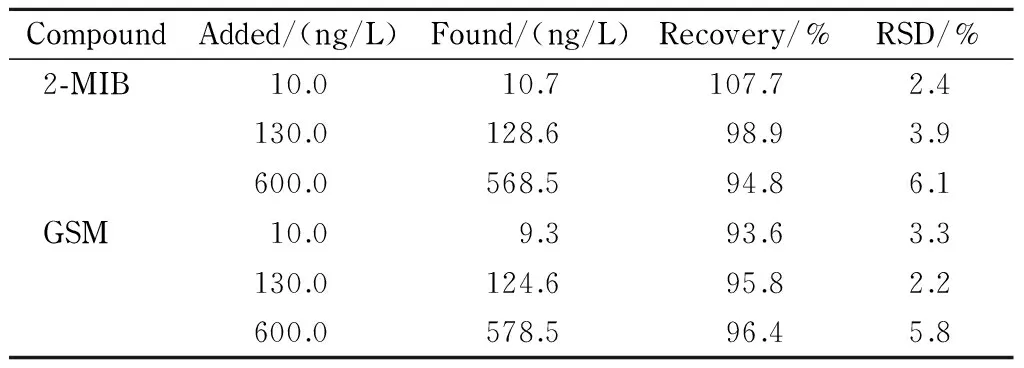
表 1 超纯水中2-MIB和GSM的加标回收率及RSD (n=6)Table 1 Spiked recoveries and RSDs of 2-MIB and GSM in pure water (n=6)
2.4 实际样品的测定
采集辽宁省某地区水库水、水库附近土壤、居民自来水样品,按照本文建立的方法平行测定6次,分析其中2-MIB和GSM的含量。表2为使用外标法定量的水库水、水库附近土壤、居民自来水的测定结果。由表2可知,除居民自来水中的目标嗅味物质未检出外,水库水中两种目标嗅味物质的质量浓度范围为3.0~3.6 ng/L,均低于人类嗅味阈值;水库附近土壤样品水提液中的2-MIB低于人类嗅味阈值(8.1 ng/L),但提取的GSM高于人类嗅味阈值(17.8 ng/L)。各组分6次平行测定的相对标准偏差(RSD)为2.7%~6.9%,表明该方法重现性较好,适合饮用水相关样品中2-MIB和GSM的检测分析。

表 2 辽宁省某地区水库水、水库附近土壤水提液、居民自来水中 2-MIB、GSM的测定结果(n=6)Table 2 Analytical results of 2-MIB, GSM in the reservoir water, water extract of soil near reservoir, tap water in Liaoning Province (n=6)
ND: not detected.
3 结论
结合正交分析法,本文在优化的顶空固相微萃取条件基础上,使用气相色谱-质谱联用方法测定了饮用水相关样品中痕量土霉味物质2-甲基异莰醇和土臭素,获得了很好的分析效果。采用质谱选择离子扫描可以排除其他化合物的干扰,降低背景噪声,提高分析方法的灵敏度,检出限和定量限均达到了ng/L水平,可以准确检测出样品中的痕量土霉嗅味物质。该方法具有灵敏、简便、准确度高、重现性好、无需使用有机溶剂等优点,适合于饮用水中2-MIB和GSM的同时检测分析,为我国饮用水嗅味物质污染突发事件提供了分析技术支持和必要的基础数据。
[1] Sun D L, Yu J W, An W, et al. J Environ Sci, 2013, 25(3): 460
[2] Klausen C, Nicolaisen M H, Strobel B W, et al. FEMS Microbiol Ecol, 2005, 52(2): 265
[3] Li Z L, Hobson P, An W, et al. Water Res, 2012, 46(16): 5165
[4] Korth W, Ellis J, Bowmer K. Water Sci Technol, 1992, 25(2): 115
[5] Suffet I H, Schweitzer L, Khiari D. Rev Environ Sci Bio, 2004, 3: 3
[6] GB 5749-2006
[7] Bartels J H M, Brady B M, Suffet I H. J AWWA, 1987, 79(1): 26
[8] Shin H S, Ahn H S. Chromatographia, 2004, 59: 107
[9] Li F A. Water Technology (李福安. 供水技术), 2012, 6(4): 54
[10] Manickum T, John W. Hydrol Current Res, 2012, 3(3): 1000134
[11] Manickum T, John W, Malungana M P. Hydrol Current Res, 2011, 2(5): 121. DOI: 10.4172/2157-7587.1000121
[12] Watson S B, Brownlee B, Satchwill T, et al. Water Res, 2000, 34(10): 2818
[13] Wu D Y, Duirk S E. Chemosphere, 2013, 91: 1495
[14] Wu J H, Wang Z H, Wang B, et al. Chinese Journal of Chromatography (吴金浩, 王召会, 王摆, 等. 色谱), 2013, 31(12): 1218
[15] Yu J W, An W, Cao N, et al. J Environ Sci, 2014, 26: 1389
[16] Ma X Y, Gao N Y, Li Q S, et al. Environmental Pollution and Control (马晓雁, 高乃云, 李青松. 环境污染与防治), 2006, 28(8): 631
[17] Ding Z, Peng S F, Xia W W, et al. Int J Environ Anal Chem, 2014: 697260. http://dx.doi.org/10.1155/2014/697260
[18] Li L, Song L R, Gan N Q, et al. Chinese Journal of Analytical Chemistry (李林, 宋立荣, 甘南琴, 等. 分析化学), 2005, 33(8): 1058
[19] Peng S F, Ding Z, Xia W W, et al. J Anal Methods Chem, 2013: 340658. http://dx.doi.org/10.1155/2013/340658
[20] Wei H R, Yi X B, Tan Y, et al. Chinese Journal of Chromatography (魏海蓉, 易锡斌, 谭钺, 等. 色谱), 2015, 33(6): 577
欢迎订阅 欢迎投稿 欢迎刊登广告
《分析测试学报》
国内刊号: CN 44-1318/TH
国际标准刊号: ISSN 1004-4957
国际刊名化代码CODEN: FCEXES 邮发代号:46-104
国外代号: BM 6013 广告经营许可证:440000100186
《分析测试学报》是由中国广州分析测试中心、中国分析测试协会共同主办的全国性学术刊物,中文核心期刊。刊登质谱学、光谱学、色谱学、波谱学、电化学、电子显微学等方面的分析测试新理论、新方法、新技术的研究成果,介绍新仪器装置及在生物、医药、化学化工、商检、食品检验等方面实用性强的实验技术。适合科研院所、高等院校、检测机构、医药、卫生以及厂矿企业分析测试工作和管理人员阅读。
经过多年的发展,本刊已成为国内知名的化学类核心期刊。2015年,影响因子为1.227,在全国化学类38种核心刊物中排名第4,被引频次为2502,稿源丰富,基金论文比超过70%。近几年,本刊刊发的论文被CA(美国化学文摘)收录率达94%, 2006年引文频次在CA千种表中国部分中列第38名,并被国际上其他知名的数据库如日本科技文献速报、俄罗斯文摘、英国分析文摘(AA)、《质谱公报》等收录。在《中文核心期刊要目总览》2011年版的化学类期刊列第9位;入选2012年度“中国国际影响力优秀学术期刊”;进入由全国8000种期刊遴选出的500种科技期刊组成的“中国科技期刊精品数据库”;本刊是中国学术期刊综合评价数据库(CAJCED)统计刊源;中国科技论文统计源期刊(中国科技核心期刊); 《中国科学引文数据库》来源期刊;中国期刊全文数据库(CJFD)收录期刊;《中国核心期刊(遴选)数据库》收录;《中国学术期刊(光盘版)》全文收录期刊;《中国期刊网》全文收录期刊;《中国学术期刊文摘(中、英文版)》源期刊。
本刊为月刊,国内外公开发行。大16开,单价:18.00元/册,全年216元。请在全国各地邮局订阅。未在邮局订到者可直接向本编辑部补订。补订办法:请从邮局汇款至广州市先烈中路100号《分析测试学报》编辑部,邮编:510070,写明订户单位、详细地址、收刊人姓名、邮编及补订份数(全年或某期),电话:(020)87684776或37656606,http://www.fxcsxb.com(可在线投稿),E-mail:fxcsxb@china.com。
分析测试学报编辑部 供稿
Determination of 2-methylisoborneol and geosmin in drinking water using headspace solid phase micro-extraction coupled with gas chromatography-mass spectrometry
CHENG Jianguo1, LIU Kaiying1*, BAI Mindong1,2*, CHENG Chao1,YU Yixuan1, ZHOU Xinying1
(1.DalianMaritimeUniversity,Dalian116026,China; 2.XiamenUniversity,Xiamen361102,China)
The odorous compounds of 2-methylisoborneol (2-MIB) and geosmin (GSM) heavily produced and released in water source are one of the most important factors leading to off-flavor emergencies and resident water consumption panic in drinking water. A headspace solid phase micro-extraction (HS-SPME) combined with gas chromatography-mass spectrometry (GC-MS) method was established for the simultaneous determination of these two trace earthy and musty compounds in reservoir water, reservoir soil and tap water. The conditions of HS-SPME, such as salt amount, extraction time and extraction temperature, were optimized based on orthogonal analysis. The qualitative and quantitative analyses of 2-MIB and GSM were carried out in the electron impact (EI)-selective ion scanning mode. The results showed that the linear relationship between peak area and concentration of 2-MIB and GSM was good enough (r2≥0.998) from 5 to 1 000 ng/L, the limits of detection were 0.72 ng/L for 2-MIB, 0.34 ng/L for GSM and the limits of quantification were 2.40 ng/L for 2-MIB, 1.13 ng/L for GSM. When the target samples spiked in the range of 10-600 ng/L, the average recoveries of the target compounds were 93.6%-107.7% (RSD≤6.1%,n=6). Based on the above method, the target compounds in reservoir water, reservoir soil and tap water in a certain region of Liaoning Province were analyzed. The results showed that the two target odors in reservoir water were 3.0-3.6 ng/L. As for the extract of the soil around the reservoir, 2-MIB was 8.1 ng/L and GSM was 17.8 ng/L. The odorous substances were not detected in the tap water. This method is simple, accurate, reliable, highly sensitive and no need of organic solvents. And it is suitable for the detection of 2-MIB and GSM in drinking water.
headspace solid phase micro-extraction (HS-SPME); gas chromatography-mass spectrometry (GC-MS); 2-methylisoborneol (2-MIB); geosmin (GSM); drinking water; orthogonal analysis
10.3724/SP.J.1123.2015.08031
国家科技支撑计划项目(2013BAC06B00);国家高技术研究发展计划(“863”计划)项目(2012AA062609);辽宁省重点实验室基础研究项目(LZ2015008);中央高校基本科研业务费专项资金(3132015140).
2015-08-26
O658
A
1000-8713(2015)12-1287-07
* 通讯联系人.Tel:(0411)84727681,E-mail:kyliu@cas.dicp.ac.cn(刘开颖);Tel:(0411)84728920,E-mail:mindong-bai@163.com(白敏冬).

